
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соли азотной кислоты и их свойства
Соли азотной кислоты, нитраты, образуются при взаимодействии кислоты с металлами, оксидами металлов, основаниями, аммиаком, а также с некоторыми солями. Нитраты - твердые кристаллические вещества, хорошо растворяются в воде, сильные электролиты. При нагревании разлагаются с выделением кислорода. Имеет ряд специфических свойств как окислителя. В зависимости от характера металла, реакция разложения протекает по-разному. Качественную реакцию на нитрат-ион (растворы азотной кислоты и ее соли) проводят так: в пробирку с исследуемым веществом добавляют медные стружки, доливают концентрат серной кислоты и нагревают. Выделение бурого газа свидетельствует о наличии нитрат-иона. Качественная реакция на твердые нитраты: щепотку соли бросают в огонь горелки, и если соль является нитратом, то произойдет яркая вспышка вследствие разложения соли с выделением кислорода. Применение азотной кислоты и ее солей Азотная кислота является одним из крупнотоннажных и важных продуктов химической промышленности. Ее широко применяют для производства удобрений, бездымного пороха, взрывчатых веществ, лекарств, красителей, пластмасс. Ее соли применяют в пиротехнике; для производства удобрений, взрыввеществ, некоторых оксидов металлов. Фосфор Фосфор относится к элементам-неметаллам. По числу электронов и по электронной конфигурации (3s2 3p3) атом фосфора является аналогом азота. Но по сравнению с атомом азота атом фосфора имеет больший радиус, меньшую энергию ионизации и ОЭО, поэтому у фосфора неметаллические свойства проявляются слабее. Степени окисления: - 3,+3,+5. У фосфора в свободном состоянии образуются аллотропные модификации: белый, красный и черный фосфор. Аллотропные видоизменения взаимосвязаны и могут переходить друг в друга. Фосфор в реакциях может быть как восстановителем, так и окислителем. В реакциях с активными металлами фосфор приобретает степень окисления - 3.
Продуктами реакции являются фосфиды (непрочные соединения, легко разлагаются водой с образованием PH3
Соединения фосфора Соединения фосфора с водородом представляет собой газообразный фосфористый водород, или фосфин PH3(бесцветный ядовитый газ с чесночным запахом, воспламеняется на воздухе).
У фосфора несколько оксидов: оксид фосфора (III) P2 O3 (белое кристаллическое вещество, образуется при медленном окислении фосфора в условиях недостатка кислорода, ядовит) и оксид фосфора (V) P2 O5 (образуется из P2 O3при его нагревании, растворим в воде с образованием фосфористой кислоты средней силы) наиболее важные. Наиболее характерный свойством второго является гигроскопичность (поглощение паров воды из воздуха), при этом он расплывается аморфную массу HPO3. При кипячении P2 O5 образуется фосфорная кислота H3 PO4 (белое кристаллическое вещество, расплывается на воздухе, tпл =42,35о С,не ядовита, растворима в воде, электролит, получают, окисляя 32%-ую азотную кислоту). Фосфаты почти всех металлов (кроме щелочных) нерастворимы в воде. Дигидрофосфаты хорошо растворимы в воде. Применение фосфора и его соединений Большое количество фосфора идет на производство спичек, белый фосфор широко используется при создании зажигательных снарядов, дымовых шашек, снарядов и бомб, соли фосфорной кислоты применяются в сельском хозяйстве как фосфорные удобрения. Соединения фосфора Оксиды Фосфор образует несколько оксидов. Важнейшими из них являются оксид фосфора (V) P4 O10 и оксид фосфора (III) P4 O6. Часто их формулы пишут в упрощённом виде – P2 O5 и P2 O3. В структуре этих оксидов сохраняется тетраэдрическое расположение атомов фосфора. Оксид фосфора (III) P4 O6 – воскообразная кристаллическая масса, плавящаяся при 22,5°С и превращающаяся при этом в бесцветную жидкость. Ядовит. При растворении в холодной воде образует фосфористую кислоту: P4 O6 + 6H2 O = 4H3 PO3, а при реакции со щелочами – соответствующие соли (фосфиты). Сильный восстановитель. При взаимодействии с кислородом окисляется до Р4 О10. Оксид фосфора (III) получается окислением белого фосфора при недостатке кислорода. Оксид фосфора (V) P4 O10 – белый кристаллический порошок. Температура возгонки 36°С. Имеет несколько модификаций, одна из которых (так называемая летучая) имеет состав Р4 О10. Кристаллическая решётка этой модификации слагается из молекул Р4 О10, связанных между собой слабыми межмолекулярными силами, легко разрывающимися при нагревании. Отсюда и летучесть этой разновидности. Другие модификации полимерны. Они образованы бесконечными слоями тетраэдров РО4.
При взаимодействии Р4 О10 с водой образуется фосфорная кислота: P4 O10 + 6H2 O = 4H3 PO4. Будучи кислотным оксидом, Р4 О10 вступает в реакции с основными оксидами и гидроксидами. Образуется при высокотемпературном окислении фосфора в избытке кислорода (сухого воздуха). Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратируюшего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием её ангидрида: 4HClO4 + P4 O10 = (HPO3)4 + 2Cl2 O7. Кислоты и их соли а) Фосфористая кислота H3 PO3. Безводная фосфористая кислота Н3 РО3 образует кристаллы плотностью 1,65 г/см3, плавящиеся при 74°С. Структурная формула:
При нагревании безводной Н3 РО3 происходит реакция диспропорционирования (самоокисления-самовосстановления): 4H3 PO3 = PH3 ↑ + 3H3 PO4. Соли фосфористой кислоты – фосфиты. Например, K3 PO3 (фосфит калия) или Mg3 (PO3)2 (фосфит магния). Фосфористую кислоту Н3 РО3 получают растворением в воде оксида фосфора (III) или гидролизом хлорида фосфора (III) РCl3: РCl3 + 3H2 O = H3 PO3 + 3HCl↑. б) Фосфорная кислота (ортофосфорная кислота) H3 PO4. Безводная фосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35°С. С водой фосфорная кислота образует растворы любых концентраций. Фосфорной кислоте соответствует следующая структурная формула:
Фосфорная кислота реагирует с металлами, расположенными в ряду стандартных электродных потенциалов до водорода, с основными оксидами, с основаниями, с солями слабых кислот. В лаборатории фосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой: 3P + 5HNO3 + 2H2 O = 3H3 PO4 + 5NO↑. В промышленности фосфорную кислоту получают двумя способами: экстракционным и термическим. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой: Ca3 (PO4)2 + 3H2 SO4 = 2H3 PO4 + 3CaSO4 ↓. Фосфорная кислота затем отфильтровывается и концентрируется упариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4 О10 и растворением последнего в воде. Производимая по данному методу фосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых). Фосфорную кислоту используют для производства удобрений, для приготовления реактивов, органических веществ, для создания защитных покрытий на металлах. Очищенная фосфорная кислота нужна для приготовления фармацевтических препаратов, кормовых концентратов. Фосфорная кислота не является сильной кислотой. Как трёхосновная кислота, в водном растворе диссоциирует ступенчато. Легче идет диссоциация по первой ступени. 1. H3 PO4 2. 3. Суммарное ионное уравнение диссоциации фосфорной кислоты: H3 PO4
Фосфорная кислота образует три ряда солей: а) K3 PO4, Ca3 (PO4)2 – трёхзамещённые, или фосфаты; б) K2 HPO4, CaHPO4 – двухзамещённые, или гидрофосфаты; в) KH2 PO4, Ca(H2 PO4)2 – однозамещённые, или дигидрофосфаты. Однозамещенные фосфаты имеют кислую реакцию, двухзамещённые – слабощелочную, трехзамещённые – щелочную. Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворяется в воде лишь дигидрофосфат кальция. Гидрофосфат кальция и фосфат кальция растворимы в органических кислотах. При нагревании фосфорная кислота вначале теряет воду – растворитель, затем начинается дегидратация фосфорной кислоты и образуется дифосфорная кислота: 2H3 PO4 = H4 P2 O7 + H2 O. Значительная часть фосфорной кислоты превращается в дифосфорную при температуре около 260°С. в) Фосфорноватая кислота (гипофосфорная кислота) H4 P2 O6.
H4 P2 O6 – четырёхосновная кислота средней силы. При хранении гипофосфорная кислота постепенно разлагается. При нагревании её растворов превращается в Н3 РО4 и Н3 РО3. Образуется при медленном окислении Н3 РО3 на воздухе или окислении белого фосфора во влажном воздухе. г) Фосфорноватистая кислота (гипофосфористая кислота) H3 PO2. Эта кислота одноосновная, сильная. Фосфорноватистой кислоте соответствует следующая структурная формула:
Гипофосфиты – соли фосфорноватистой кислоты – обычно хорошо растворимы в воде. Гипофосфиты и Н3 РО2 – энергичные восстановители (особенно в кислой среде). Их ценной особенностью является способность восстанавливать растворённые соли некоторых металлов (Ni, Cu и др.) до свободного металла: 2Ni2+ + Получается фосфорноватистая кислота разложением гипофосфитов кальция или бария серной кислотой: Ba(H2 PO2)2 + H2 SO4 = 2H3 PO2 + BaSO4 ↓. Гипофосфиты образуются при кипячении белого фосфора в суспензиях гидроксидов кальция или бария. 2P4 (белый) + 3Ba(OH)2 + 6H2 O = 2PH3 ↑ + 3Ba(H2 PO2)2. Фосфин Фосфин PH3 – соединение фосфора с водородом – бесцветный газ с резким неприятным чесночным запахом, хорошо растворимый в воде (химически с ней не взаимодействует), очень ядовит. На воздухе чистый и сухой фосфин загорается при нагревании выше 100-140°С. Если фосфин содержит примеси дифосфина Р2 Н4, он самовоспламеняется на воздухе. При взаимодействии с некоторыми сильными кислотами фосфин образует соли фосфония, например: PH3 + HCl = PH4 Cl (хлорид фосфония). Строение катиона фосфония [РН4 ]+ аналогично строению катиона аммония [NН4 ]+.
Вода разлагает соли фосфония с образованием фосфина и галогеноводорода. Фосфин может быть получен при взаимодействии фосфидов с водой: Ca3 P2 + 6H2 O = 3Ca(OH)2 + 2PH3 ↑. И последнее. При взаимодействии фосфора с металлами образуются соли – фосфиды. Например, Ca3 P2 (фосфид кальция), Mg3 P2 (фосфид магния). Углерод Углерод находится в природе, как в свободном состоянии, так и виде соединений. Свободный углерод встречается в виде алмаза и графита. Некоторые из ископаемых углей содержат до 99 % углерода. Кроме ископаемого угля, в недрах Земли находятся большие скопления нефти, представляющие собой в основном смесь углеводородов. Хотя содержание углерода в земной коре мало (0.09 %), этот элемент, наряду с азотом, серой и фосфором является основой жизни на Земле. По разнообразию своих соединений углерод занимает особое место в химии. В настоящее время число изученных соединений углерода оценивается примерно в 2 млн, тогда как соединения всех остальных элементов, вместе взятые, исчисляются лишь сотнями тысяч. Алмаз-бесцветное, прозрачное вещество, чрезвычайно сильно преломляющее лучи света. Из всех простых веществ он имеет максимальное число атомов, приходящихся на единицу объема. С этим, а также с большой прочностью связи между атомами углерода связано то, что по твердости алмаз превосходит все известные вещества. Будучи весьма твердым, алмаз в то же время хрупок, и его можно растереть в порошок в стальной ступке. Отшлифованные прозрачные алмазы называются бриллиантами. Алмаз имеет низкую реакционную способность. Он горит в кислороде только при 8000, превращаясь в двуокись углерода с сильным выделением света (Лавуазье). Кислоты, основания и галогены не реагируют с алмазом, но раствор хлорки (гипохлорита кальция) его окисляет. При низких температурах уголь и графит относительно инертны, хотя известны случаи самовозгорания больших масс угля. При нагревании их активность увеличивается. Уголь служит хорошим восстановителем, отнимая кислород у оксидов металлов. Таким образом, выплавляют многие металлы MemOn + n/2C = mMe + n/2CO2 При сгорании на воздухе углерод образует два соединения: углекислый газ CO2 при избытке кислорода C + O2 = CO2 и угарный газ СО при его недостатке C + 1/2O2 = CO Угарный газ не имеет цвета и запаха. При его вдыхании кровь человека насыщается этим газом, что приводит к сильному снижению концентрации кислорода в крови, человек при этом засыпает, и во сне наступает смерть от удушья. Подобные случаи известны жителям загородных домов, где есть печка или банька. На солнечном свету или в присутствии активного угля (катализатор) оксид углерода непосредственно соединяется с хлором, образуя чрезвычайно ядовитый газ- фосген СO + Cl2 = COCl2 При пожарах в помещениях из-за недостатка кислорода образуется угарный газ, а из полимерных материалов, содержащих хлор, может выделяться молекулярный хлор. При взаимодействии этих газов при пожаре может образовываться фосген.
При очень высоких температурах углерод соединяется с водородом, серой, кремнием, бором и многими металлами. Соединения металлов с углеродом называются карбидами. Карбиды - кристаллические тела. Природа химической связи в них может быть различной. Так, многие карбиды металлов главных подгрупп I, II и III групп периодической системы представляют собой солеобразные соединения с преобладанием ионной связи. К их числу относятся карбиды алюминия Al4C3 и кальция СаС2. При взаимодействии с водой эти карбиды (неорганические соединения) дают метан и ацетилен (органические соединения) Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 CaC2 + 2H2O = Ca(OH)2 + C2H2
При взаимодействии карбида магния Mg2C3 с водой получается более сложное органическое соединение пропин (метилацетилен) СH3-CºCH. В карбидах кремния SiC и бора B4C связь меду атомами ковалентная. Эти вещества характеризуются высокой твердостью, тугоплавкостью и химической инертностью. Большинство металлов побочных подгрупп IV-VIII групп образуют карбиды, связь в которых близка к металлической, вследствие чего эти карбиды в некоторых отношениях сходны с металлами, например, обладают значительной электрической проводимостью. Они характеризуются также высокой твердостью и тугоплавкостью; карбиды этой группы применяются в ряде отраслей промышленности. Большинство ценных свойств чугунов и сталей обусловлены присутствием в них карбида железа Fe3C. При растворении углекислого газа в воде образуется очень слабая угольная кислота CO2 + H2O = H2CO3 Равновесие этой реакции сильно сдвинуто влево, лишь очень небольшое количество растворенного углекислого газа превращается в угольную кислоту. Со слабыми основаниями угольная кислота в большинстве случаев дает только основные соли. Встречающийся в природе минерал - (CuOH)2CO3 (основная соль), называется малахитом. Из солей угольной кислоты в природе распространен карбонат кальция CaCO3. Он встречается в виде известняка, мела и мрамора. В быту хорошо известен карбонат натрия-сода Na2CO3. Сода - один из главных продуктов химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности. Карбонат калия, или поташ, К2СО3 применяется для получения мыла, при изготовлении тугоплавкого стекла, в фотографии. При взаимодействии углекислого газа с аммиаком под давлением получают карбамид (мочевину) СO2 + 2NH3 = CO(NH2)2 + H2O Он используется в сельском хозяйстве в качестве азотного удобрения. На основе карбамида получают карбамидные пластики.
24 Круговорот углерода в природе Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на основе углеродного скелета. Атомы углерода постоянно мигрируют из одной части биосферы (узкой оболочки Земли, где существует жизнь) в другую. На примере круговорота углерода в природе можно проследить в динамике картину жизни на нашей планете.Основные запасы углерода на Земле находятся в виде содержащегося в атмосфере и растворенного в Мировом океане диоксида углерода, то есть углекислого газа (CO2). Рассмотрим сначала молекулы углекислого газа, находящиеся в атмосфере. Растения поглощают эти молекулы, затем в процессефотосинтеза атом углерода превращается в разнообразные органические соединения и таким образом включается в структуру растений. Далее возможно несколько вариантов:углерод может оставаться в растениях, пока растения не погибнут. Тогда их молекулы пойдут в пищуредуцентам (организмам, которые питаются мертвым органическим веществом и при этом разрушают его до простых неорганических соединений), таким как грибы и термиты. В конце концов углерод вернется в атмосферу в качестве CO2;растения могут быть съедены травоядными животными. В этом случае углерод либо вернется в атмосферу (в процессе дыхания животных и при их разложении после смерти), либо травоядные животные будут съедены плотоядными (и тогда углерод опять же вернется в атмосферу теми же путями);растения могут погибнуть и оказаться под землей. Тогда в конечном итоге они превратятся в ископаемое топливо — например, в уголь. Кремний и его соединения Второй представитель элементов главной подгруппы IV группы — кремний Si. В природе кремний — второй по распространенности после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. Наиболее распространенным соединением кремния является его диоксид SiO2, другое его название — кремнезем. В природе он образует минерал кварц (рис. 46) и многие разновидности, такие, как горный хрусталь и его знаменитая лиловая форма — аметист, а также агат, опал, яшма, халцедон, сердолик, которые известны как поделочные и полудрагоценные камни. Диоксид кремния — это также обычный и кварцевый песок. Из разновидностей минералов на основе диоксида кремния — кремня, халцедона и других первобытные люди изготовляли орудия труда. Именно кремень, этот невзрачный и не очень прочный камень, положил начало каменному веку — веку кремневых орудий труда. Причин этому две: распространенность и доступность кремня, а также его способность образовывать при сколе острые режущие края. Второй тип природных соединений кремния — это силикаты. Среди них наиболее распространены алюмосиликаты (понятно, что эти силикаты содержат алюминий). К алюмосиликатам относятся гранит, различные виды глин, слюды. Силикатом, не содержащим алюминий, является, например, асбест. Важнейшее соединение кремния — оксид SiO2 необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем. Кремний придает гладкость и прочность костям человека. Кремний входит и в состав низших живых организмов — диатомовых водорослей и радиолярий, — нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезема. Свойства кремния. Если вы пользуетесь микрокалькулятором с солнечной батарейкой, то, вероятно, имеете представление о кристаллическом кремнии. Это полупроводник. В отличие от металлов с повышением температуры его электропроводность увеличивается. На спутниках, космических кораблях и станциях устанавливают солнечные батареи, преобразующие солнечную энергию в электрическую. В них работают кристаллы полупроводников, и в первую очередь кремния. Кремниевые фотоэлементы могут превратить в электрическую до 10% поглощенной солнечной энергии. Кремний горит в кислороде, образуя известный уже вам диоксид кремния, или оксид кремния(1У): Si+ 02 = SiO2 Будучи неметаллом, при нагревании он соединяется с металлами с образованием силицидов, например: Si + 2Mg = Мg2 Si Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния — силан: Мg2 Si + 2Н2SO4 = 2MgSO4 + SiH4 В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды: SiH4 + 202 = SiO2 + 2Н2О Повышенная реакционная способность силана по сравнению с метаном СН4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи —Н слабее связей С—Н. Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород: Si + 2NаОН + Н20 = Na2SiО3 + 2Н2 Кремний получают, восстанавливая его из диоксида магнием или углеродом. Оксид кремния(IV), или диоксид кремния, или кремнезем, как и С02, является кислотным оксидом. Однако в отличие от С02 имеет не молекулярную, а атомную кристаллическую решетку. Поэтому SiO2 твердое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме, как вы знаете, плавиковой, но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты — силикатов. Силикаты можно получить также сплавлением диоксида кремния с оксидами металлов или с карбонатами: SiO2 + СаО = СаSiO3 SiO2 + СаС03 = СаSiO3 + С02 Силикаты натрия и калия называют растворимым стеклом. Их водные растворы — это хорошо известный силикатный клей. Из растворов силикатов действием на них более сильных кислот — соляной, серной, уксусной и даже угольной получается кремниевая кислота Н2SiO3: К2SiO3 + 2НСl = 2КСl + Н2SiO3 Следовательно, Н2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество — силикагелъ, широко применяемый в качестве адсорбента — поглотителя других веществ. Применение кремния. Вы уже знаете, что кремний применяют для получения полупроводниковых материалов, а также кислотоупорных сплавов. При сплавлении кварцевого песка с углем при высоких температурах образуется карбид кремния SiC, который по твердости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней. Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая может выдерживать высокую температуру и не трескается при резком охлаждении. Соединения кремния служат основой для производства стекла и цемента. Обычное оконное стекло имеет состав, который можно выразить формулой Nа20 • СаО • 6SiO2 Его получают в специальных стекловаренных печах сплавлением смеси соды, известняка и песка. Отличительная особенность стекла — способность размягчаться и в расплавленном состоянии принимать любую форму, которая сохраняется при застывании стекла. На этом основано производство посуды и других изделий из стекла.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1900; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.85.33 (0.083 с.) |
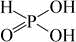 .
. .
. H+ +
H+ +  (дигидрофосфат-ион);
(дигидрофосфат-ион);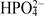 (гидрофосфат-ион);
(гидрофосфат-ион);
 (фосфат-ион).
(фосфат-ион). .
. .
. .
. + 2H2 O → Ni0 +
+ 2H2 O → Ni0 +  + 6H+.
+ 6H+.


