Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хроническая болезнь почек у детейСтр 1 из 12Следующая ⇒
Чингаева Г.Н.
Хроническая болезнь почек у детей Учебное пособие
Алматы, 2010 УДК 616.61-002.2053.5 БКК 57.3:569я 73 Ч 63
РЕЦЕНЗЕНТЫ: Канатбаева А.Б. – профессор кафедры детских болезней лечебного факультета с курсом неонатологии КазНМУ, д.м.н., главный внештатный детский нефролог РК Хусаинова Ш.Н. – главный научный сотрудник Научного центра педиатрии и детской хирургии МЗ РК, д.м.н., профессор Ч 63Чингаева Г.Н. Хроническая болезнь почек у детей. Учебное пособие. – Алматы. – 2009. – 96 с. ISBN 978-601-246-102-2 Учебное пособие отражает современный взгляд на этиологию, патогенез, диагностику и лечение различных стадий хронической болезни почек у детей. Учебное пособие предназначено резидентам, студентам, интернам педиатрического, лечебного факультетов и общей медицины.
ББК 57.3:569я 73
Одобрено и разрешено к печати членами комиссии ТОО «Республиканский центр инновационных технологий медицинского образования и науки»
№ 5 протокола от «24» мая 2010г.
Ó Г.Н. Чингаева, 2010г. Перечень сокращений
Оглавление
Введение Актуальность проблемы
Хроническая болезнь почек (ХБП) является одной из наиболее значимых медицинских и социально-экономических проблем современности. Традиционное представление о редкости хронических заболеваний почек сегодня полностью пересмотрено. Широкие популяционные исследования выявляют частые случаи их бессимптомного течения с клинической манифестацией только в стадии терминальной почечной недостаточности (ТПН). Признаками поражения почек в таких случаях являются - микроальбуминурия/изолированная протеинурия и снижение клубочковой фильтрации. По данным эпидемиологических исследований ТПН представляет собой «верхушку айсберга» при ХБП и предположительно количество пациентов с более ранними стадиями болезни, вероятно, превышает количество тех, кто достигает ТПН, более чем 50 раз. Социальная значимость ХБП заключается в продолжающемся росте ее распространенности, ранней инвалидизации больных. Количество больных с терминальной почечной недостаточностью в мире на 2001 год составляло 1 479.000, на 2004 год 1 783.000 человек (прирост ≈ 7%/в год). Соответственно с каждым годом непрерывно увеличивается и число больных на диализе. Если в 1990 году заместительную почечную терапию (ЗПТ) получали 426 000, то в 2000 году – 1 065 000, на конец 2004 года - 1 800 000 человек, в 2010 году прогнозируется увеличение до 2 095 000 больных.
Высокая стоимость ЗПТ и в связи с этим недостаточная доступность в большинстве регионов мира, в которых проживает 80% человечества, делают ХБП одной из проблем не только практической нефрологии, но и практического здравоохранения в целом. Экономическая стоимость североамериканских программ лечения ТПН на 2002 год достигла 25,2 миллиардов долларов, то есть увеличилась на 11,5% за предыдущий год, и, как ожидается, достигнет 29 миллиардов долларов к 2010 году. Решение задачи улучшения исходов у больных с ХБП требует скоординированного международного подхода, оценки распространенности заболевания, выявления его ранних стадий, предшествующих факторов риска, а также выявления и коррекции факторов риска неблагоприятных исходов. В последние годы современная нефрология столкнулась, по крайней мере, с тремя очень важными проблемами. Во-первых, наблюдается фактическое увеличение количества больных с хронической почечной патологией. Во-вторых, результаты этиологического и патогенетического лечения большинства ХБП остаются несовершенными. В-третьих, оба вышеперечисленных фактора привели к увеличению количества пациентов, которым требуется ЗПТ. Однако следует признать, что росту числа пациентов на ЗПТ способствовал и существовавший долгое время подход к вторичной профилактике ТПН у больных с хронической почечной патологией. Считалось, что поскольку рано или поздно применение ЗПТ все равно потребуется, то с достижением определенной степени снижения функции почек, прибегать к каким-либо специальным методам замедления прогрессирования патологического процесса в почечной ткани нет необходимости. Кроме того, на протяжении последних десятилетий непрерывно улучшалось качество технологий ЗПТ, что вызвало резкое увеличение продолжительности жизни больных, получающих такие методы лечения. Все это привело к тому, что потребовалось все больше и больше диализных мест или органов для трансплантации, катастрофически росли расходы. Организационные и финансовые проблемы, связанные с ЗПТ, начали превышать возможности даже высокоразвитых стран. Первая и необходимая предпосылка разработки оптимальной стратегии торможения ХБП и ее осложнений (рено- и кардиопротекции) – создание единой классификации стадий хронического заболевания почек (степени тяжести поражения почек). Придерживаясь долгосрочной стратегии, направленной на улучшение качества помощи для всех пациентов с заболеваниями почек Национальный почечный фонд (NKF/США) учредил в 1995 году Инициативу (по улучшению) качества лечения диализом (Dialysis Outcomes Quality Initiative – DOQI) для разработки Клинических практических рекомендаций для диализных пациентов и специалистов, оказывающих им помощь. Со времени публикации в 1997 году Рекомендации DOQI оказали существенное влияние на медицинскую помощь и исходы у диализных пациентов. K/DOQI в 2002 году предложила терминологию «хроническая болезнь почек». Инициативой K/DOQI ежегодно дополняются и уточняются основные направления диагностики и лечения ХБП.
Таким образом, ХБП в настоящее время является крупной проблемой практической нефрологии и практического здравоохранения. Большой процент детей развивает ХБП очень рано, в основном при врожденных аномалиях почек, являющихся ответственными почти за половину всех случаев. Альтернативой терминальной стадии ХБП является трансплантация почки, но в связи с недостаточностью средств здравоохранения и высокой смертностью в развивающемся мире ограничиваются условиями ЗПТ, что влияет на удельный вес пациентов с ТПН.
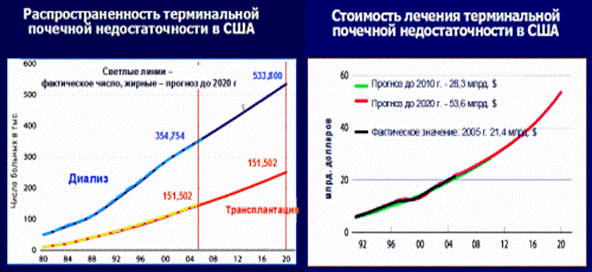
Хроническая болезнь почек занимает среди хронических неинфекционных болезней особое место, поскольку она широко распространена, связана с резким ухудшением качества жизни, высокой смертностью и в терминальной стадии приводит к необходимости применения дорогостоящих методов заместительной терапии – диализа и пересадки почки. Многие годы серьезность проблемы хронической болезни почек недооценивалась, она оставалась в «тени» других социально значимых заболеваний. Всплеск интереса к проблеме хронической болезни почек возник в начале XXI века, когда появились данные крупных эпидемиологических исследований (NHANES и др.), показывающие высокую частоту нарушений функции почек в популяции, а также когда стало очевидно, что диализные службы во всем мире, несмотря на открытие новых центров диализа, не справляются с притоком пациентов с ТПН). Так, в США на лечение больных с ТПН в 2005 г было израсходовано 21,3 млрд. долларов, что составило 6,4% бюджета Medicare. Ежегодно эти расходы увеличиваются на 7,7%. В странах ЕС на обеспечение только диализа ежегодно расходуется 2% бюджета здравоохранения (рис. 1).
Рисунок 1. Распространенность терминальной почечной недостаточности в США и стоимость лечения
В России по данным Регистра Российского диализного общества в 2007 году различные виды ЗПТ получали более 20 000 человек, ежегодный прирост числа этих больных в среднем составляет 10,5%. При этом на лечение одного диализного больного в течение года в России расходуется не менее 1-1,5 млн. рублей, что в 100 раз выше подушевого норматива Программы государственных гарантий. В России средний возраст больных, получающих заместительную почечную терапию, составляет 47 лет, то есть в значительной мере страдает молодая, трудоспособная часть населения. На сегодняшний день, несмотря на определенный прогресс в развитии заместительной почечной терапии в России в течение последних 10 лет, обеспеченность населения нашей страны этими видами лечения остается в 2,5-7 раз ниже, чем в странах Евросоюза, в 12 раз ниже, чем в США. По Казахстану, к сожалению, у нас нет точных данных пациентов с ТПН, соответственно нуждающихся в ЗПТ.
Однако высокая стоимость ЗПТ и существенный дефицит данных видов лечения в нашей стране – это только одна сторона проблемы. Ни один из существующих на сегодня методов ЗПТ не является безупречным, не обеспечивает 100% восполнения утраченных функций почек, не лишен риска осложнений. Больные, получающие ЗПТ, характеризуются в несколько раз более высокой смертностью по сравнению с общей популяцией, снижением качества жизни. Основная причина госпитализаций и смерти диализных больных – сердечно-сосудистые осложнения.
Рисунок 2. Ожидаемая продолжительность жизни пациентов, получающих ЗПТ, по сравнению с общец популяцией Так, 25-летний представитель общей популяции (красный пунктир) проживет еще 55 лет, дожив до 80; пациент с пересаженной почкой – 35 лет, диализный больной – только 12 лет. Таким образом, развитие ЗПТ – открытие новых диализных центров и увеличение числа трансплантаций почки – в мире и в нашей стране имеет огромное значение, однако решает проблему ТПН лишь отчасти, поскольку не обеспечивает восстановления трудоспособности и высокого качества жизни больных, не предотвращает их высокую смертность. Более того, было установлено, что риск сердечно-сосудистых осложнений резко возрастает по сравнению с общепопуляционным уровнем уже на стадии умеренного снижения функции почек. В результате большинство пациентов с хронической болезнью почек не доживает до диализа, погибая на более ранних стадиях. Очевидно, что преодолеть эти негативные тенденции можно только путем своевременной диагностики болезней почек, раннего назначения патогенетического и нефропротективного лечения, широких и эффективных профилактических мероприятий. Однако до настоящего времени сохраняется парадоксальная и печальная ситуация: с одной стороны, существуют простые и доступные методы раннего выявления признаков поражения почек и нарушения их функции, разработаны принципы нефропротективного лечения, позволяющего снизить риск ТПН на 30-50%; с другой стороны, значительное число больных по-прежнему попадает к нефрологу лишь на стадии, когда надо экстренно начинать диализ для спасения жизни, а возможности нефропротекции уже упущены. Нарушение функции почек отмечается у каждого четвертого пациента с сердечно-сосудистыми заболеваниями, однако специфические «почечные» факторы сердечно-сосудистого риска, которые выходят у этих больных на первый план и определяют прогноз, остаются мало известными широкой врачебной аудитории. Таким образом, приходится говорить о неэффективности не только нефро-, но и кардиопротективного лечения у пациентов с нарушенной функцией почек.
Можно назвать целый ряд причин этой ситуации – как объективного, так и субъективного характера.
С целью преодоления этих трудностей Национальным Почечным Фондом США (National Kidney Foundation – NKF) при участии большой группы экспертов (комитет K/DOQI- Kidney Disease Outcomes Quality Initiative), включающей специалистов в области нефрологии, эпидемиологии, клинической лабораторной диагностики, в 2002 г была предложена концепция хронической болезни почек (ХБП), принятая в настоящее время во всем мире. Внедрение концепции ХБП в практику нашего здравоохранения следует рассматривать как важный стратегический подход к снижению сердечно-сосудистой и общей смертности, увеличению продолжительности жизни населения, а также к снижению расходов на госпитальное лечение осложнений дисфункции почек и проведение заместительной почечной терапии.
Данные о нозологическом составе ХБП неполны и различаются в разных странах. Для установления нозологического диагноза требуются сложные обследования (иногда – биопсия почки), что затруднительно в рамках скрининговых эпидемиологических исследований. Наиболее полная и надежная информация имеется о больных с 5 стадией ХБП, поступающих на учет в связи с началом заместительной терапии и проходящих в связи с этим детальное нефрологическое обследование. В то же время скорость прогрессирования ХБП зависит от нозологии и, соответственно, продолжительность додиализного периода при разных заболеваниях существенно различается. Существенно варьирует и смертность от сердечно-сосудистых осложнений, которые часто приводят к летальному исходу на 3-4 стадиях ХБП. Поэтому не вполне корректно экстраполировать данные о нозологическом составе пациентов, поступающих на диализ, на всю совокупность пациентов с ХБП. В странах, плохо обеспеченных диализом, таких как Россия, на заместительную терапию, в первую очередь, отбирают больных молодого возраста, у которых переносимость диализа и прогноз лучше по сравнению с пожилыми, страдающими сахарным диабетом, тяжелыми сердечно-сосудистыми заболеваниями. Это также существенно искажает наше представление о нозологическом составе пациентов с ХБП. У пациентов с ХБП, выявленной на поздней стадии, не проводится биопсия почки, поскольку ее цель – определение тактики патогенетической терапии, которая используется на более ранних этапах. Отсутствие данных биопсии ограничивает возможность точного нозологического диагноза. Даже если морфологическое исследование проводится у больных с выраженным нефросклерозом, то оказывается малоинформативным в плане постановки нозологического диагноза, поскольку морфологическая картина теряет своеобразие, присущее той или иной нозологии. Для получения наиболее точного представления о нозологическом составе ХБП необходимо наладить систему ранней диагностики и учета больных (скрининг и регистр ХБП), а также обеспечить повсеместную доступность биопсии почки на ранних стадиях протеинурических нефропатий. Имеющиеся на сегодня данные свидетельствуют о преобладании в популяции вторичных нефропатий. В разных странах «пальму первенства» делят между собой поражения почек при диабете и сердечно-сосудистых заболеваниях (диабетическая и гипертоническая нефропатии, а также ишемическая болезнь почек). Учитывая неуклонный рост в популяции числа больных сахарным диабетом, можно ожидать, что доля вторичных нефропатий в структуре ХБП в будущем увеличится еще более. Значительную часть пациентов с ХБП составляют больные хроническим гломерулонефритом, хроническим интерстициальным нефритом (особое место занимает анальгетическая нефропатия), хроническим пиелонефритом, поликистозной болезнью почек. Другие нозологии встречаются существенно реже.
Развитие хронической болезни почек у больных артериальной гипертонией и сахарным диабетом, аутоиммунными болезнями (системной красной волчанкой, ревматоидным артритом и др.) существенно ухудшает прогноз и требует пересмотра тактики лечения. С одной стороны, при наличии хронической болезни почек требуется более строгий контроль артериального давления, чем у гипертоников со здоровыми почками, с другой стороны, при нарушенной функции почек гипертония носит более резистентный к лечению характер, а возможности применения многих лекарств с почечным путем выведения резко ограничены. У больных с нарушенной функцией почек резко повышается риск нежелательных явлений лечения и непредсказуемых лекарственных взаимодействий. Выполнение комплексной задачи кардио- и нефропротекции, направленной на улучшение общего прогноза и предотвращение развития терминальной почечной недостаточности возможно только при совместном ведении пациента с признаками хронической болезни почек и активном взаимодействии кардиолога и нефролога, эндокринолога и нефролога или всех трех специалистов.
Факторы риска ХБП К основным факторам риска ХБП относятся сахарный диабет и другие нарушения обмена веществ, наличие сердечно-сосудистых заболеваний, ряд аутоиммунных и инфекционных заболеваний, новообразования, курение и другие вредные привычки, пожилой возраст и мужской пол, наличие ХБП у прямых родственников и др. (см. рисунок). Особое значение имеют факторы, приводящие к развитию олигонефронии, т.е. несоответствию числа действующих нефронов потребностям организма (см. далее): операции на почках, аплазия и гипоплазия почки – с одной стороны, и ожирение – с другой. Очень важным фактором риска поражения почек, борьбе с которым не уделяется должного внимания в России, является злоупотребление анальгетиками и нестероидными противовоспалительными препаратами, «увлечение» пищевыми добавками (средства для снижения веса у женщин, протеиновые коктейли для наращивания мышечной массы у мужчин). Показателен пример Австралии и многих стран Европы, где спустя несколько лет после запрета безрецептурной продажи анальгетиков и НПВП процент больных анальгетической нефропатией среди поступающих на диализ или трансплантацию почки, снизился в несколько раз.
Принципы диагностики ХБП
Как отмечалось, критериями диагностики ХБП являются наличие признаков повреждения почек и снижение фильтрационной функции.
Маркеры повреждения почек Маркеры повреждения почек Ø Лабораторные: исследовать уровень креатинина крови для последующего расчета СКФ; тестировать анализ мочи на наличие альбуминурии/ протеинурии (>30 мг/сут). Ø УЗИ: изменение размеров почек, повышение эхогенности, объемные образования, камни, нефрокальциноз, кисты. Ø КТ: обструкция, опухоли, кисты, камни пузыря и мочеточников, стеноз а. renalis. Ø Изотопная сцинтиграфия: асимметрия функции, размеров почек. Лабораторные маркеры К лабораторным маркерам относят: снижение относительной плотности мочи, протеинурия, гематурия, лейкоцитурия, цилиндрурия. Снижение относительной плотности мочи отражает концентрационную функцию почек (канальцы). Данный метод вообще можно использовать в качестве скрининга для определения заболеваний почек при массовых осмотрах населения. Для поражения канальцев почек характерны изостенурия и гипостенурия, в то время как значения относительной плотности мочи 1018 и выше исключают его. Оценка протеинурии. Протеинурия также является ранним и чувствительным маркером почечного повреждения. При этом основным белком мочи, как правило, является альбумин. Учитывая, что протеинурия наряду со снижением относительной плотности мочи является самым неблагоприятным прогностическим компонентом нефротического синдрома, ее выявлению уделяется огромное значение. Экскреция белка с мочой. В норме экскреция общего белка с мочой у взрослых составляет 50 мг/сут, альбумина (Аl) - 10 мг/сут. Персистирующая повышенная экскреция белка обычно является маркером почечного повреждения. В моче можно обнаружить как фильтруемые белки (α1-,α2-,β2-микроглобулины, лизоцим), так и образующиеся в мочевом тракте (белок Тамм-Хорсфала). Экскреция определенных типов белка зависит от типа почечного повреждения. Увеличенная экскреция Аl является чувствительным маркером почечного повреждения при сахарном диабете (СД), гломерулярных болезнях и артериальной гипертензии. При отсутствии инфекции мочевыводящих путей и лихорадки повышенная экскреция Аl с мочой, как правило, отражает патологию клубочкового аппарата почек (таблица 3).
Таблица 3 – Типичные причины ложных результатов рутинного измерения общего белка или альбумина в моче
Скорость экскреции Аl с мочой значительно возрастает в вертикальном положении, после физической нагрузки, при повышенном потреблении белков с пищей, при беременности, лихорадке, у больных с инфекцией мочевыводящих путей и сердечной недостаточностью, а также некоторыми другими заболеваниями. Распространенность альбуминурии варьирует в зависимости от возраста, наличия или отсутствия СД. Для всех возрастов распространенность выше у лиц с диабетом. Поскольку экскреция Cr у мужчин выше, чем у женщин, уровни отношения Аl/Cr в моче у мужчин ниже, чем у женщин. Прогностическое значение МАУ в отношении развития сердечно-сосудистых осложнений позволило предложить термин «альбуминурия низкой степени», нацеливающий на необходимость определения уровня экскреции Аl с мочой.
Диагностические критерии микроальбуминурии (МАУ) и протеинурии. Определение белка в суточной моче долгое время было золотым стандартом для количественной оценки протеинурии. Альтернативным методом является измерение отношения белка или альбумина к креатинину в разовой порции мочи. Граничным является уровень в соотношении альбумин/креатинин свыше 30 мг/г у взрослых; данный показатель у детей и подростков представлен в табл. 1.8. Значение соотношения альбу-мин/креатинин ≥300 мг/г у женщин и ≥200 мг/г у мужчин соответствует терминам «макроальбуминурия» или клиническая протеинурия.
Таблица - Сравнение соотношения белок/креатинин и альбумин/креатинин мочи у детей и подростков
Эти отношения сглаживают колебания концентрации белка в моче при различных питьевых режимах, их определение удобнее в сравнении со сбором суточной мочи. В зависимости от метода определения, диагностическими считаются следующие уровни белка (таблица 4).
Таблица 4 – Определения альбуминурии и протеинурии
Рекомендации для взрослых и детей: Ø В большинстве случаев для выявления и мониторинга протеинурии у детей и взрослых следует использовать собранный в произвольное время (“spot”) образец мочи. Ø Обычно нет необходимости получать собранный за определенное время образец мочи (в течение ночи или за 24 часа) для этой оценки, как у взрослых, так и у детей. Ø Предпочтительным является первый утренний образец мочи, но и случайный образец приемлем, если первый утренний недоступен. Ø В большинстве случаев для выявления протеинурии приемлем скрининг с помощью мочевых полосок (urine dipsticks): стандартные полоски приемлемы для выявления повышения общего белка в моче. Ø Альбуминовые полоски приемлемы для выявления альбуминурии. Ø У пациентов с положительным тестом (1+ или более) следует подтверждать протеинурию количественными методами (соотношение белок/Cr или Аl/Cr) в течение 3 месяцев. Ø Мониторинг протеинурии у пациентов с ХБП следует осуществлять количественными измерениями. Специфические рекомендации для детей без сахарного диабета: При скрининге детей на наличие ХБП общий белок мочи следует измерять в произвольном образце мочи, используя: Ø стандартные мочевые полоски; Ø соотношение общий белок/креатинин. Ø Ортостатическую протеинурию следует исключать повторными измерениями в первом утреннем образце мочи, если первоначально протеинурия была выявлена в случайном образце. Ø При мониторировании протеинурии у детей с ХБП соотношение общий белок/креатинин следует измерять в произвольном образце мочи. Маркеры почечного повреждения, помимо протеинурии, включают в себя отклонения в осадке мочи и отклонения при визуализирующих исследованиях. Совокупность маркеров определяет клинические проявления некоторых типов ХБП. Для выявления почечного повреждения до снижения СКФ при других типах ХБП требуются новые маркеры. Ø У пациентов с ХБП и у лиц с повышенным риском развития ХБП следует проводить исследование осадка мочи или применять тест-полоски (dipstick) на эритроциты и лейкоциты. Ø У пациентов с ХБП и у некоторых лиц с повышенным риском развития хронического заболевания почек следует проводить визуализирующие исследования почек. Ø Хотя применение нескольких новых мочевых маркеров (таких как тубулярные и низкомолекулярные белки и специфические мононуклеарные клетки) продемонстрировало обнадеживающие результаты, в настоящее время их не следует использовать для принятия клинических решений. Визуальные маркеры повреждения почек определяются при инструментальном исследовании: ультразвуковое исследование, компьютерная томография, изотопная сцинтиграфия, контрастная урография. Существенное значение придают уменьшению размеров почек (в отличие от острой почечной недостаточности, при которой размеры почек увеличены). Ультразвуковое исследование почек Ø Целесообразно у всех пациентов с ХБП в таких случаях как: прогрессирование заболевания; явная или хроническая скрытая гематурия; симптомы обструкции мочевыводящих путей; поликистозная болезнь почек в семейном анамнезе; ХБП в стадии 4 или 5 и перед проведением биопсии почек. Ø Лицам с врожденными заболеваниями почек в семейном анамнезе перед проведением исследования следует разъяснить значение результатов, отклоняющихся от нормы.
2. Оценка функции почек. Суммарную функцию почек оценивают по СКФ. Скорость клубочковой фильтрации показывает, какой объем крови в миллилитрах может быть полностью очищен от креатинина за 1 минуту. Снижение СКФ в динамике четко отражает уменьшение числа действующих нефронов. Причем скорость снижения СКФ у каждого больного практически постоянна (при отсутствии дополнительных факторов прогрессирования). Рассчитав эту скорость по нескольким измерениям, можно заранее определить время начала гемодиализа. Скорость клубочковой фильтрации является гораздо более чувствительным показателем функционального состояния почек, чем сывороточный креатинин или мочевина. Уровень мочевины не соответствует степени тяжести ХБП, поэтому от этого параметра отказались. Диагностическую ценность Cr существенно снижает его зависимость от многих параметров: мышечной массы (у женщин Cr на 15% ниже), диеты (у вегетарианцев уровень Cr ниже), приема некоторых лекарств и пр. Оценить СКФ можно при помощи расчетных формул или путем определения клиренса креатинина (таблица 5). Креатинин сыворотки. Исследование концентрации Cr сыворотки является обязательным методом лабораторного исследования. В виду зависимости его концентрации от ряда факторов, определение Cr сыворотки является недостаточным для оценки функции почек. Уровень креатинина крови зависит от возраста, пола, расы и поверхности тела пациента. Критическим с точки зрения прогрессирования ХБП является снижение СКФ ниже 60 мл/мин. Со-отношение СКФ меньше 60 мл/мин с уровнем креатинина приобретает весомое значение с увеличением возраста пациентов.
Таблица 5 – Факторы, влияющие на концентрацию креатинина в сыворотке (K/DOQI, 2006)
Концентрация Cr сыворотки зависит от продукции, секреции, внепочечной экскреции Cr. Креатинин представляет собой ангидрид креатина, образующийся в организме в результате отщепления остатка фосфорной кислоты от креатинфосфата; является одним из конечных продуктов азотистого обмена и постоянной составной частью мочи.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.194.39 (0.073 с.) |