
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие об энергии Гиббса. Характер изменения энергии Гиббса как критерий, выражающий принципиальную возможность протекания процесса. Изменение энергии Гиббса как мера химического сродства.
Энергия Гиббса Энергия Гиббса G=H-TS - термодинамическая ф-я,а её изменение:
Вопрос 12. Второй закон термодинамики. Вияние энтропийного и энтальпийного факторов на направление химического сродства. Второй закон термодинамики. Существует функция состояния - энтропия S, которая обладает следующим свойством: Функцией состояния системы одновременно определяющей влияние энтальпийного и энтропийного факторов на направленность процессов при постоянных T и P является свободная энергия Гиббса G=H-TS. ХИМИЧЕСКОЕ СРОДСТВО (сродство р-ции), параметр термодинамич. системы, характеризующий отклонение от состояния хим. равновесия. Если р-цию записать в виде ур-ния:
Вопрос 13 Что характеризует первый и второй закон термодинамики и их математические выражения. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Здесь U (T 1) и U (T 2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
Первый закон термодинамики для изобарного процесса дает:
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T 2 < T 1; внутренняя энергия убывает, Δ U < 0. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0. Первый закон термодинамики для изотермического процесса выражается соотношением.
Вопрос 14 Состояние термодинамического равновесия. Константа равновесия. Использование уравнения изотермы Вант-Гоффа для определения возможности осуществления химических реакций.
Термодинамическое равновесие — состояние системы, при котором ее параметры (температура, давление, объем, энтропия) остаются неизменными по времени в условиях изолированности от окружающей среды.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
Например, для реакции окисления монооксида углерода: 2CO + O2 = 2CO2константа равновесия может быть рассчитана по уравнению:
Правило Вант-Гоффа При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза. Уравнение, которое описывает это правило, следующее:
где
Вопрос 15
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.118.198 (0.005 с.) |
 G=
G=  , где знак равенства относится к обратимым процессам, а знак больше - к необратимым.
, где знак равенства относится к обратимым процессам, а знак больше - к необратимым.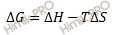


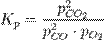

 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).


