Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
Моносахариды (монозы) являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная), и несколько гидроксильных групп. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа). Например, глюкоза – это альдоза, а фруктоза – это кетоза. Для всех моносахаридов характерно явление мутаротации, т.е. существование в циклической и нециклической формах.
Химические свойства Моносахариды проявляют свойства спиртов и карбонильных соединений. I. Реакции по карбонильной группе
Окисление. a) Как и у всех альдегидов, окисление моносахаридов приводит к соответствующим кислотам. Так, при окислении глюкозы аммиачным раствором гидрата окиси серебра образуется глюконовая кислота (реакция "серебряного зеркала"). b) Реакция моносахаридов с гидроксидом меди при нагревании так же приводит к альдоновым кислотам. c) Более сильные окислительные средства окисляют в карбоксильную группу не только альдегидную, но и первичную спиртовую группы, приводя к двухосновным сахарным (альдаровым) кислотам. Обычно для такого окисления используют концентрированную азотную кислоту.
Восстановление. Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрид лития и др.
II. Реакции по гидроксильным группам 1. Алкилирование (образование простых эфиров). 2. Ацилирование (образование сложных эфиров). 3. Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция).
III. Специфические реакции Кроме приведенных выше, глюкоза характеризуется и некоторыми специфическими свойствами - процессами брожения. Брожением называется расщепление молекул сахаров под воздействием ферментов (энзимов). Брожению подвергаются сахара с числом углеродных атомов, кратным трем. Существует много видов брожения, среди которых наиболее известны следующие:
a) спиртовое брожение b) молочнокислое брожение c) маслянокислое брожение
Упомянутые виды брожения, вызываемые микроорганизмами, имеют широкое практическое значение. Например, спиртовое – для получения этилового спирта, в виноделии, пивоварении и т.д., а молочнокислое – для получения молочной кислоты и кисломолочных продуктов.
3. Стереоизомерия моносахаридов D- и L-ряды. Открытые и циклические формулы. Пиранозы и фуранозы. α- и β-аномеры. Циклоцепная таутомерия. Явление муторотации.
Способность ряда органических соединений вращать плоскость поляризации поляризованного света вправо или влево называют оптической активностью. Исходя из сказанного выше, следует, что органические вещества могут существовать в виде правовращающих и левовращающих изомеров. Такие изомеры получили название стереоизомеров, а само явление стереоизомерии. В основе более строгой системы классификации и обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера, т.е. взаимное расположение четырех обязательно разных замещающих групп, находящихся в вершинах тетраэдра, вокруг локализованного в центре атома углерода, который получил название асимметрического атома углерода или хирального центра. Хиральные или, как их еще называют, оптически активные атомы углерода обозначают в структурных формулах звездочками
Таким образом, под термином стереоизомерия следует понимать различную пространственную конфигурацию заместителей у соединений, имеющих одну и ту же структурную формулу и обладающих одинаковыми химическими свойствами. Такой вид изомерии называют также зеркальной изомерией. Наглядным примером зеркальной изомерии могут служить правая и левая ладони руки. Ниже приведены структурные формулы стереоизомеров глицеринового альдегида и глюкозы.
Если у асимметрического атома углерода в проекционной формуле глицеринового альдегида ОН-группа располагается справа, такой изомер называют D-стереоизомером, а если ОН-группа расположена слева –L-стереоизомером.
В случае тетроз, пентоз, гексоз и других моноз, которые обладают двумя и более асимметрическими атомами углерода, принадлежность стереоизомера к D- или L-ряду определяют по расположению ОН-группы у предпоследнего атома углерода в цепи – он же является последним асимметрическим атомом. Например, для глюкозы оценивают ориентацию ОН-группы у 5-ого атома углерода. Абсолютно зеркальные стереоизомеры называют энантиомерами или антиподами. Стереоизомеры не отличаются по своим химическим свойствам, но отличаются по биологическому действию (биологической активности). Большая часть моносахаридов в организме млекопитающих относится к D-ряду – именно к этой конфигурации специфичны ферменты, ответственные за их метаболизм. В частности D-глюкоза воспринимается как сладкое вещество, благодаря способности взаимодействовать с вкусовыми рецепторами языка, в то время как L-глюкоза безвкусна, поскольку ее конфигурация не воспринимается вкусовыми рецепторами. В общем виде строение альдоз и кетоз можно представить следующим образом.
Стереоизомерия. Молекулы моносахаридов содержат несколько центров хиральности, что служит причиной существования многих стереоизомеров, отвечающих одной и той же структурной формуле. Например, в альдогексозе имеются четыре асимметрических атома углерода и ей соответствуют 16 стереоизомеров (24), т. е. 8 пар энантиомеров. По сравнению с соответствующими альдозами кетогексозы содержат на один хиральный атом углерода меньше, поэтому число стереоизомеров (23) уменьшается до 8 (4 пары энантиомеров).
Открытые (нециклические) формы моносахаридов изображают в виде проекционных формул Фишера. Углеродную цепь в них записывают вертикально. У альдоз наверху помещают альдегидную группу, у кетоз - соседнюю с карбонильной первичную спиртовую группу. С этих групп начинают нумерацию цепи.
Для обозначения стереохимии используется D,L-система. Отнесение моносахарида к D- или L-ряду проводят по конфигурации хирального центра, наиболее удаленного от оксогруппы, независимо от конфигурации остальных центров! Для пентоз таким «определяющим» центром является атом С-4, а для гексоз - С-5. Положение группы ОН у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева - к L-ряду, т. е. по аналогии со стереохимическим стандартом - глицериновым альдегидом
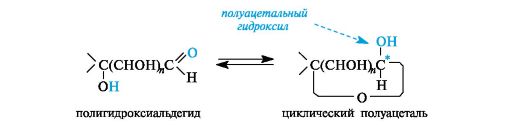
Циклические формы. Открытые формы моносахаридов удобны для рассмотрения пространственных отношений между стереоизомерными моносахаридами. В действительности моносахариды по строению являются циклическими полуацеталями. Образование циклических форм моносахаридов можно представить как результат внутримолекулярного взаимодействия карбонильной и гидроксильной групп, содержащихся в молекуле моносахарида.
Впервые циклическую полуацетальную формулу глюкозы предложил А. А. Колли (1870). Он объяснил отсутствие некоторых альдегидных реакций у глюкозы наличием трехчленного этиленоксидного (α-окисного) цикла:
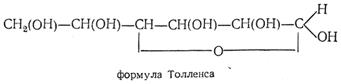
Позже Толленс (1883) предложил аналогичную полуацетальную формулу глюкозы, но с пятичленным (γ-окисным) бутиленоксидным кольцом:
Формулы Колли — Толленса громоздки и неудобны, не отражают строения циклической глюкозы, поэтому были предложены формулы Хеуорса.
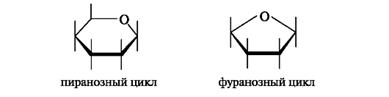
В результате циклизации образуются термодинамически более устойчивые фуранозные (пятичленные) и пиранозные (шестичленные) циклы. Названия циклов происходят от названий родственных гетероциклических соединений - фурана и пирана.
Образование этих циклов связано со способностью углеродных цепей моносахаридов принимать достаточно выгодную клешневидную конформацию. Вследствие этого в пространстве оказываются сближенными альдегидная (или кетонная) и гидроксильная при С-4 (или при С-5) группы, т. е. те функциональные группы, в результате взаимодействия которых осуществляется внутримолекулярная циклизация.
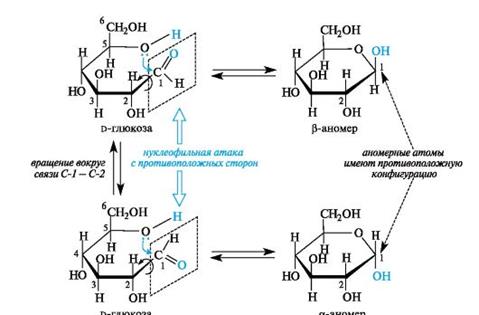
В циклической форме создается дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы (у альдоз это С-1). Этот атом называют аномерным, а два соответствующих стереоизомера - α- и β-аномерами (рис. 11.1). Аномеры представляют собой частный случай эпимеров.
У α-аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к d- или l-ряду, а у β-аномера - противоположна. В проекционных формулах Фишера у моносахаридов d-ряда в α-аномере гликозидная группа ОН находится справа, а в β-аномере - слева от углеродной цепи.
Рис. 11.1. Образование α- и β-аномеров на примере d-глюкозы
Формулы Хеуорса. Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не указывают.
Для перехода к формулам Хеуорса циклическую формулу Фишера преобразуют так, чтобы атом кислорода цикла располагался на одной прямой с атомами углерода, входящими в цикл. Это показано ниже на примере a-d-глюкопиранозы путем двух перестановок у атома С-5, что не изменяет конфигурацию этого асимметрического центра (см. 7.1.2). Если преобразованную формулу Фишера расположить горизонтально, как требуют правила написания формул Хеуорса, то заместители, находившиеся справа от вертикальной линии углеродной цепи, окажутся под плоскостью цикла, а те, что были слева, - над этой плоскостью.
У d-альдогексоз в пиранозной форме (и у d-альдопентоз в фуранозной форме) группа СН2ОН всегда располагается над плоскостью цикла, что служит формальным признаком d-ряда. Гликозидная гидроксильная группа у a-аномеров d-альдоз оказывается под плоскостью цикла, у β-аномеров - над плоскостью.
D-ГЛЮКОПИРАНОЗА По аналогичным правилам осуществляется переход и у кетоз, что показано ниже на примере одного из аномеров фуранозной формы d-фруктозы.
Циклоцепная таутомерия обусловлена переходом открытых форм моносахаридов в циклические и наоборот. Изменение во времени угла вращения плоскости поляризации света растворами углеводов называют мутаротацией. Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией. В растворах равновесие между четырьмя циклическими таутомерами моносахаридов устанавливается через открытую форму - оксоформу. Взаимопревращение a- и β-аномеров друг в друга через про- межуточную оксоформу называется аномеризацией. Таким образом, в растворе d-глюкоза существует в виде таутомеров: оксоформы и a- и β-аномеров пиранозных и фуранозных циклических форм.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.166.98 (0.028 с.) |

 По количеству атомов углерода в цепи моносахариды подразделяют на: низшие (диозы, триозы, тетрозы), средние (пентозы, гексозы) и высшие (гептозы, октозы и нонозы).
По количеству атомов углерода в цепи моносахариды подразделяют на: низшие (диозы, триозы, тетрозы), средние (пентозы, гексозы) и высшие (гептозы, октозы и нонозы).