
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
У бас: од. Маси – 1 фунт (lbm). Сила - паундаль
1паундаль = 1 (фунт×фут)/с2 = 0,13825 Н У БІС: Од. сили – фунт сили – lb. Од. маси – слаг 1слаг = 1 (фунт×с2)/фут = 14,5939 кг Прискорення – 1 фут/с2. Співвідношення між температурами по Цельсію і Фаренгейту: t оC = 5 / 9(t оF – 32о); t оF = 9 / 5(t оC + 32о). Для двох різних станів газу
Нормальні фізичні умови: Р н= 101325 Па = 760 мм.рт.ст., Т = 273,15 К, t = 0оC. Газові суміші Масові, об'ємні і мольні частки gі = mі / mсум – масова; rі = Vі / Vсум – об'ємна; zі = Mі / Mсум – мольна; де mi – маса і -го компоненту; mсум – маса суміші mсум = m 1 + m 2 +... + mп ; Vi – парціальний об’єм і -го компоненту; Vсум – об’єм суміші; Mі – кількість молей і -го компоненту; Mсум – сумарна кількість молей всіх компонентів
Для ідеальної газової суміші rі = zі. Перерахунок з масових часток в об'ємні і навпаки
Уявна молекулярна маса суміші
Густина і питомий об’єм суміші rсум =
Газова стала суміші
Парціальний тиск компонента Pі = Pсум × rі = gі × Rі / Rсум × Pсум. Ентропія суміші s = s 1+ s 2+…+ sn + sсум. Ентропія змішування
1.2. Розв’язання задач
Задача № 1. Визначити масу вуглекислого газу в судині об’ємом V =4 м3, при температурі t =80оС. Тиск газу по манометру Pм =0,04МПа, барометричний тиск Pб =103990 Па. Дано: V = 4 м3; t = 80 оC; Pм = 0,04 МПа; Pб = 103990 Па m -?
Розв’язання: PV = mRT
m = PV/RT P = Pм + Pб = 0,10399+ 0,04=0,14399 МПа = 143990 Па
Задача № 2. У судині знаходиться повітря під розрідженням 10 кПа і температурі 0оС. Ртутний барометр показує Рб =99725 Па при tрт =20оС. Визначити питомий об’єм повітря. Дано: Рр = 10 кПа = 10000 Па; t = 0оC; Рб = 99725 Па; tрт = 20оC v -?
Розв’язання: Приведення показань ртутного барометра до 0оС: В 0= В (1 – 0,000172× t) = 99725 (1 – 0,000172×20) = 99382 Па
Рр = Рб - Ра;
Ра = Рб – Рр = 99382 – 10000 = 89382 Па
Задача № 3. Розрахувати ентальпію кисню, що знаходиться при t =-50оС і має питому внутрішню енергію u =144,2 кДж/кг. Маса кисню m О2=10 кг. Дано: t = -50оC; u = 144,2 кДж/кг; m О2= 10 кг i -?
Розв’язання: і = u + Pv
Pv = RT;
Pv = RT = 259,8 (-50 + 273) = 57935,4 Дж/кг = 57,9 кДж/кг
і = u + Pv = 144,2 + 57,9 = 202,1 кДж/кг
І= і × m = 202,1 × 10 = 2021 кДж
Задача № 4. Газова суміш має такий масовий склад: СО2=38%, N2=62%. Визначити об'ємний склад суміші, уявну молекулярну масу, газову сталу і парціальні тиски компонентів, якщо тиск суміші Рсум =1,2 МПа.
Дано: g СО2= 0,38 = 38%; g N2= 0,62 = 62%; Pcум = 1,2 МПа rі -? mсум -? Rсум -? P СО2-? P N2-?
Розв’язання:
= 0,281×44 + 0,719×28 = 32,5 кг/кмоль
Rсум = mR/mсум = 8314/32,5 = 255,8 Дж/(кг×К)
Р СО2= r СО2× Pсум = 0,281×1,2 = 0,337 МПа
Р N2= r N2× Pсум = 0,719×1,2 = 0,863 МПа
Рсум = S Рі = P СО2+ P N2= 0,337 + 0,863 = 1,2 МПа
1.3. Задачі для самостійного розв’язання
Задача № 1. У циліндричній судині з внутрішнім діаметром d =0,5×N м і висотою h =1,5+0,2×N; знаходиться газ SO2, масою m =(50+N) кг. Барометричний тиск Pб =101325 Па. Визначити температуру газу в судині. Тиск газу визначається за умовою P =(0,01×N+0,005) МПа, при цьому слід врахувати: якщо P<Pб, то газ знаходиться в судині під розрідженням – (вакуум); якщо P>Pб, то газ знаходиться в судині під надлишковим тиском. Що буде показувати мановакууметр, якщо температура газу в судині збільшиться на 20×NоC? Виразити тиск газу в мм.рт.ст.; кг/см2; м.вод.ст.; lbf/in2, а температуру в градусах по Фаренгейту. N – номер прізвища за списком.
Задача № 2. У балоні об’ємом V =0,4 м3 знаходиться повітря при тиску Pн =N кг/см2 і температурі 10×N по Фаренгейту. Барометричний тиск Pб =101,325 кПа. Скільки газу необхідно викачати із судини, щоб розрідження в ньому стало Pр =0,001×N МПа. Визначити питомий об’єм і густину повітря до і після випуску газу.
Задача № 3. Маса порожнього балона для кисню ємністю V =0,05м3 дорівнює 80кг. Визначити масу балона після його заповнення киснем при t =(20+2×N)оC, до тиску Pн =N МПа. Барометричний тиск Pб =99800Па. Як зміниться температура газу, якщо з нього випустити 50% кисню, а тиск понизиться на 40%. Виразити цю температуру в оС, в оF, а тиск після випуску кисню в кг/см2, мм.рт.ст., м.вод.ст.
Задача № 4. Поршневий компресор всмоктує в хвилину Vn =N м3 повітря при t =(15+N)оC і Рб =100 кПа і нагнітає його в резервуар Vр =N м3. За скільки хвилин компресор підніме тиск у резервуарі до Рк =N МПа, якщо температура в ньому буде залишатися постійною. Початковий тиск повітря в резервуарі Рб =100 кПа, при температурі t. Виразити Рк у бар, мм.рт.ст., кг/см2, м.вод.ст., lbt/in2, t в оF.
Задача № 5. Резервуар масою mр =20×N кг і об’ємом V =(4+N) м3 заповнений вуглекислим газом. Визначити, з якою силою діє резервуар на балку перекриття, а газ на дно резервуара, якщо діаметр циліндричного резервуара dр =(2+0,2×N) м, а газ знаходиться при надлишковому тиску Рр =0,5×N МПа і t =(30+2×N)оC. Барометричний тиск повітря Рб =102,4 кПа. Виразити тиск в бар, мм.рт.ст., м.вод.ст., кг/см2, lbt/in2, а t в оF.
Задача № 6. Визначити підйомну силу повітряної кулі, наповненої воднем, якщо її об’єм Vк =N м3, тиск Р =101325 Па, температура водню t Н2=(50+3×N)оС, температура навколишнього повітря t =NоС.
Задача № 7. Аналіз продуктів згоряння палива показав їхній об'ємний склад r SO2=N%, r О2=2N%, r Н2=100–(r SO2+ r О2). Визначити масові частки компонентів суміші, уявну молекулярну масу, газову сталу, густину і парціальний тиск компонентів суміші при t =20оС і Рб =0,101 МПа.
Задача № 8. Димові гази мають такий масовий склад g СО2=N%, g 2=2N%, g Н2О=100–(g СО2+gN2). Визначити об'ємні частки компонентів, уявну молекулярну масу, газову сталу, питомий об’єм і парціальні тиски при t =30оС і Рб =101325 Па.
Задача № 9. Визначити масовий склад газової суміші, що складається з аргону і гелію, якщо парціальний тиск Р Ar=(100+5×N) кПа, тиск суміші Рсум =500 кПа. Розрахувати газову сталу, уявну молекулярну масу і густину суміші при t =NоС, маси компонентів, якщо маса суміші mсум =2×N кг.
Задача № 10. Розрахувати внутрішню енергію повітря при температурі t =5×NоC і ентальпії i =100×N кДж/кг, маса повітря m =2×N кг.
Задача № 11. Розрахувати ентальпію двоокису вуглецю при t =3×NоC, якщо внутрішня енергія u =(150+2×N) кДж/кг, маса газу m СО2=5×N кг.
Задача № 12. Визначити питомий об’єм азоту, якщо він знаходиться при тиску P =(100000+500×N) Па. Питома ентальпія азоту і =(304+5×N) кДж/кг, а питома внутрішня енергія u =(217+3×N) кДж/кг.
Задача № 13. Розрахувати ентропію повітря масою m =(5+N) кг, що знаходиться в судині, об’ємом V =(0,5+0,2×N) м3, при температурі t =(20+5×N)оC. Ізобарна теплоємність повітря ср =1,005 кДж/(кг×К).
Задача № 14. Суміш газів складається з (5+N) кг двоокису вуглецю з ентропією s СО2=4,89 кДж/кг×К; (10+N) кг водяної пари з ентропією s Н2О=10,5 кДж/кг×К. Визначити ентропію суміші. Задача № 15. 1 кг повітря при температурі t 1=(100+N)оC розширюється до десятикратного об’єму, при цьому його температура падає до t 2=(10+N)оС. Визначити зміну ентропії, якщо ізохорна теплоємність повітря сv =0,75 кДж/(кг×К).
Задача № 16. Ідеально-газова суміш задана мольними частками z О2=2×N%, z SO2=1,5×N%, z CO=100–(z 2+ z SO2). Визначити масові частки, уявну молекулярну масу суміші, газову сталу, густину при тиску Рcум =1,2 МПа і температурі t =50оС, масу суміші і маси компонентів, якщо сумарна кількість молів Мсум =2×N.
Задача № 17. Газ коксових печей має такий об'ємний склад: H2=(40+N)%, CH4=(15+0,5×N)%, N2=100–(H2+CH4)%. Визначити уявну молекулярну масу, масові частки, газову сталу, густину і парціальні тиски при температурі t =NоC і тиску Р =(100+5×N) кПа.
Задача № 18. Знайти газову сталу, питомий об’єм газової суміші і парціальний тиск її складових, якщо об'ємний склад суміші r СО2=(10+0,5×N)%, r N2=(40+N)%, r Н2О=100–(r СО2+ r 2)%, загальний тиск суміші Р =100+5×N кПа, температура t =50оС.
1.4. Питання для самоперевірки та контролю засвоєння знань
1. Термічні параметри стану. 2. Калоричні параметри стану. 3. Рівняння стану ідеального газу Менделєєва-Клапейрона.
4. Співвідношення між одиницями виміру тиску. 5. Одиниці вимірювання тиску в Англії і США. 6. Співвідношення між температурами по Цельсію і Фаренгейту. 7. Нормальні фізичні умови. 8. Масові, об'ємні і мольні частки газової суміші. 9. Формули для перерахунку масових часток в об’ємні і навпаки. 10. Ентропія суміші та змішування. 2.
2.1.Основні розрахункові рівняння
2.1.1. Перший закон Теплота Q 1-2, що підводиться до тіла у процесі 1-2 витрачається на зміну внутрішньої енергії Δ U 1-2 та використання роботи L 1-2. Для газу масою m
Для одного кілограму газу
В диференційній формі
Для безкінечно малої зміни стану:
Для інтервалу температур:
де ср, сv –істинні масові ізобарна та ізохорна теплоємності; срm, сvm – середні масові ізобарна та ізохорна теплоємності;
Теплоємністю тіла с називають кількість теплоти Q, яку необхідно підвести чи відвести від тіла для зміни температури на один градус,
Якщо теплота підводиться у процесі з постійним тиском, P =const, то таку теплоємність називають ізобарною, якщо ж у процесі з постійним об’ємом, V =const, то ізохорною. Відповідним теплоємностям присвоюють індекси «p» або «v». Індекс «m» означає, що теплоємність середня і вона визначена для інтервалу температур. Істина теплоємність визначається в межах однієї температури.
Питомі теплоємності: 1. Масова – c, кДж/(кг·К); 2. Об’ємна – c´, кДж/(м3·К); 3. Мольна – μc, кДж/(кмоль·К). Відношення теплоємностей позначають k=cp/cv=μcp/μcv, для одноатомних газів k= 1,67; двоатомних, k= 1,4; трьох – і багатоатомних, k= 1,33. Теплоємність змінюється із зміною температури. Вона може не залежати від температури, мати лінійну або криволінійну залежність. У випадку, коли теплоємність не залежить від температури, то її визначають,
де μ – молекулярна маса речовини, кг/моль. Числові значення мольних теплоємностей вибирають із таблиць у залежності від атомності газу: одноатомні, двоатомні, трьох – і багатоатомні. Таблиця 1
При лінійній залежності середня теплоємність визначається,
де a, b – постійні коефіцієнти для даного газу, їх величина наводиться в табл. 4, додатку.
Під індексом «x» розуміють вид процесу: ізобарний x=p, ізохорний x=v. При нелінійній залежності теплоємності від температури, що виражається багаточленом
де сх 1, сх 2 – теплоємності, які вибирають із таблиць додатку відповідно температурам t 1 і t 2. Теплоємність газової суміші: Масова, де gi, ri – відповідно масові та об’ємні частки компонентів суміші. Визначена теплоємність дозволяє розрахувати кількість підведеної чи відведеної теплоти. Якщо в процесі приймало участь m, кг або V н, м3 газу, то
де V н – об’єм речовини при нормальних умовах, м3. Рівняння І закону термодинаміки для потоку
де і 1, і 2 – питома ентальпія потоку речовини в перерізах 1 і 2, Дж/кг; G – масова втрата речовини, кг/с; w 1, w 2 – швидкість потоку в перерізах 1 і 2, м/с; h 1, h 2 – висота розміщення центра першого та другого перерізі ввід контрольної поверхні, м; Lтехн . – технічна робота, яку може виконати потік, Дж/с; g =9,81 м2/с – прискорення сили тяжіння.
2.1.2. Другий закон Аналітичний вираз другого закону термодинаміки
де dS, ds – безкінечно малий приріст повної та питомої ентропії; T – абсолютна температура джерела теплоти, К; dQ, dq – безкінечно мала кількість повної та питомої теплоти. Якщо dS> 0 теплота в процес підводиться, якщо dS< 0 - відводиться. Знак «>» відноситься до протікання необоротних процесів, знак «=» до протікання оборотних процесів. Об’єднане рівняння І і ІІ закону термодинаміки
Повна та питома величина корисної роботи при переході ізольованої системи із нерівноважного стану в рівноважний.
Повна та питома величина максимальної корисної роботи
де U 1, U 2, (u 1, u 2) – відповідно повна та питома внутрішня енергія джерела роботи на початку і в кінці процесу; S 01, S 02, (s 01, s 02) – повна та питома ентропія навколишнього середовища; V 1, V 2, (v 1, v 2) – повний та питомий об’єм джерела роботи; S 1, S 2, (s 1, s 2) – повна та питома ентропія джерела роботи; P 0, T 0 – тиск і температура навколишнього середовища; Ех, ех – повна та питома ексергія джерела роботи.
2.2. Розв’язання задач
Задача №1. Визначити середню масову ізобарну та ізохорну теплоємності, середню об’ємну ізобарну та ізохорну теплоємності при зміні температури від t 1=(100+N)ºC до t 2=(600+3·N)ºC для трьох випадків: 1. Незалежність теплоємності від температури; 2. Лінійна залежність; 3. Нелінійна залежність. Вид газу вибирається в залежності від N - номера прізвища по списку групи: N=(1÷5) – O2; N=(6÷10) – СO2; N=(11÷15) – N2; N=(16÷20) – водяна пара; N=(21÷25) – повітря; N=(26÷30) – SO2.
Дано: t 1=108ºC, t 2=587ºC, O2 - кисень.
Розв’язання:
1. Незалежність теплоємності від температури
Кисень O2 двоатомний газ, з табл.1 вибираємо значення мольних теплоємностей для двоатомного газу: μср =29,1 кДж/(кмоль·К), μсv =20,8 кДж/(кмоль·К),
Для інтервалу температур від t 1=108ºC до t 2=587ºC масові теплоємності:
Об’ємні теплоємності:
2. Лінійна залежність
Із табл.4 додатку для кисню O2, виписуємо формули і розрахуємо теплоємності
3. Нелінійна залежність
Для визначення теплоємностей, що відповідають проміжним значенням температури t 1=108ºC (між 100 і 200ºС) та t 2=587ºC (між 500 і 600ºС) використовуємо інтерполяційну формулу, наприклад, для t 1=108ºC
де с 108 – теплоємність, розрахункова величина при t 1=108ºC; с 100 – теплоємність при температурі 100ºС, вибирається із табл. 5 додатку; с 200 – теплоємність при температурі 200ºС, вибирається із табл. 5 додатку; Δ t – температурний інтервал таблиці, ºС; t – крайнє початкове значення температури у температурному інтервалі між 100 і 200ºС
Інтерполяційна формула для t 2=587ºC
де с 587 – теплоємність при t 2=587ºC, розрахункова величина; с 500 – теплоємність при температурі 500ºC, вибирається із табл. 5 додатку; с 600 – теплоємність при температурі 600ºC, вибирається із табл. 5 додатку; t – крайнє початкове значення температури у температурному інтервалі між 500 і 600ºC.
Середні масові теплоємності:
Середні об’ємні теплоємності:
Аналіз проведених розрахунків показує, що величини теплоємностей значно відрізняються одна від одної, тому в кожному конкретному випадку для отримання більш точного результату треба знати залежність теплоємності від температури. Задача №2. Сірчаний газ SO2 в кількості V 1=(3+N)м3 нагрівається від t 1=NºC до t 2=(300+5·N)ºC в одному випадку при постійному тиску Р 1= Р 2=(0,3+0,1·N)МПа, а в другому при постійному об’ємі V 1= V 2=const. Визначити кількість підведеної теплоти при: 1. незалежності теплоємності від температури; 2. лінійній залежності; 3. нелінійній залежності.
QP -? QV -?
Розв’язання:
1. Нагрівання при постійному тиску, Р =const
Газова стала SO2
Маса газу
1.1. Кількість теплоти при незалежності теплоємності від температури Середня ізобарна теплоємність газу:
1.2. Кількість теплоти при лінійній залежності.
де a =0,6314, b =0,00015541 – коефіцієнти вибрані із табл. 4 додатку.
1.3. Кількість теплоти при нелінійній залежності.
2. Нагрівання при постійному об’ємі, V =const
Об’єм газу при нормальних умовах Р =101325Па, t 1=0ºC визначається із співвідношення
2.1. Кількість теплоти при незалежності теплоємності від температури Середня об’ємна ізохорна теплоємність
2.2. Кількість теплоти при лінійній залежності
2.3. Кількість теплоти при нелінійній залежності
В ізобарному процесі, на нагрівання витрачається більша кількість теплоти, чим в ізохорному процесі. Величина затраченої теплоти залежить від вибору теплоємності. Найбільші витрати теплоти на нагрівання мають місце при нелінійній залежності теплоємності від температури. Задача №3. Визначити масову та об’ємну ізобарну теплоємність газової суміші, що складається з вуглекислого газу СO2, азоту N2, та кисню O2. Об’ємний склад суміші:
Дано:
Розв’язання:
Масові частки компонентів,
Газові теплоємності газів
Газові сталі компонентів,
Густина компонентів при нормальних умовах Р н=101325Па, t н=0ºC.
Об’ємні теплоємності газів,
Масова ізобарна теплоємність газової суміші,
Об’ємна ізобарна теплоємність газової суміші,
Задача №4. В каналі довільної форми рухається повітря з витратою G =(5+N)кг/с. На вході і виході з каналу ентальпія газу – і, швидкість потоку – w, висота перерізів каналу – h, над контрольною поверхнею відповідно мають значення: i 1=(300+3·N)кДж/кг, i 2=(310+5·N)кДж/кг; w 1=(10+0,1·N)м/с; w 2=(15+0,2·N)м/с; h 1=(20+N)м; h 2=(10+0,5·N)м. Між перерізами 1-1 і 2-2 до газу підводиться теплота Q =(300+5·N)кДж/с. Визначити, яку технічну роботу L техн може виконати газ.
Дано: G =5кг/с; i 1=300кДж/кг; i 2=310кДж/кг; w 1=10м/с; w 2=15м/с; h 1=20м; h 2=10м; Q =300кДж/с.
Розв’язання:
Розв’язання першого закону термодинаміки для потоку
Визначаємо технічну роботу, яку може виконати газ
Задача №5. Визначити максимально корисну роботу (ексергію) та втрати працездатності азоту, який знаходиться у балоні об’ємом V 1=(300+5·N) літрів при тиску Р 1=NМПа і температурі t 1=(100+5·N)ºC. Азот може використовувати роботу під час переходу із не рівноважного стану до рівноважного, знижуючи параметри до параметрів навколишнього середовища Р 0=0,1МПа, t 0=10ºC, при цьому зміна ентропії системи (джерело – середовище) складає (1+0,1·N)кДж/К. Прийняти теплоємність незалежно від температури.
Ex = L max -? Δ L -?
Розв’язання:
Маса азоту в балоні
Об’єм азоту при параметрах навколишнього середовища
Питомі об’єми азоту в стані «1» і «2».
Теплоємність процесу Зміна внутрішньої енергії джерела роботи
Зміна ентропії
Максимально корисна робота (ексергія)
Зміна ентропії системи джерело – навколишнє середовище
тоді
Корисна робота, яку може виконати азот
L =(U 1– U 2)– T 0(S 02– S 01)– P 0(V 2– V 1)=
=496,3–(10+273)·(–5,12)–0,1·103(7,02–0,3)=1445кДж.
Втрати працездатності азоту
2.3. Задачі для самостійного розв’язання
Задача №1. В процесі підведення теплоти до повітря його температура змінилася від t 1=NºC до t 2=(100+2·N)ºC. При цьому була виконана питома робота l =(200+5N)кДж/кг. Визначити повну кількість теплоти, якщо при нормальних умовах газ займав об’єм V н=(10+2·N)м3. Задача №2. Дослідами встановлені такі значення мольної теплоємності окислу вуглецю
По цим даним скласти приблизне інтерполяційне рівняння виду Задача №3. Повітря охолоджується в процесі з постійним об’ємом, від t 1=(800+5·N)ºC до t 2=(100+3·N)ºC. Об’єм повітря V =Nм3, початковий тиск Р 1=(0,5+0,1·N) МПа. Визначити кількість відведеної теплоти, враховуючи залежність теплоємності від температури. Задача №4. Стан газу під поршнем циліндру визначається точкою 1. Газ переводиться у стан 2 по шляху 1-а-2: спочатку по ізохорі 1-а, а потім по ізобарі а-2. У другому разі газ переводиться у стан 2 по шляху 1-b-2: спочатку по ізобарі 1-b, а потім по ізохорі b-2. Чи будуть відрізнятися кількості підведеної і відведеної теплоти в цих процесах, якщо тиски в точках 1 і 2 дорівнюють відповідно (0,1+0,01·N) МПа і (0,5+0,1·N) МПа, а зміна об’єму V 2- V 1=(1+0,1·N)м3. Задача №5. Скільки кілограмів свинцю можливо нагріти від температури t 1=(5+N)ºC до температури плавлення tпл =327ºC ударом молоту масою m =(200+5·N)кг при падінні його з висоти h =4м. Теплоємність свинцю ср =0,1256кДж/(кг·К). Допустити, що вся енергія молоту перетворюється в теплоту, яка поглинається свинцем. Задача №6. В закритій судині об’ємом V =(500+5·N) літрів знаходиться кисень при тиску Р 1=(0,2+0,1·N) МПа і t 1=(20+2·N)ºC. Яку кількість теплоти необхідно підвести до повітря, щоб його температура піднялася до t 2=(150+5·N)ºC. Задачу вирішити для трьох випадків залежності теплоємності від температури. Задача №7. В каналі довільної форми рухається повітря між двома перерізами потоку до нього підводиться теплота Q =(500+5·N)кДж/с. Параметри потоку в двох перерізах: і 1=(250+2·N)кДж/кг, і 2=(300+N)кДж/кг, w 1=(5+0,1·N)м/с, w 2=(10+0,2·N)м/с. Перерізи потоку розміщені горизонтально. Визначити витрату газу. Задача №8. Визначити масову та об’ємну теплоємності газової суміші, що складається з двох компонентів Задача № 9. Побудувати в діаграмі T-S для азоту в інтервалі від 0 до 100ºС ізобари: Р 1=0,5 МПа, Р 2=1 МПа. Задача №10. Визначити ексергію CO2 в балоні. Тиск газу в балоні Р =(25+0,5·N) МПа, температура t 1=20ºC. Об’єм балона V =(0,5+0,01·N)м3. Параметри навколишнього середовища Р 0=0,1 МПа, t 0=20ºC. Задача №11. визначити зміну ентропії навколишнього середовища, якщо максимально корисна робота складає L max=(200+10·N) кДж, а робота яку виконав газ L менша від максимальної на (30+N)%. Початкові параметри газу Р 1=2·N МПа, t 1=(150+2·N)ºC, V 1=0,5·N м3. Параметри навколишнього середовища Р 0=0,2 МПа, t 0=NºC. Вид газу вибрати згідно з умовами задачі № 1.
2.4. Питання для самоперевірки та контролю засвоєння знань
1. Формулювання та аналітичний вираз І закону термодинаміки. 2. Формулювання та аналітичний вираз ІІ закону термодинаміки. 3. Позначення та одиниці вимірювання теплоти і роботи. 4. Питома теплота та робота. 5. Теплоємність. 6. Істина та середня теплоємність. 7. Ізобарна та ізохорна теплоємність. 8. Теплоємність газової суміші. 9. Формули для визначення підведеної або відведеної теплоти в процесі. 10. Рівняння І закону термодинаміки для потоку. 11. Об’єднане рівняння І і ІІ закону термодинаміки. 12. Повна та питома величина максимальної корисної роботи. 3. ТЕРМОДИНАМІЧНІ ПРОЦЕСИ ІДЕАЛЬНИХ ГАЗІВ 3.1. Основні розрахункові рівняння
1. Ізохорний процес, V = const
2. Ізобарний процес, Р = const
3. Ізотермічний процес, Т = const
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 156; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.108.54 (0.297 с.) |
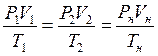
 = g 1 + g 2 + … + gп = 1;
= g 1 + g 2 + … + gп = 1;




 rі × rі, кг/м3;
rі × rі, кг/м3;  кг/м3
кг/м3 м3/ кг
м3/ кг  м3/ кг
м3/ кг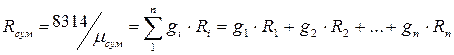


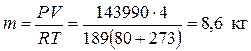
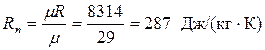
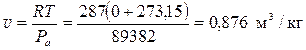





 .
.
 ;
; ;
;
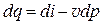 .
.
 .
.
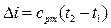 ,
, початкова і кінцева температури тіла.
початкова і кінцева температури тіла. .
.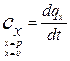 ;
;
 .
.
 ;
;  ,
,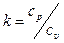
 cv
cv

 , де a,b,d,е – постійні коефіцієнти, t – температура, середня теплоємність визначається за допомогою таблиць по формулі:
, де a,b,d,е – постійні коефіцієнти, t – температура, середня теплоємність визначається за допомогою таблиць по формулі:
 ; об’ємна,
; об’ємна,  ; мольна,
; мольна, 
 ;
; ,
, ,
, ;
; 
 ;
; 
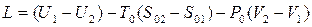 ;
;  .
.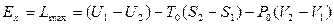 ;
; 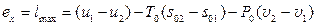 .
. срm -? с´рm -? сvm -? с´vm -?
срm -? с´рm -? сvm -? с´vm -? = 32 кг/кмоль.
= 32 кг/кмоль.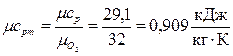 ;
;  .
. ;
;  .
.
 ;
;
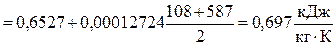 ;
;
 ;
;
 .
.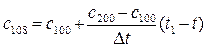
 ;
; ;
; ;
; .
. ,
, ;
; ;
; ;
; .
. ;
; .
. ;
; .
. Дано: V 1=2м3, t 1=10ºC, Р 1=0,3МПа, t 2=400ºC, газ SO2, Р =const, V =const
Дано: V 1=2м3, t 1=10ºC, Р 1=0,3МПа, t 2=400ºC, газ SO2, Р =const, V =const .
. .
. ;
; .
. ,
, .
. ;
; .
. , тоді
, тоді  .
. ;
; .
. ;
;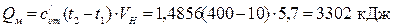 .
. ;
;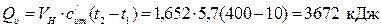 .
.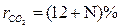 ,
,  ,
, 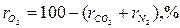 . Прийняти теплоємність незалежною від температури.
. Прийняти теплоємність незалежною від температури. ,
,  ,
, 



 ;
; ;
; .
. ;
;  ;
;  .
. ;
;  ;
; 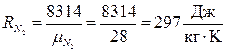 .
. ;
;  ;
; 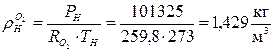 .
. ;
;  ;
;  .
. .
.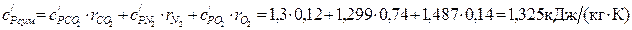 .
. Lтехн -?
Lтехн -?
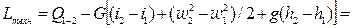
 .
. Дано: Р 1=3МПа
Дано: Р 1=3МПа  ; t 1=90ºC; V 1=300л=0,3м3; Р 0=0,1МПа; t 0=10ºC; Δ Sсист =1кДж/К
; t 1=90ºC; V 1=300л=0,3м3; Р 0=0,1МПа; t 0=10ºC; Δ Sсист =1кДж/К .
. .
. ;
;  .
. .
. .
. ;
; ;
;  .
.
 .
. ,
, .
. .
. .
. ,
,  в інтервалі температур від t 1=(50+3·N)ºC до t 2=(500+2·N)ºC. Прийняти теплоємність залежною від температури.
в інтервалі температур від t 1=(50+3·N)ºC до t 2=(500+2·N)ºC. Прийняти теплоємність залежною від температури. lv = 0; qv =
lv = 0; qv =  U = cvm (t 2 - t 1);
U = cvm (t 2 - t 1);  l p= p ×(v 2 – v 1); q p=
l p= p ×(v 2 – v 1); q p= 


