
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле
Лабораторный практикум «Физико-химические методы исследования материалов, реагентов и углеводородных систем» «Нефтегазовое дело» Магистр
Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле Цель работы Построить изотерму адсорбции, проверить применимость к ней уравнений Фрейндлиха и Ленгмюра, оценить удельную поверхность активированного угля. Сущность работы Для границы раздела «твердое тело – раствор ПАВ» возможно прямое экспериментальное определение удельной адсорбции, например, статическим методом. В статическом методе определяют концентрацию исходного раствора, перемешиванию навески адсорбента в каждом раствора в течение определенного времени, необходимого для установления адсорбционного равновесия, фильтрованию и определению равновесной концентрации растворенного вещества в фильтратах. Оборудование и реактивы Перемешивающее устройство (шейкер); бюретка объемом 25 мл – 1 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 5 мл – 1 шт.; колбы круглые объемом 250 мл – 4 шт.; колбы конические объемом 250 мл – 6 шт; стакан химический объемом 150 мл – 1 шт.; стакан химический объемом 50 мл – 1 шт.; стакан химический объемом 250 – 300 мл – 1 шт.; воронка химическая - 4 шт.; фильтр беззольный «белая лента» – 4 шт.; гидроксид натрия – 0,1 н. раствор; фенолфталеин; растворы карбоновых кислот (муравьиной, уксусной). Выполнение работы 1. Получить у преподавателя раствор кислоты. 2. Отобрать пробу кислоты в химический стакан объемом 150 мл. 3. Приготовить 4 раствора путем последовательного разведения в 2 раза: 3.1. В круглые колбы № 2, № 3 и № 4 отобрать мерной пипеткой по 50 мл дистиллированной воды; 3.2. В колбы № 1 и № 2 мерной пипеткой объемом 50 мл поместить по 50 мл исходного раствора кислоты; 3.3. Из колбы № 2 при помощи мерной пипетки 50 мл раствора перенести в колбу № 3 и перемешать. 3.4. Из колбы № 3 при помощи мерной пипетки отобрать 50 мл раствора, перенести в колбу № 4, перемешать. 3.5. Из колбы №4 мерной пипеткой отобрать 50 мл раствора и выбросить. 4. В каждую колбу с приготовленными растворами высыпать по навеске 3 г активированного угля. 5. Колбы поставить на перемешивающее устройство на 15 минут.
6. Осторожно слить растворы через бумажный фильтр в конические колбы под теми же номерами, стараясь, чтобы основная масса угля осталась в круглой колбе. 7. Определить концентрацию кислоты в исходном С 0 и равновесных С * растворах по следующей методике. 7.1. В 2 конические колбы мерной пипеткой объемом 5 мл отобрать по 5 мл пробы. 7.2. В каждую колбу добавить немного дистиллированной воды (до толщины слоя жидкости около 5 мм). 7.3. В каждую колбу прилить по 3-4 капель индикатора – фенолфталеина. 7.4. Отобрать раствор щелочи в химический стакан объемом 50 мл. 7.5. Из стакана раствор щелочи налить в бюретку. 7.6. Выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан со щелочью и нажать на шарик. 7.7. Довести объем щелочи в бюретке до отметки «0». 7.8. Титровать одну из колб с пробой кислоты раствором гидроксидом натрия до перехода окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. 7.9. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. 7.10. Довести объем щелочи в бюретке до отметки «0» и провести титрование пробы во второй конической колбе. 7.11. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. Содержание протокола лабораторной работы Масса навески угля g = __________ г Концентрация раствора щелочи С (NaOH) = ________ экв/л. Слабый электролит (название и химическая формула). Ориентировочная концентрация слабого электролита (указана на емкости с кислотой). Объем аликвоты Va = ________ мл. Таблица 1. Результаты анализа проб кислоты
Таблица 2. Данные для построения изотерм адсорбции
7. Построить изотерму удельной адсорбции кислоты в координатах Г = f (C) (рис. 1).
Рис. 1. Изотерма удельной адсорбции. 8. Построить изотерму адсорбции Фрейндлиха в координатах lgГ = f (lg C) и вычислить коэффициенты уравнения Фрейндлиха по уравнению линии тренда (рис. 2).
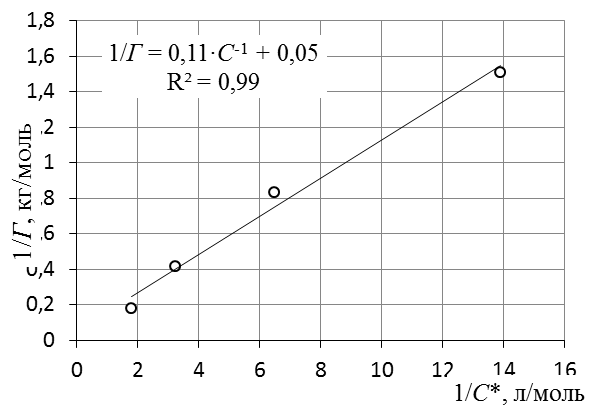
Рис. 2. Линейная форма уравнения адсорбции Фрейндлиха. lg K = 0,97; 1/ n = 1,04. 9. Построить график линейной формы изотермы адсорбции Ленгмюра в координатах 1/Г = f (1/ C) (рис. 3).
Рис. 3. Линейная форма уравнения адсорбции Ленгмюра в координатах 1/Г = f (1/ C). 10. По уравнению линии тренда определить константы уравнения Ленгмюра Г ∞ и K. 11. Оценить удельную поверхность активированного угля по уравнению
где NA – число Авогадро; SM – площадь поперечного сечения молекулы адсорбата, равная для карбоновых кислот 20,5×10-20 м2. Содержание отчета по лабораторной работе 1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Цель работы Определить характеристики ионообменной смолы: полную обменную емкость (ПОЕ) и обменную емкость до проскока (ДОЕ) динамическим методом. Сущность работы Получить выходную кривую сорбента. Через колонку (бюретку) заполненную слоем ионита высотой не менее 10 см медленно пропускают раствор соли металла известной концентрации. На выходе из колонки раствор собирают порциями в мерные цилиндры, точно определяя объем каждой порции и содержание поглощаемых ионов. По данным эксперимента строят график в координатах: объем раствора, прошедшего через ионит – концентрация иона. По графику определяют ПОЕ и ДОЕ. Оборудование и реактивы Колонка с катионитом; мерный цилиндр объемом 10 мл – 2 шт.; пипетка Мора объемом 10 мл – 1 шт.; колбы конические объемом 250 мл – 2 шт.; бюретка для титрования объемом 25 мл – 1 шт.; стакан химический объемом 100 мл – 2 шт.; стакан химический объемом 50 мл – 2 шт.; Трилон Б – 0,05 М раствор; мурексид; хлорид аммония – 1 н. раствор; гидроксид аммония – разбавленный 1:1; сульфаты меди, никеля, кобальта – 0,05 н. растворы. Выполнение работы 1. Получить от преподавателя раствор соли металла для исследования. 2. Отобрать пробу раствора соли металла в маркированный химический стакан объемом 100 мл. 3. Провести анализ исходного раствора соли металла. 3.1. Анализ содержания меди (2+): 3.1.1. В две конические колбы вместимостью 250 мл мерной пипеткой вместимостью 10 мл отобрать аликвоты объемом 10 мл. 3.1.2. К отобранным аликвотам добавить по каплям при перемешивании водный раствор аммиака до получения прозрачного синего раствора. 3.1.3. К каждой из проб добавить немного сухого индикатора «мурексид». После добавления индикатора цвет раствора должен быть достаточно интенсивным, но не слишком насыщенным. 3.1.4. Прилить дистиллированной воды до объема 20-30 мл. 3.1.5. В химический стакан вместимостью 50 мл отобрать некоторое количество раствора трилона Б. 3.1.6. Из стакана раствор трилона Б налить в бюретку. 3.1.7. Выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик. 3.1.8. Довести объем трилона Б в бюретке до отметки «0».
3.1.9. Титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от цвета хаки к сиренево-фиолетовому. Полученное значение объема титранта записать в протокол лабораторной работы. 3.1.10. Довести объем щелочи в бюретке до отметки «0» и провести титрование пробы во второй конической колбе. Полученное значение объема титранта записать в протокол лабораторной работы. 3.2. Анализ содержания кобальта и никеля. 3.2.1. В две конические колбы вместимостью 250 мл мерной пипеткой вместимостью 10 мл отобрать аликвоты объемом 10 мл. 3.2.2. К каждой из аликвот при помощи мерного цилиндра вместимостью 10 мл прилить по 5-7 мл ратсвора хлорида аммония. 3.2.3. К каждой из проб добавить немного сухого индикатора «мурексид». После добавления индикатора цвет раствора должен быть достаточно интенсивным, но не слишком насыщенным. 3.2.4. Прилить дистиллированной воды до объема 20-30 мл. 3.2.5. В химический стакан вместимостью 50 мл отобрать некоторое количество раствора трилона Б. 3.2.6. Из стакана раствор трилона Б налить в бюретку. 3.2.7. Выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан с трилоном Б и нажать на шарик. 3.2.8. Довести объем трилона Б в бюретке до отметки «0». 3.2.9. Титровать одну из колб с пробой раствором трилона Б до перехода окраски до перехода окраски индикатора в эквивалентной точке от желтого цвета к фиолетовому. Полученное значение объема титранта записать в протокол лабораторной работы. 3.2.10. В процессе титрования раствор краснеет и следует поддерживать желтую окраску раствора, добавляя несколько капель аммиака. 3.2.11. Довести объем щелочи в бюретке до отметки «0» и провести титрование пробы во второй конической колбе. Полученное значение объема титранта записать в протокол лабораторной работы. 4. Налить в колонку раствор соли металла. Осторожно открыть кран так, чтобы раствор проходил через ионит со скоростью 3 – 4 мл в минуту (примерно 1 капля в секунду). 5. Фильтрат собирать в мерный цилиндр порциями по 10 мл. 6. Каждую порцию анализировать на содержание в ней иона металла по методикам, описанным в п. 3. Результаты титрования заносить в таблицу 8 протокола лабораторной работы. 7. Пропускать раствор соли металла через колонку продолжать до тех пор, пока концентрация металла на выходе из колонки не станет равной исходной. ИЛИ! Объем трилона Б на титрование порции из колонки не станет равным объему трилона Б при титровании исходной соли металла.
Содержание протокола лабораторной работы 1. Наименование соли металла и ее химическая формула. 2. Масса катионита: m = _____________ г. 3. Объем катионита: VK = ____________ мл. 4. Концентрация раствора трилона Б: С Т = ________ моль/л. 5. Объем аликвоты: Va = _________ мл. 6. Объем трилона Б, расходованный на титрование исходного раствора соли металла:
Таблица 1. Данные для расчета выходной кривой сорбции
Таблица 2 Зависимость концентрации сульфата металла в фильтрате от объема раствора, пропущенного через колонку с катионитом
2. Построить график выходной кривой ионообменной адсорбции
Рис. 1. Обработка выходной кривой ионообменной адсорбции. 3. Вычислить полную обменную емкость ионита по уравнению
где С 0 – исходная концентрация иона металла в растворе, моль/л; V М – объем раствора, соответствующий половине исходной концентрации и определяемый графически по выходной кривой, мл; m – масса сухого ионита, г. 4. Вычислить динамическую обменную емкость до проскока по уравнению
Содержание отчета по лабораторной работе 1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Экспериментальные данные (см. протокол к лабораторной работе). 5. Обработка экспериментальных данных. 6. Вывод. Получение кривой разгонки
Цель работы Анализ смеси соляной и уксусной кислот методом кондуктометрического титрования. Сущность метода Методом индикаторного титрования определить концентрацию сильной и слабой кислоты в совместном присутствии мало реально. Обычно индикаторным титрованием определяют общее содержание обеих кислот. Оборудование и реактивы Штатив с лапкой, колбы конические объемом 100 мл – 2 шт.; пипетка мерная объемом 5 или 10 мл – 1 шт.; бюретка объемом 25 мл – 1 шт.; гидроксид натрия, раствор, фенолфталеин – раствор. Выполнение работы 1. В 2 конические колбы пипеткой Мора отобрать аликвотные объемы 5 или 10 мл, добавить немного дистиллированной воды (до толщины слоя жидкости около 5 мм) и 2−3 капли индикатора – фенолфталеина. 2. Бюретку на 25 мл наполнить титрованным раствором едкого натра. Кончик бюретки должен быть заполнен раствором, а уровень жидкости доведен точно до нулевого деления. Затем медленно, по каплям, добавлять раствор щелочи из бюретки к аликвоте кислоты, непрерывно перемешивая раствор в конической колбе.
3. Эквивалентную точку определить по переходу окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. 4. Титрование повторить 2−3 раза, измеренные эквивалентные объемы щелочи усреднить. Цель работы Анализ смеси соляной и уксусной кислот методом кондуктометрического титрования. Сущность метода Определение основано на последовательном взаимодействии с NaOH сильных и слабых кислот. При титровании сначала нейтрализуется сильная кислота, электропроводность линейно понижается, что вызывается уменьшением концентрации Н+. Затем титруется слабая кислота и электропроводность раствора несколько увеличивается за счет повышения концентрации растворимых солей. После второй точки эквивалентности рост электропроводности объясняется избытком NaOH и присутствием подвижных ионов ОН-. Оборудование и реактивы Кондуктометр; электрод для измерения электропроводности; магнитная мешалка; бюретка объемом 25 мл; мерная пипетка объемом 10 мл; химический стакан объемом от 200 до 250 мл; химический стакан объемом 50 или 100 мл; раствор гидроксида натрия концентрацией ___ экв/л; пробы для проведения анализа. Выполнение работы 1. В химический стакан объемом 200 мл при помощи мерной пипетки вместимостью 10 мл отобрать пробу объемом 10 мл. 2. В бюретку залить раствор щелочи и «занулить» ее. 3. Стакан с пробой поставить на магнитную мешалку. 4. Поместить в стакан якорь для перемешивания. 5. Опустить в стакан с пробой электрод для измерения электропроводности. Электрод следует опустить максимально низко, однако он не должен мешать перемешиванию раствора. 6. Добавить в стакан с пробой дистиллированную воду в таком количестве, чтобы щель электрода была закрыта раствором. 7. Включить кондуктометр. 8. Запустить магнитную мешалку. 9. Значение электропроводности на экране прибора занести в таблицу 10 протокола лабораторной работы, отметив единицы измерения электропроводности. 10. Титровать пробу кислоты с шагом 1 мл. Значение электропроводности после добавления каждой порции титранта заносить в таблицу 10. 11. Титрант добавлять до получения перегиба зависимости χ = f (V T). 12. После перегиба следует выполнить еще 5-7 измерений электропроводности. Таблица 1. Данные для построения кривой кондуктометрического титрования
Цель работы Получить спектр поглощения соли металла и определить его аналитическую длину волны. Сущность работы Спектр поглощения обычно представляют в виде графика, на котором по оси абсцисс откладывают длину волны, а на оси ординат – оптическую плотность раствора. Аналитической называется длина волны, при которой наблюдается максимальное поглощение света (оптическая плотность). Оборудование и реактивы Фотоколориметр или спектрофотометр; кюветы толщиной 1 см; мерная колба объемом 200 мл – 1 шт.; мерная колба объемом 50 мл – 2 шт.; пипетка мерная объемом 5 мл – 2 шт.; пипетка мерная объемом 2 мл – 1 шт.; химические стаканы объемом 100 или 50 мл – 3 шт.; стандартный раствор соли железа, с содержанием железа 2 г/л; раствор роданида калия (или аммония) концентрацией 1 моль/л; азотная кислота, разбавленная 1:1; дистиллированная вода; салфетки для протирки кювет. Выполнение работы Приготовить рабочий раствор 1.1. В маркированный химический стакан объемом 100 мл налить стандартный раствор сульфата; 1.2. Из маркированного химического стакана в мерную колбу объемом 100 мл мерной пипеткой отобрать 50 мл стандартного раствора; 1.3. Довести объем раствора до метки дистиллированной водой; 1.4. Закрыть колбу пробкой и перемешать, переворачивая колбу не менее 20 раз. Рабочий раствор сохранить до конца выполнения лабораторной работы. 2. Выполнить измерения оптической плотности при разных длинах волн: 4.1. В кювету толщиной 1 см налить до метки раствор сравнения – дистиллированную воду – и насухо протереть стенки кюветы салфеткой; кювету с раствором сравнения поместить в дальнее отделение кюветодержателя. 4.2. В другую кювету толщиной 1 см налить до метки окрашенный раствор соли металла и насухо протереть стенки кюветы салфеткой; кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя. 4.3. Измерить оптическую плотность раствора при различных длинах волн в диапазоне от 360 до 640 нм с шагом 20 нм, следуя инструкции к пользованию прибором. Результаты измерений занести в протокол лабораторной работы (табл. 1). Таблица 1 Зависимость оптической плотности от длины волны
Цель работы Определить концентрацию железа (III) в растворе по измеренному значению оптической плотности методом градуировочного графика, построенного по серии контрольных растворов. Сущность работы Ион железа (III) с ионами тиоцианата, образует комплексное соединение кроваво-красного цвета. Раствор бледнеет вследствие восстановления ионов железа ионами роданида. Поэтому фотометрировать раствор необходимо сразу же после приготовления. Раствор окрашенного комплекса имеет максимум поглощения при длине волны 480 нм. Оборудование и реактивы Фотоколориметр; кюветы толщиной 1 см – 2 шт.; химические стаканы объемом 100 мл – 3 шт.; химический стакан объемом 50 мл – 1 шт.; мерная колба объемом 200 мл – 1 шт.; мерные колбы объемом 50 мл – 8 шт.; пипетка мерная объемом 5 мл – 2 шт.; пипетка мерная объемом 2 мл – 1 шт.; пипетка градуированная объемом 10 мл – 2 шт.; стандартный раствор соли железа с содержанием железа 2 г/л; азотная кислота, разбавленная 1:1; роданид аммония (или роданид калия) – 1 М раствор; дистиллированная вода; салфетки для протирания кювет; проба раствора с концентрацией по железу 5 – 15 г/л. Выполнение работы Подготовить пробу. 4.1. В мерную колбу объемом 50 мл № 7 отобрать мерной пипеткой 5 мл исследуемого раствора. 4.2. При помощи мерных пипеток к пробе раствора в мерной колбе добавить 2 мл раствора азотной кислоты и 5 мл раствора роданида калия (мерной пипеткой объемом 5 мл). 4.3. Долить дистиллированную воду до метки на горле колбы. 4.4. Закрыть колбу пробкой и перемешать раствор, переворачивая колбу не менее 20 раз. 5. Выполнить измерение оптической плотности. 5.1. Измерять оптическую плотность следует при длине волны 480 нм. 5.2. Вначале измерить оптические плотности контрольных растворов, затем, ополоснув кювету, измерить оптическую плотность пробы. 5.3. Начинать измерения оптической плотности контрольных растворов следует с самого разбавленного (наименее окрашенного). 5.4. В кювету толщиной 1 см налить до метки раствор сравнения и насухо протереть стенки кюветы салфеткой. 5.5. Кювету с раствором сравнения поместить в дальнее отделение кюветодержателя. 5.6. В другую кювету толщиной 1 см налить до метки окрашенный раствор, содержащий роданидный комплекс железа (III) и насухо протереть стенки кюветы салфеткой. 5.7. Кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя. 5.9. Измерить оптическую плотность, следуя инструкции к пользованию прибором. 5.10. Результаты измерений занести в протокол лабораторной работы (табл. 1). 5.11. Повторить операции с 5.6 по 5.10 со всеми растворами. 5.12. Результаты измерений занести в протокол лабораторной работы (табл. 1). Таблица 1 Значения оптической плотности контрольных растворов и пробы
Таблица 2. Данные для построения градуировочной зависимости
4. По данным таблицы 2 построить градуировочный график в координатах D – m (Fe) (рис. 5). 5. По градуировочному графику (см. рис. 5) или уравнению линии тренда определить массу железа, содержащуюся в пробе раствора, взятой для выполнения анализа 6. Рассчитать массовую концентрацию железа в пробе раствора по формуле
где
Рис. 5. Определение массы железа (III) в пробе раствора по градуировочной зависимости. Краткие сведения Чистая вода в небольших слоях бесцветна. В толстом слое она имеет голубоватый оттенок. Иные оттенки свидетельствуют о наличии в воде различных растворенных примесей. Повышение цветности воды обусловлено наличием гуминовых веществ, коллоидных соединений железа, взвешенных и окрашенных веществ и массовым цветением водорослей. Цветность питьевой воды по нормам ГОСТ 2874-73 не должна превышать 20°. Цель работы Определить показатель цветности водопроводной или речной воды. Для водопроводной воды сравнить данный показатель для линии холодного и горячего водоснабжения. Сущность метода Измеряют оптическую плотность пробы воды при длине волны 413 нм. По градуировочной зависимости определяют градус цветности. Оборудование и реактивы Фотоколориметр; кювета толщиной 5 см – 2 шт.; мерные колбы объемом 100 мл – 9 шт.; бюретка объемом 25 мл – 1 шт.; штатив с лапкой – 1 шт.; стакан химический объемом 100 мл – 3 шт.; контрольный раствор № 1; контрольный раствор № 2; проба воды для анализа. Выполнение работы Таблица 1 Значения оптической плотности контрольных растворов и пробы
Лабораторный практикум «Физико-химические методы исследования материалов, реагентов и углеводородных систем» «Нефтегазовое дело» Магистр
Исследование молекулярной адсорбции растворенного вещества из растворов на активированном угле Цель работы Построить изотерму адсорбции, проверить применимость к ней уравнений Фрейндлиха и Ленгмюра, оценить удельную поверхность активированного угля. Сущность работы Для границы раздела «твердое тело – раствор ПАВ» возможно прямое экспериментальное определение удельной адсорбции, например, статическим методом. В статическом методе определяют концентрацию исходного раствора, перемешиванию навески адсорбента в каждом раствора в течение определенного времени, необходимого для установления адсорбционного равновесия, фильтрованию и определению равновесной концентрации растворенного вещества в фильтратах. Оборудование и реактивы Перемешивающее устройство (шейкер); бюретка объемом 25 мл – 1 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 5 мл – 1 шт.; колбы круглые объемом 250 мл – 4 шт.; колбы конические объемом 250 мл – 6 шт; стакан химический объемом 150 мл – 1 шт.; стакан химический объемом 50 мл – 1 шт.; стакан химический объемом 250 – 300 мл – 1 шт.; воронка химическая - 4 шт.; фильтр беззольный «белая лента» – 4 шт.; гидроксид натрия – 0,1 н. раствор; фенолфталеин; растворы карбоновых кислот (муравьиной, уксусной). Выполнение работы 1. Получить у преподавателя раствор кислоты. 2. Отобрать пробу кислоты в химический стакан объемом 150 мл. 3. Приготовить 4 раствора путем последовательного разведения в 2 раза: 3.1. В круглые колбы № 2, № 3 и № 4 отобрать мерной пипеткой по 50 мл дистиллированной воды; 3.2. В колбы № 1 и № 2 мерной пипеткой объемом 50 мл поместить по 50 мл исходного раствора кислоты; 3.3. Из колбы № 2 при помощи мерной пипетки 50 мл раствора перенести в колбу № 3 и перемешать. 3.4. Из колбы № 3 при помощи мерной пипетки отобрать 50 мл раствора, перенести в колбу № 4, перемешать. 3.5. Из колбы №4 мерной пипеткой отобрать 50 мл раствора и выбросить. 4. В каждую колбу с приготовленными растворами высыпать по навеске 3 г активированного угля. 5. Колбы поставить на перемешивающее устройство на 15 минут. 6. Осторожно слить растворы через бумажный фильтр в конические колбы под теми же номерами, стараясь, чтобы основная масса угля осталась в круглой колбе. 7. Определить концентрацию кислоты в исходном С 0 и равновесных С * растворах по следующей методике. 7.1. В 2 конические колбы мерной пипеткой объемом 5 мл отобрать по 5 мл пробы. 7.2. В каждую колбу добавить немного дистиллированной воды (до толщины слоя жидкости около 5 мм). 7.3. В каждую колбу прилить по 3-4 капель индикатора – фенолфталеина. 7.4. Отобрать раствор щелочи в химический стакан объемом 50 мл. 7.5. Из стакана раствор щелочи налить в бюретку. 7.6. Выпустить воздух из носика бюретки, для чего поднять носик бюретки, подставить стакан со щелочью и нажать на шарик. 7.7. Довести объем щелочи в бюретке до отметки «0». 7.8. Титровать одну из колб с пробой кислоты раствором гидроксидом натрия до перехода окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. 7.9. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. 7.10. Довести объем щелочи в бюретке до отметки «0» и провести титрование пробы во второй конической колбе. 7.11. Полученное значение объема щелочи занести в таблицу 6 протокола лабораторной работы. Содержание протокола лабораторной работы Масса навески угля g = __________ г Концентрация раствора щелочи С (NaOH) = ________ экв/л. Слабый электролит (название и химическая формула). Ориентировочная концентрация слабого электролита (указана на емкости с кислотой). Объем аликвоты Va = ________ мл. Таблица 1. Результаты анализа проб кислоты
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.154.41 (0.177 с.) |


 ;
;  .
. ,
, = ____________ мл.
= ____________ мл. = ____________ мл.
= ____________ мл. = ____________ мл.
= ____________ мл.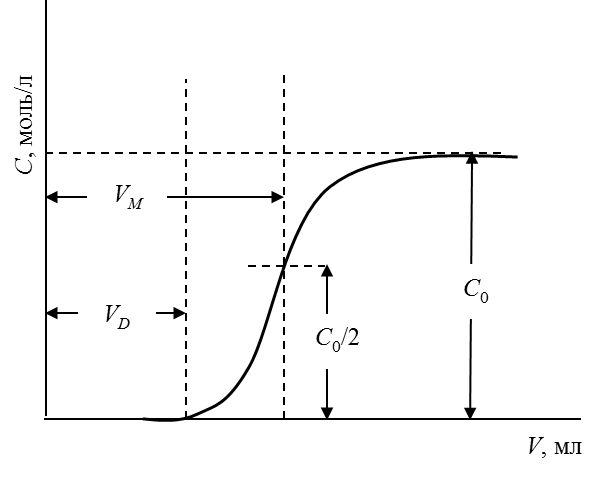
 ,
, .
. .
. ,
, – объем пробы раствора, взятый для анализа, мл.
– объем пробы раствора, взятый для анализа, мл.



