
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретичні критерії адгезії покриттів до металів
Адгезія покриттів до металів пов'язана з контактною активністю останніх. Як теоретичні критерії адгезії й контактної активності металів приймають наступні критерії. I. Термодинамічний критерій. (Ізобарні потенціали При хімічній взаємодії на границі покриття з підложкою виникають хімічні зв'язки й утворюються нові хімічні сполуки. Вважається, що робота адгезії зв'язана з вільними енергіями утворення відповідних сполук. Чим більше негативна вільна енергія утворення сполуки II. Енергетичний критерій. (Середні енергії одиничних зв'язків Me–О, Me'–Мe" та ін., або в першому наближенні, середні енергії атомізації U ат відповідних сполук). Адгезія обумовлена силами притягання атомів, що перебувають у різних фазах. Отже, безпосередньою мірою адгезії служить робота роз'єднання атомів або, іншими словами, робота (енергія) розриву міжатомних зв'язків, що доводяться на одиницю поверхні розподілу. Роботу розриву хімічного зв'язку часто називають енергією міжатомної хімічної взаємодії або просто енергією зв'язку. Вона визначається роботою атомізації речовини. Робота, витрачена на роз'єднання атомів однофазного тіла, є робота когезії. Роботу когезії W К простої речовини можна розглядати як добуток числа атомів, розташованих у площині розриву (N 0ρ/ M)2/3 на середню енергію розриву половини зв'язків, що доводяться на один атом U ат/2 N 0, тобто
де U ат – енергія атомізації 1 г-ат речовини; N o – число Авогадро; ρ – щільність, М – атомна вага. Теоретична міра адгезії металу до окислу того ж металу і навпаки, у найпростішому трактуванні приблизно виражається добутком середньої енергії U i одиничного зв'язку Mе Т – О на число зв'язків W a = U i Число зв'язків, що виникли до моменту часу t, обумовлюється кінетикою процесу взаємодії покриття з даною підложкою і представляє складну функцію багатьох параметрів. На відміну від найпростішого шляху розрахунку когезії неможливо визначити число зв'язків III. Електрохімічний критерій. (Нормальні електродні потенціали металів
На границях розподілу двох фаз завжди утворюються подвійні електричні шари, у яких різнойменні заряди розподілені нерівномірно. Ця обставина веде до виникнення контактної різниці потенціалів. Стрибок потенціалу ( Залежно від природи речовини, що перебуває в контакті з металом, металева поверхня може нести як позитивний, так і негативний заряд. У розплавах окислів поверхні металів і сплавів звичайно заряджаються негативно, що пов’язано з окислюванням поверхні й переходом іонів металу в розплав. По стрибку потенціалу на границі метал-розплав або, по величині нормального електродного потенціалу металу Величини Встановлено, що електродні потенціали металів періодично пов'язані з їхніми атомними номерами й залежать від структури зовнішніх електронних оболонок атомів. IV. Електронно-структурний критерій. (Ступінь недобудованості електронних оболонок атомів і статистична вага атомів зі стабільними електронними конфігураціями - (СBACK). Атом кожного елемента періодичної системи, як відомо, характеризується в ізольованому стані своєю електронною конфігурацією. Численні експериментальні факти дозволяють прослідкувати зв'язок між електронною будовою атомів металів і їхньою контактною активністю. Відомий ряд розташування перехідних металів по убуваючий адгезійної активності до графіту та алмазу в такому виді: IV період Ti, Cr, (V), Mn, Fe, Co, Ni V період Zr, Nb, Mo, Pd VI період W, Pt Ці ряди відповідають розташуванню атомів у періодичній системі за ступенем недобудованості їх зовнішніх електронних оболонок. Порядок порушений лише для ванадію.
При конденсації ізольованих атомів частина валентних електронів локалізується біля кістяків атомів, а частина переходить у нелокалізований (у випадку металів - колективізований) стан. Нелокалізовані (колективізовані) електрони мають підвищений запас енергії, легко збуджуються й передаються від одного тіла до іншого. Найбільша ймовірність взаємодії між двома контактуючими тілами спостерігається в тому випадку, коли передача нелокалізованої частини валентних електронів від атомів одного тіла до іншого приводить до утворення енергетично стійких електронних конфігурацій як у першому, так і в другому з контактуючих тел. Це означає додаткову локалізацію електронів, що приводить до підвищення в системі так званої статистичної ваги атомів зі стабільними конфігураціями (СBACK). Стабільними конфігураціями для d-перехідних металів є d0, d6, d10; для f - перехідних металів — f 0, f 7, f l4; для неперехідних металів — s2, для неметалів — ар3 і s2 p6. Значення СВАСК для локалізованої частини валентних електронів d -перехідних металів у процентних співвідношеннях конфігурацій d0, d5, d10 зіставлені в роботі [9]. Вони дозволяють якісно пояснити багато властивостей перехідних металів; при цьому варто враховувати, що серед стабільних конфігурацій максимально стійка конфігурація d5. Значення СВАСК із d5 конфігураціями закономірно зростають у ряді груп 3а, 4а, 5а, 6а елементів періодичної системи. Згідно Самcонову, взаємодія будь-яких речовин, зокрема твердих і рідких, повинне супроводжуватися обміном електронів з підвищенням СВАСК, що в остаточному підсумку означає зниження сумарної вільної енергії системи. При цьому одні елементи діють переважно як донори електронів, наприклад, скандій, титан, ітрій, цирконій, що прагнуть до підвищення статистичної ваги d0 -конфігурацій, інші — як акцептори, наприклад, ванадій, тантал, ніобій, молібден, вольфрам, оскільки для них характерна тенденція до підвищення статистичної ваги d5 -конфігурацій. Проявлення тої або іншої тенденції в d-металів залежить від числа електронів на d - орбіталях. V. Електростатичний критерій. (Розрядний потенціал і щільність заряду на границях метал-діелектрик). Електрична взаємодія зарядів подвійного електричного шару особливо чітко реєструється при відриві полімерних плівок від твердих поверхонь. Наприклад, швидкий відрив плівок від скла й металу супроводжується світінням у середньому вакуумі або електронної - емісією у високому вакуумі, а на роз'єднаних зразках відзначається наявність залишкового заряду. Світіння є наслідком електричних розрядів, що виникають у зазорі між плівкою та підложкою. Явище розряду спостерігається при досягненні певної, індивідуальної для кожного полімеру, швидкості відриву. Розглянуті вище в принципі якісні й кількісні критерії контактної активності й адгезії матеріалів будуються, здавалося б, на основі різних теоретичних передумов, але вони не суперечливі. Ці критерії взаємозалежні або доповнюють один одного. Часто в одних роботах аналізуються ті особливості взаємодії, яких інші не стосуються. Всі аспекти теорії, узяті разом, дозволяють бачити одне явище образних сторін, про що свідчать дані, поміщені в таблиці.
Міцність сполуки F під час відсутності перехідного шару пов'язана з роботою адгезії W а, співвідношенням
де r 0 – радіус дії міжграничних сил притягання; Створення узагальненої теорії адгезії ускладнюється експериментальними труднощами визначення W a і вторинними процесами (пасивація поверхні металів, утворення проміжних шарів і ін.), що маскують або повністю перекривають первинні явища в їхньому чистому виді. Для цього необхідні нові додаткові експериментальні данні. аблиця 10.2. Середньостатистична міцність сполуки F оксидів з металами
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.218.147 (0.008 с.) |
 , реакцій, що протікають у двомірному моноатомному приграничному шарі.)
, реакцій, що протікають у двомірному моноатомному приграничному шарі.) в моношарі, тим вище робота адгезії.
в моношарі, тим вище робота адгезії. (10.28)
(10.28) , що проходять через одиницю поверхні розподілу
, що проходять через одиницю поверхні розподілу , що виникають на границі метал-розплав).
, що виникають на границі метал-розплав). ) між двома металами дорівнює різниці робіт виходу електрону з одного та іншого металу. Позитивно заряджається поверхня того металу, робота виходу з якого менше. Малими значеннями роботи виходу електрону відрізняються лужні метали, високими–благородні.
) між двома металами дорівнює різниці робіт виходу електрону з одного та іншого металу. Позитивно заряджається поверхня того металу, робота виходу з якого менше. Малими значеннями роботи виходу електрону відрізняються лужні метали, високими–благородні. (10.30)
(10.30) – функція внутрішніх механічних напруг у покритті; n ~ 4.
– функція внутрішніх механічних напруг у покритті; n ~ 4.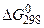 ккал/моль
ккал/моль



