
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коефіцієнт дифузії й енергія активації дифузії
У відповідність з кінетичними представленнями коефіцієнт дифузії D характеризує властивість речовини здійснювати взаємні одиничні переходи атомів у результаті теплового руху. В той же час для переміщення атомів з одного положення в інше необхідно зруйнувати зв'язку і деформувати ґрати кристала, тобто необхідна енергія активації. Величина коефіцієнта дифузії по представленнях Больцмана повинна бути пропорційної кількості атомів, що мають енергією вище енергії активації одиничних перескоків. Число атомів з необхідною енергією активації експоненціально залежить від величини, зворотній температурі. Для відносно вузьких інтервалів температур справедлива найбільш розповсюджена залежність
де D0 – предекспоненційний множник, експериментально знайдений для кожної дифузійної пари. У рівнянні (7.30) Q – енергія активації дифузії, необхідна для переходу атома через енергетичний бар'єр. Енергія активації дифузії істотно вище значення енергії плавлення, але нижче енергії випару. Як окремий випадок, енергія активації самодифузії може бути записана у виді
де Утворення і перенос точкового дефекту пов'язані з ослабленням кристалічних ґрат, руйнуванням і деформацією міжатомних зв'язків. Тому значення енергії активації залежать від сил міжатомного взаємодії, що безпосередньо зв'язано з електронною структурою твердого тіла. Фактори, що впливають на коефіцієнт дифузії Коефіцієнти дифузії сильно залежать від температури, значна різниця також для різних дифузійних пар. Він також залежить і від концентрації, якщо мова йде не про розведені розчини. Можна сформулювати загальні закономірності. За інших рівних умов: 1. енергія активації дифузії менше для невеликих атомів заглиблення, ніж для великих атомів заміщення; 2. енергія активації менше для дифузії в металі - розчиннику з більш низькою температурою плавлення; 3. енергія активації менше для дифузії в ґратах з меншим атомним коефіцієнтом упакування.
Деякі рішення законів Фіка Якщо величина коефіцієнта дифузії D не залежить від координат, то другий закон Фіка прийме вид
1. У стаціонарному стані
2. Як частне рішення для лінійного розміру R, що характеризує область, зайняту речовиною, що дифундує, одержуємо наступний закон його збільшення зчасом:
Значення коефіцієнта К може змінюватися від 2 до Далі, якщо позначити через М повну масу речовини, що дифундує, то із співвідношення М~ρСR3 і попереднього (7.33)одержуємо закон, по якому концентрація убуває з часом в процесі розповсюдження речовини, що дифундує:
Характерна швидкість дифузії речовини, що займає об’єм порядку R3:
3. Розглянемо застосування закону до дифузійної пари, у якої в одному об’ємі концентрація компонента, що дифундує, в момент часу t=0 дорівнює С0, а в іншому об’ємі - нулеві. Рішення диференціального рівняння (7.32) буде мати вигляд:
де С0 – вихідна концентрація компонента, що дифундує; w- перемінна інтегрування. Вираз
називається функцією помилок Гауса. Значення функції помилок беруться з довідника.
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 207; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.107.96 (0.024 с.) |
 (7.30)
(7.30) (7.31)
(7.31)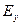 – енергія утворення дефекту;
– енергія утворення дефекту;  – енергія міграції дефекту.
– енергія міграції дефекту. (7.32)
(7.32) , і рішення рівняння (7.32) зводиться до одномірної задачі з прямокутними координатами
, і рішення рівняння (7.32) зводиться до одномірної задачі з прямокутними координатами (7.33).
(7.33). (7.34)
(7.34)
 (7.35)
(7.35) (7.36)
(7.36) (7.37)
(7.37) =
=  (7.38)
(7.38)


