
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оцінка можливості і спрямованості протікання процесів. Розрахунок стандартної зміни енергії Гіббса
Основні поняття і співвідношення Будь-яка хімічна реакція супроводжується виділенням або поглинанням тепла, зміною ентропії, інших термодинамічних характеристик системи. Кількість тепла, що виділяється або поглинається в ході хімічної реакції при заданій температурі початкових речовин і продуктів реакції, називається тепловим ефектом. Тепловий ефект хімічної реакції, що протікає при постійному об'ємі, рівний зміні внутрішньої енергії системи Важливими термодинамічними характеристиками реакції, безпосередньо пов'язаними з напрямом її протікання і величиною константи рівноваги, є зміна енергії Гельмгольца (ізохорно-ізотермічного потенціалу)
де Стехіометричне рівняння реакції в загальному вигляді можна записати наступним, чином:
де Тоді зміну якої-небудь термодинамічної характеристики реакції можна розрахувати за допомогою наступного узагальненого рівняння
де Тепловий ефект реакції при постійному тиску або об'ємі залежить тільки від природи і стану реагентів і продуктів реакції, але не залежить від шляху переходу. Він рівний різниці між сумою теплоти утворення продуктів реакції і сумою теплоти утворення реагентів з їх стехіометричними коефіцієнтами. Відповідно до цього висновку для рівняння (3.22) можна записати
де індекси «кон» і «нач» характеризують продукти реакції і реагенти. За довідковими даними про термодинамічні властивості індивідуальних речовин можна визначити основні термодинамічні характеристики реакції (
Перерахунок вказаних величин з температури 298К на будь-яку іншу температуру вимагає відомостей про теплоємності речовин, які беруть участь в реакції. Температурна залежність теплового ефекту і ентропії реакції визначаються зміною теплоємності Δ сР, розрахованою відповідно до рівняння (3.22):
Температурна залежність енергії Гіббса реакції має вигляд:
причому є функцією температури. Розрахунок теплового ефекту Початковими даними для розрахунку теплового ефекту хімічної реакції служать теплоти утворення речовин, що беруть участь в реакції. В довідниках приводяться теплоти утворення хімічних з'єднань в стандартних умовах, що позначаються через
Перерахунок теплового ефекту реакції з температури 298К на будь-яку іншу температуру здійснюється по рівнянню Кірхгофа, яке в інтегральній формі має вигляд
де
Якщо всередині даного інтервалу температур один або декілька учасників реакції випробовують фазові перетворення, температурний інтервал розбивають на декілька частин:
В кожну суму алгебри входять теплоємності тих фаз, які стійкі в даному інтервалі температур. Теплота перетворення Розрахунок зміни ентропії реакції Ентропія реакції в стандартних умовах підраховується як сума алгебри абсолютних стандартних ентропій учасників реакції
Перерахунок її з температури 298К на будь-яку іншу температуру здійснюється за формулою
За наявності фазових переходів інтервал інтеграції розбивається на окремі ділянки:
Розрахунок зміни енергії Гіббса На практиці частіше мають справу з процесами при постійному тиску, тому для термодинамічного аналізу принципової можливості процесу частіше використовується вільна енергія Гіббса.
За даними, що є в довідковій літературі, можна розрахувати стандартну зміну енергії Гіббса Існує декілька методів розрахунку змін енергії Гіббса хімічних реакцій: 1) метод комбінування хімічних рівноваг; 2) ентропійний метод розрахунку; 3) розрахунок за спектроскопічними даними – метод Ф- потенціалу (абсолютних ентропій, приведених термодинамічних потенціалів); 4) метод Тьомкіна і Шварцмана; Суть методу комбінування хімічних рівноваг полягає в підборі двох або декількох хімічних реакцій з відомими термодинамічними характеристиками, складання стехіометричних рівнянь яких могло б дати рівняння досліджуваній реакції. Оскільки енергія Гіббса є функцією стану системи, її чисельне значення для досліджуваної реакції набувають як результат тих же самих алгебраїчних дій, які здійснені з стехіометричними рівняннями вихідних реакцій. Метод розрахунку із спектроскопічних даних (метод Ф - потенціалу - абсолютних ентропій, приведених термодинамічних потенціалів) використовує умову що при нулі градусів за шкалою Кельвіна Спектральні дані дозволяють безпосередньо визначити значення приведеного ізобарного потенціалу, за допомогою якого можна розрахувати константу рівноваги реакції. Тепловий ефект реакції при абсолютному нулі
Розрахунок В основі ентропійного методу розрахунку лежить відоме термодинамічне рівняння Гіббса-Гельмгольца (3.31) за допомогою якого виконується розрахунок
Вихідними даними для розрахунку служать стандартні теплоти На першому етапі за формулами (3.24) і (3.27) визначають тепловий ефект і зміну ентропії реакції в стандартних умовах. Далі за рівняннями (3.25) і (3.28) проводять перерахунок цих величин з температури 298К на будь-яку іншу температуру. Якщо в досліджуваному інтервалі температур учасники реакцій зазнають фазові перетворення, то інтервал інтеграції розбивається на окремі ділянки відповідно до виразів (3.26) і (3.29). Розрахунок енергії Гіббса можна провести в трьох наближеннях. В першому, найгрубішому, наближенні (за стандартними даними для базової температури 298К) нехтують температурною залежністю термодинамічних функцій, тобто вважають
По цьому рівнянню оцінюють можливість повільного протікання хімічної реакції або фазового перетворення при допущенні, що для реакції сума змін теплоємкості
Подальші наближення засновані на тому положенні, що в широкому температурному інтервалі (298...Т) враховується температурна залежність
Для різних випадків застосовуються різні наближення. В другому наближенні (за середніми теплоємкостями
Можливість помилки виникає у зв'язку з тим, що криволінійна залежність теплоємності від температури замінюється на прямолінійну, що відповідно відображається в значенні Друге наближення ентропійного методу в літературі відоме під назвою наближення Уліха, який додав останній формулі вигляд
Уліх позначив співмножник Таким чином, розрахунок енергії Гіббса реакції за методом Уліха ведеться за формулою
В третьому, найточнішому наближенні – методі розкриття вхідних в рівняння (3.33) інтегралів – враховують температурну залежність термодинамічних функцій, тобто використовують
Виключення інтегральних величин Якщо в даному інтервалі температур речовини, що беруть участь в реакції, не випробовують фазових перетворень, розрахунок ентропійним методом значно полегшують допоміжні таблиці, складені М. І. Тьомкіним і Л.А. Шварцманом. В основі цих таблиць лежать наступні теоретичні міркування. У формулі для зміни енергії Гіббса хімічної реакції
останні два доданки можна об'єднати в одне, використовуючи формулу інтеграції по частинах. Якщо прийняти
Таким чином,
Тоді
І, отже, третій і п'ятий члени в правій частині рівняння скорочуються. Розділивши всі члени на Т, матимемо
Як видно, останній член правої частини рівняння дає поправку до результатів наближеного розрахунку. Введемо позначення
Тоді при а при Якщо теплоємність речовин, що беруть участь в реакції, виражена за допомогою формул
де
Величини
Розділ 4. ЯВИЩА АДСОРБЦІЇ
|
||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 166; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.166.7 (0.039 с.) |
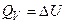 . Якщо хімічна реакція протікає при постійному тиску, її, тепловий ефект рівний зміні ентальпії системи
. Якщо хімічна реакція протікає при постійному тиску, її, тепловий ефект рівний зміні ентальпії системи  .
. для реакцій, що протікають при постійних об'ємі і температурі, і енергії Гіббса (ізобарно-ізотермічного потенціалу)
для реакцій, що протікають при постійних об'ємі і температурі, і енергії Гіббса (ізобарно-ізотермічного потенціалу)  для реакцій при постійних тиску і температурі. Зміна енергії Гельмгольца або енергії Гіббса характеризує максимальну роботу процесу і рівне різниці між відповідним тепловим ефектом і зв'язаною енергією системи:
для реакцій при постійних тиску і температурі. Зміна енергії Гельмгольца або енергії Гіббса характеризує максимальну роботу процесу і рівне різниці між відповідним тепловим ефектом і зв'язаною енергією системи: ,
, 
 – зміна ентропії при протіканні хімічної реакції. Величину часто називають енергією Гіббса хімічної реакції, а
– зміна ентропії при протіканні хімічної реакції. Величину часто називають енергією Гіббса хімічної реакції, а  (3.21)
(3.21) – хімічний символ учасників реакції,
– хімічний символ учасників реакції,  – відповідний стехіометричний коефіцієнт.
– відповідний стехіометричний коефіцієнт. (3.22)
(3.22) – молярне значення термодинамічної функції речовини, що відноситься до продуктів реакції, а
– молярне значення термодинамічної функції речовини, що відноситься до продуктів реакції, а  – відповідне значення для речовини, що відноситься до реагентів.
– відповідне значення для речовини, що відноситься до реагентів. (3.23)
(3.23) ,
,  ,
, 

 і що використовуються для розрахунку теплового ефекту хімічної реакції при 298К по рівнянню (3.22):
і що використовуються для розрахунку теплового ефекту хімічної реакції при 298К по рівнянню (3.22): (3.24)
(3.24)
 (3.25)
(3.25) (3.26)
(3.26) береться з своїм або протилежним знаком залежно від приналежності до продукту реакції або початкової речовини.
береться з своїм або протилежним знаком залежно від приналежності до продукту реакції або початкової речовини. (3.27)
(3.27)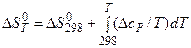 (3.28)
(3.28) (3.29)
(3.29) за стандартними даними
за стандартними даними , що відноситься до стану реакції, в якому парціальний тиск кожного газоподібного компоненту рівний стандартному значенню (101325Па). Стандартна зміна енергії Гіббса дозволяє визначити головну термодинамічну характеристику реакції – константу хімічної рівноваги. Остання дозволяє обчислити вихід будь-якого продукту реакції і встановити оптимальні умови її проведення.
, що відноситься до стану реакції, в якому парціальний тиск кожного газоподібного компоненту рівний стандартному значенню (101325Па). Стандартна зміна енергії Гіббса дозволяє визначити головну термодинамічну характеристику реакції – константу хімічної рівноваги. Остання дозволяє обчислити вихід будь-якого продукту реакції і встановити оптимальні умови її проведення. =0. Це означає, що при абсолютному нулі температур
=0. Це означає, що при абсолютному нулі температур  .
. визначається або із спектральних даних, або з термохімічних даних для будь-якої температури за допомогою рівняння Кірхгофа
визначається або із спектральних даних, або з термохімічних даних для будь-якої температури за допомогою рівняння Кірхгофа (3.30)
(3.30) за стандартною теплотою утворення і стандартним ентропіям речовин, що беруть участь в реакції використовує абсолютні значення ентропій і зведення стандартних значень цієї величини для багатьох речовин які одержують на підставі постулату Планка
за стандартною теплотою утворення і стандартним ентропіям речовин, що беруть участь в реакції використовує абсолютні значення ентропій і зведення стандартних значень цієї величини для багатьох речовин які одержують на підставі постулату Планка (3.31)
(3.31) і теплоємності речовин, що беруть участь в реакції.
і теплоємності речовин, що беруть участь в реакції. . Тоді
. Тоді (3.32)
(3.32)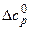 близька до нуля і не залежить від температури. Таку оцінку можна зробити для інтервалу температур від 298К до температури зміни агрегатного стану хоча б одного компоненту реакції. Байдужість величиною
близька до нуля і не залежить від температури. Таку оцінку можна зробити для інтервалу температур від 298К до температури зміни агрегатного стану хоча б одного компоненту реакції. Байдужість величиною  .
. у вигляді
у вигляді (3.33)
(3.33) для інтервалу 298...Т) вважають
для інтервалу 298...Т) вважають  . Тоді
. Тоді (3.34)
(3.34) (3.35)
(3.35) і розрахував його чисельне значення. Добуток
і розрахував його чисельне значення. Добуток  називають функцією Уліха (табл.3.1).
називають функцією Уліха (табл.3.1). (3.36)
(3.36) як функцію температури:
як функцію температури: (3.37)
(3.37)
 або
або  дещо спрощує розрахунок, але помилка при цьому зростає.
дещо спрощує розрахунок, але помилка при цьому зростає.
 , то
, то








 або
або  то
то (3.38)
(3.38) – алгебраїчні суми коефіцієнтів в температурному ряду теплоємності реакції, обчислені відповідно до формули (3.24).
– алгебраїчні суми коефіцієнтів в температурному ряду теплоємності реакції, обчислені відповідно до формули (3.24).

 для різних температур розраховані М.І. Тьомкіним і Л.А. Шварцманом зведені в таблиці 3.2.
для різних температур розраховані М.І. Тьомкіним і Л.А. Шварцманом зведені в таблиці 3.2.


