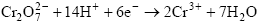Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы реакций окисления-восстановления. ⇐ ПредыдущаяСтр 3 из 3
Вещества, атомы или ионы которых отдают электроны-восстановители (процесс-окислением). Вещества, атомы или ионы которых принимают электроны-окислители (процесс-восстановлением). Важнейшие окислители: KМnO4, H2O2, Cl2, K2Cr2O7, Br2, KClO3, KBrO3, HNO3, I2 и др. Важнейшие восстановители: H2S, Na2S2O3, SnCl, HI, HBr, HCl, FeSO4, MnSO4, KI и др.
Каждую окислительно-восстановительную реакцию можно представить как сумму двух полуреакций, одна из которых отражает превращение окислителя, а другая восстановителя:
ок1 + n1e ® восс1 çn2 восс2 – n2е ® ок2 çn1 ¾¾¾¾¾¾¾¾¾¾¾¾ n2ок1 + n1восс2 ↔ n2восс1 + n1ок2 ок1 / восс1 ок2 / восс2 Каждая окислительно-восстановительная система количественно характеризуется величиной потенциала: (уравнение Нернста)
Еок/восс = Е0ок/восс +
Еок/восс = Е0ок/восс +
Е0 стандартный или нормальный окислительно-восстановительный потенциал, В n – число электронов, принимающих участие в процессе. Стандартным окислительно-восстановительным потенциалом называют потенциал возникающий на границе раздела благородного Ме и раствора, содержащего окисленную и восстановленную форму, и измеренный относительно стандартного водородного электрода (приводят в справочнике). Стандартный водородный электрод состоит из платиновой пластинки, выполняющей роль инертного носителя, на которую электролитически наносится слой платиновой черни (платина в мелкодисперсном состоянии). Пластинку погружают в раствор кислоты (HCl или H2SO4) с активной концентрацией Н+, равной 1,0 моль/л. Через данную систему непрерывно пропускают очищенный газообразный водород под давлением. При этом протекает реакция: Н2 (г) ↔ 2 Н+ + 2 е Е0 = 0, а уравнение Нернста Е = - 0,059 рН.
Молярная масса эквивалента в реакциях окисления – восстановления - зависит от числа принимаемых или отдаваемых электронов и рассчитывается по уравнению: М(fэкв. (Х)Х) = М(Х)/n, где М(fэкв. (Х)Х) – молярная масса эквивалента, М(Х) – молярная масса вещества, N – число электронов, участвующих в процессе. Д/з: рассчитать молярную массу эквивалента KMnO4 в кислой среде. Константы равновесия окислительно-восстановительной реакции
где E0ox, E0red – стандартные электродные потенциалы редокс пары,
n – число электронов, участвующих в процессе.
Если lg K = 1 –равновесие Если lg K > 1 – равновесие смещается в сторону продуктов реакции Если lg K < 1 – равновесие смещается в сторону исходных веществ.
Классификация методов ОВТ
Способы фиксирования точки эквивалентности в методах окислительно-восстановительного титрования
Перманганатометрия Рабочий раствор: KMnO4. Титрованный раствор перманганата калия по тонной навеске препарата приготовить нельзя, т.к. он содержит ряд примесей, концентрация раствора изменяется из-за взаимодействия с органическими примесями в дистил. воде. Также вода обладает окислительно-восстановительными свойствами и может восстанавливать KMnO4. Данная реакция идет медленно, но солнечный свет ее катализирует, поэтому приготовленный раствор хранят в темной склянке. Готовят раствор приблизительно требуемой концентрации, затем его стандартизируют по первичному стандарту (Na2C2O4 – оксалат натрия, гидрат оксалата аммония (NH4)2C2O4×H2O или дигидрат щавелевой кислоты Н2C2O4×2H2O, оксиду мышьяка As2O3 или металлическому железу).
Точку эквивалентности фиксируют по бледно-розовому окрашиванию раствора от одной избыточной капли титранта (без индикаторный метод).
В анализе некоторых органических соединений используют восстановление в сильнощелочной среде по уравнению: MnO4- + e ® MnO42- Перманганатометрически определяют восстановители методом прямого титрования, окислители – методом обратного титрования и некоторые вещества – титрованием по замещению. Дихроматометрия Рабочий раствор: K2Cr2O7. Титрованный раствор можно приготовить по тонной навеске, поскольку кристаллический K2Cr2O7 удовлетворяет всем требованиям первичного стандарта. Раствор бихромата калия устойчив при хранении, титр раствора остается неизменным длительное время Основной реакцией метода бихроматометрии является реакция окисления бихроматом калия в кислой среде:
Точку эквивалентности фиксируют, используя редокс-индикаторы (дифенил амин и его производные). Бихроматометрический метод используют для определения восстановителей – прямое титрование (Fe2+, U4+,Sb3+,Sn2+), окислителей-обратное титрование (Cr3+), а также некоторые органические соединения (метанол, глицерин).
Осадительное титрование
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.0.25 (0.026 с.) |

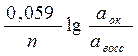
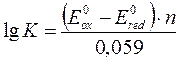
 Е0 = 1,51 В
Е0 = 1,51 В
 Е0 = 1,33 В
Е0 = 1,33 В
 Реакция перманганата калия с восстановителями в кислой среде протекает по схеме:
Реакция перманганата калия с восстановителями в кислой среде протекает по схеме: