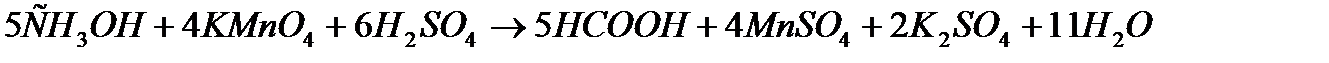Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Швидкість реакції характеризується зміною концентрації будь-якої з вихідних речовин або кінцевих продуктів реакції за одиницю часу.
Задача №1.Пояснити залежність швидкості реакції від концентрацій реагуючих речовин: Розв’язування.
Швидкість її виражається кінетичним рівнянням:
де Для гетерогенних реакцій у вираз їх швидкості концентрація твердих речовин не входить:
Задача №2. Як змінюється швидкість реакції А2 + 2В→2АВ, що відбувається безпосередньо між молекулами в закритій посудині, якщо тиск збільшиться у 6 разів? Розв’язування. Позначимо початкові концентрації молекул А2 і В через а і b відповідно:
[А2] = а, [В] = b. Швидкість реакції дорівнює:
Під час збільшення тиску у 6 разів концентрація кожної з речовин також зростає у 6 разів. У такому випадку:
Відповідь: Швидкість реакції зросте у 216 разів.
Задача №3. У скільки разів зросте швидкість реакції в результаті підвищення температури від 400 до 800 С, якщо прийняти, що температурний коефіцієнт швидкості дорівнює 2? Розв’язування.
де Підставляючи в цю формулу дані, одержимо:
Відповідь: Швидкість реакції зросте у 16 разів. ХІ. ХІМІЧНА РІВНОВАГА Необоротні реакції - ті, які відбуваються до кінця, тобто до повного перетворення всіх молекул вихідних речовин у молекули продуктів реакції. Наприклад: Оборотні реакції - ті, які при тих самих умовах одночасно відбуваються у двох взаємопротилежних напрямках. Наприклад: Реакцію, що протікає зліва направо, називають прямою, а ту, що протікає справа наліво, — зворотною. Хімічна рівновага - стан системи, за якої швидкості прямої та зворотної реакцій стають однаковими та концентрації речовин залишаються незмінними (поки зовнішні умови зберігаються сталими). Вплив зміни зовнішніх умов на стан хімічної рівноваги визначається за принципом Ле Шательє (1884 p.), або принципом рухомої (динамічної) рівноваги: якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють або знищують цю дію. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ Задача №1. Як впливатиме підвищення температури і тиску на стан рівноваги в таких реакціях:
а) Розв’язування. а) Пряма реакція супроводжується вбиранням теплоти, тому нагрівання сприяє прямій реакції і рівновага зміститься у бік продуктів. У ході прямої реакції збільшується число молекул у газовій сфері, тому тиск сприяє зворотній реакції і рівновага зміщується в бік вихідних речовин. б) У процесі нагрівання рівновага зміститься в бік продуктів. Тиск не впливає на стан рівноваги, оскільки в ході реакції число молекул у газовій сфері не змінюється. Задача № 2 За певних умов реакція гідроген хлориду з киснем є оборотною:
Як на рівноважний стан системи впливає: а) підвищення тиску; б) підвищення температури; в) введення каталізатора? Розв’язування. а) Всі речовини в системі – гази. Відповідно до принципу Ле Шательє підвищення тиску зміщує рівновагу в бік реакцій, що приводить до меншої кількості речовини газів, тобто в бік утворення СІ2 і Н2О. б) Оскільки пряма реакція екзотермічна, то підвищення температури сприятиме перебігу реакцій з поглинанням теплоти, тобто рівновага зміститься у бік ендотермічної реакції – утворення НСІ і О2. в) Каталізатор однаковою мірою прискорює пряму і зворотну реакції, тому в його присутності рівноважні кількості речовин не змінюються.
XІІ. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Окисно-відновні реакції - реакцї що відбуваються зі зміною ступенів окиснення атомів, які входять до складу реагуючих речовин.
1. Окиснення - процес віддачі електронів атомом, молекулою або іоном, що супроводжується підвищенням ступеня окиснення. 2. Відновлення - процес приєднання електронів атомом, молекулою або іоном, що супроводжується зниженням ступеня окиснення. 3. Відновник- атоми, молекули або іони, що віддають електрони, під час реакції вони окиснюються. 4. Окисник -атоми, молекули або іони, що приєднують електрони, під час реакції вони відновлюються. Ступінь окиснення. Перетворення елементів при окисно-відновних реакціях зображають у вигляді їх окиснювальних чисел (ступенів окиснення):
Задача №1. Скласти рівняння реакції відновлення Розв’язування: Записуємо схему процесу із зазначенням зміни ступенів окиснення елементів:
Складаємо електронні рівняння:
Знайдені коефіцієнти підставляємо в схему процесу, замінюючи стрілку знаком рівності:
Задача №2. Поставити коефіцієнти в окисно-відновній реакції за участю органічних сполук.
Розв’язування: Складаємо схему реакції із зазначенням ступенів окиснення атомів у молекулах відновника, окисника і продуктів їх відновлення й окиснення:
Звідси видно, що Складаємо електронні рівняння:
і підставляємо коефіцієнти у схему реакції:
Решту коефіцієнтів знаходимо добором:
Задача 3. Скласти іонне рівняння методом напівреакцій, реакції взаємодії натрій сульфіту з калій перманганатом у кислому середовищі.
РОЗЧИННІСТЬ КИСЛОТ, ОСНОВ І СОЛЕЙ У ВОДІ.
Примітка.
Практичні навички.
16. Виконання експериментальних задач, пов’язаних із підтвердженням хімічних властивостей оксидів, гідроксидів, кислот, солей.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 161; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.192.3 (0.017 с.) |
 ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ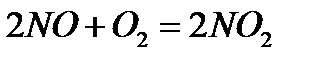 ;
; .
. ;
; ,
,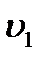 - швидкість прямої реакції.
- швидкість прямої реакції. ;
; 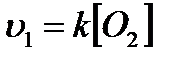 ;
; ;
; 
 .
. .
.
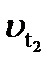 - швидкість реакції за підвищеної температури t2,
- швидкість реакції за підвищеної температури t2,  - швидкість реакції за початкової температури t1, - температурний коефіцієнт
- швидкість реакції за початкової температури t1, - температурний коефіцієнт ,
, 
 .
. .
. ; б)
; б) 
 ?
? , ∆Н= - 116,4 кДж.
, ∆Н= - 116,4 кДж. воднем.
воднем. +
+ 


 4
4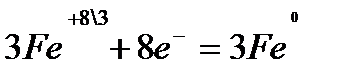 1
1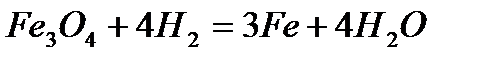

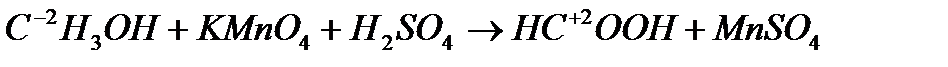
 відновник,
відновник,  окисник.
окисник. 5
5 4
4