
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Властивості сполук s-, p- і d-елементів та їх сполук.
Мета: закріпити теоретичні знання, набути практичних умінь та навичок проведення хімічного експерименту для підтвердження хімічних властивостей сполук s- і p-елементів. Література: Е.Я.Левітін, А.М.Бризицька, Р.Г.Клюєва «Загальна та неорганічна хімія», «Нова книга», 2003р. с.342-370; 370-410; 433-443; 210-227; Н.В.Романова «Загальна та неорганічна хімія», К., «Вища школа», 1998р. с.209-252; 441-451.
План: 1. Дослідження властивостей йоду. 2. Дослідження властивостей кислот (HCl, H2SO4, HNO3). 3. Окисно – відновні властивості сполук. 4. Вивчення якісних реакцій. 5. Добування амоніаку в лабораторії. 6. Гідроліз солей. 7. Добування та вивчення властивостей феруму (ІІ) і (ІІІ) гідроксидів. Знати: 1. Загальну характеристику s-, p- і d - елементів(Елементи VII-A, VI-A, V-A, VIII-В груп). 2. Загальну характеристику елементів за місцем положення в періодичній системі. 3. Поширення та способи добування простих речовин та сполук елементів. 4. Фізичні та хімічні властивості простих речовин та сполук елементів. 5. Біологічну роль та застосування. 6. Якісні реакції.
Уміти: 1. Проводити хімічні реакції, що підтверджують властивості елементів та їх сполук. 2. Виконувати якісні реакції. 3. Виконувати експериментальні завдання. 4. Складати рівняння хімічних реакцій і пояснювати їх.
Контрольні питання. 1. Дати загальну характеристику елементам VII-A, VI-A, V-A, VIII-В груп. 2. Порівняти властивості елементів VII-A, VI-A та V-A груп. 3. Скласти електронну формулу атомів N, P, Fe, O, S, Cl, Br, I, Fe ________________________________________________________________________________________________________________________________________________________________________________________________________ 4. Характеристика елементів за положенням їх у періодичній системі хімічних елементів Д.І.Менделєєва. 5. Будова молекул O2,N2, Cl2, Br2, I2, S___________________________________________________________________ ____________________________________________________________________________________________________ 6. Способи добування O2,N2, Cl2, Br2, I2 та їх сполук_______________________________________________________ ____________________________________________________________________________________________________ 7. Фізичні та хімічні властивості елементів VII-A, VI-A, V-A, VIII-В груп. 8. Фізичні та хімічні властивості кислот (хлоридної, бромідної, йодидної, сульфідної, сульфітної, сульфатної, нітратної та ортофосфатної), їх використання. 9. Фізичні та хімічні властивості солей (хлоридів, бромідів, йодидів, нітратів, фосфатів, сульфідів, сульфітів, сульфатів та тіосульфатів).
10. Оксигенвмісні сполуки елементів VII-A, VI-A, V-A, VIII-В груп. 11. Якісні реакції на:
12. Біологічна роль та використання сполук у медицині, фармації.
Висновок:
Підпис викладача:____________________
РОЗДІЛ 1. ЗАГАЛЬНА ХІМІЯ І. АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ Молекула – це найменша частинка речовини, яка може існувати самостійно і здатна зберігати її хімічні властивості. Атом – це найменша електронейтральна хімічно неподільна частинка хімічного елемента. Визначення еквівалента та еквівалентної маси: елемента у сполуці (1); основи (2); кислоти (3); солі (4).
При обчисленні еквівалента складної речовини у хімічній реакції враховують число моль-еквівалентів сполуки, яка з ним взаємодіє. Наприклад, у реакції:
у другому випадку:
еквівалент сульфатної кислоти:
тому що 1 моль кислоти взаємодіє з 2 моль еквівалентів однокислотного лугу. Задача №1. Визначити кількість речовини у 60 г Карбону. Розв’язування. Відносна атомна маса чисельно дорівнює молярній масі атома Карбону –
Кількість речовини визначають за формулою:
Відповідь: n =5моль атомів Карбону. Задача №2. Визначити масу 15 моль калій нітрату. Розв’язування. Молярна маса калій нітрату
відповідно, за формулою
маса 15 моль
Відповідь: m =1515 г Задача №3.Скільки атомів міститься у 3,2 г сірки? Розв’язування. Молярна маса сірки дорівнює 32 г/моль. Кількість атомів Сульфуру визначаємо з формули:
Відповідь: N (атомів S)= 6,02 •1022. Задача №4. Скільки молекул міститься у 6,2 г натрій оксиду? Розв’язування. Відповідь:N (молекул Nа2О)= 6,02 •1022. Задача №5.Обчислити масу однієї молекули NO. Розв’язування. Із формули:
випливає:
Відповідь: mмолекули (NO) =5•10-23 г
ІІ. БУДОВА АТОМА Атом складається з позитивно зарядженого ядра та негативно заряджених електронів, які рухаються навколо ядра. Таблиця 1 Складові частини атома
Будова електронних рівнів. Електрони, рухаючись навколо ядра, утворюють енергетичні рівні. Енергетичний рівень - простір, в якому вірогідність перебування електронів найбільша (90-95%) Стан електрона в атомі характеризується 4 - квантовими числами. IIІ. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА Періодичний закон (сучасне визначення) - властивості елементів і утворених ними простих і складних речовин перебувають у періодичній залежності від величини заряду ядер їхніх атомів. Періодична система елементів - це графічне відображення закону Д.І. Менделєєва. Таблиця 3. Складові періодичної системи та їх визначення
Вправа 1. Розташувати енергетичні підрівні у послідовності їх заповнення електронами:
3p, 3d, 4s, 4p 4d, 5s, 5p, 6s 4f, 5s, 4d, 6s, 5р 5d, 6s, 7s, 4 Відповідь: 3p, 4s, 3d, 4p 5s, 4d, 5p, 6s 5s, 4d, 5p, 6s, 4f 6s, 4f, 5d, 6p, 7s Вправа 2. Указати кількість електронних шарів в атомах елементів з атомними номерами 2,8,19,33,40,79. Відповідь: 1,2,4,4,5,6. Вправа 3. Записати електронні конфігурації атомів елементів з атомними номерами 7,16,21 і 35. Відповідь: №7 – 1s22s22p3 №16 – 1s22s22p63s23p4 №21 – 1s22s22p63s23p63d14s2 №35 – 1s22s22p63s23p63d104s24p5 Вправа 4. Указати номер періоду і номер групи (головна чи побічна підгрупа) елементів, атоми яких в основному стані мають фрагменти: …2р6 …3d54s1 …4р4 …4f56s2 Відповідь: другий період, група VІІІА (головна) – Ne четвертий період, група VIB (побічна) – Cr четвертий період, група VIА (головна) – Se шостий період, сімейство лантаноїдів – Pm Вправа 5. Назвати номер зовнішнього енергетичного рівня (зовнішнього електронного шару) в атомах Mg, Ni, Ag i Hg Відповідь: Номер зовнішнього енергетичного рівня (електронного шару) визначають за номером періоду, у якому знаходиться елемент. Mg – 3 Ni – 4 Ag – 5 Hg – 6 Вправа 6. Назвати елементи, атоми яких мають електронні конфігурації: а.... 3s23p3 б.... 3d2 4s2 в.... 3d54s2 г.... 4f145d26s2 Відповідь: а. P б. Ti в. Mn г. Hf Вправа 7. Написати електронну конфігурацію елемента, зовнішній енергетичний рівень якого має конфігурацію …4s24p4. До якого періоду і групи належить цей елемент? Які його вищий і нижчий ступені окисненя? Наведіть приклади. Відповідь: 1s22s22p63s23p63d104s24p4; 4-й період, VIA група, №34 – Se; вищий с.о. +6, SeO3; нижчий (– 2); H2Se. Вправа 8. Порівняти електронні конфігурації елементів №12 і №38. У якого з них більше виражені металеві властивості? Відповідь: №12 (Mg): 1s22s22p63s2; №38 (Sr): 1s22s22p63s23p63d104s24p65s2. В елемента №38 металічні властивості сильніше.
IV. ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ Хімічний зв'язок утворюється внаслідок взаємодії атомів (чи будь-яких інших частинок у речовині), яка зумовлює їхнє сполучення в молекули (кристали). Задача 1. Як змінюється міцність зв’язку в ряді: HF – HCI – HBr – HJ? Розв’язування: Найменша міцність зв’язку буде у HJ, а найбільша – у HF.У головній підгрупі збільшується радіус атома, відповідно збільшується L (довжина зв’язку). А чим більша довжина зв’язку, тим міцність його менша. Відповідь: Міцність зв’язку в ряді: HF – HCI – HBr – HJ послаблюється. Задача 2. Вказати сполуки з ковалентним неполярним, ковалентним полярним, йонним, металічним, водневим зв’язками:
Розв’язування:
V. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Оксиди – складні речовини, які утворені двома елементами, один із яких Оксиген.
Основи– це електроліти, які дисоціюють на катіон металу і аніон гідроксогупи:
Кислоти – електроліти, які при дисоціації утворюють іон Н+:
Солі – електроліти, що дисоціюють на катіон металу та аніон кислотного залишку.
а) б) в) г) д) 1. а) б) в) г) VІ. КОМПЛЕКСНІ СПОЛУКИ Комплексними називають складні сполуки, які містять комплексний іон, що складається з комплексоутворювача та координованих навколо нього лігандів, здатний самостійно існувати у розчині та розплаві.
Вправа 1. Назвати комплексні сполуки:
Вправа 2. Визначити: заряд комплексоутворювача, лігандів, внутрішньої та зовнішньої сфери. Назвати Калій тетраціанокадміат(ІІ): 2К+ - зовнішня координаційна сфера;
Вправа 3. Дисоціація комплексної сполуки:
Вправа 4. Скласти формули комплексної сполуки за назвою Пентаамінхлоридоплатина (ІV) хлорид: Калій тетраіодомеркуріат (ІІ): Вправа 5. Скласти формулу комплексної сполуки та назвати її
VІІ. РОЗЧИНИ Розчини – це однорідні (гомогенні) системи, які складаються з двох і більше компонентів: розчинника і розчинених в ньому речовин та продуктів їх взаємодії.
СКЛАД ДИСПЕРСНОЇ СИСТЕМИ
ТИПИ ДИСПЕРСНИХ СИСТЕМ
СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РЕЧОВИН У РОЗЧИНАХ Масова частка – відношення маси розчиненої речовини до маси розчину(%):
де w – масова частка (%); Молярна концентрація – кількість молів розчиненої речовини, що міститься в 1дм3 розчину. Визначається як відношення кількості речовини до одиниці об’єму розчину де с– молярна концентрація (моль/дм3); n- кількість речовини (моль); V – об’єм розчину (дм3); М – молярна маса (г/моль) розчиненої речовини. Моляльна концентрація – кількість молів розчиненої речовини, що міститься в 1000г розчинника. Молярна концентрація еквівалента (нормальна концентрація) – кількість молів еквівалентів розчиненої речовини, що міститься в 1дм3 розчину:
де сN – молярна концентрація еквіваленту (моль•екв/дм3); М(екв)(реч) – молярна маса еквіваленту речовин (моль/дм3). Титр – кількість грам речовини, що міститься в 1см3 розчину (г/см3).
Формули, що виражають перехід від одного способу вираження концентрації речовини у розчині до іншого:
де Длязмішування розчинів різної концентрації:
Задача 1. Визначити масу натрій хлориду, який потрібно розчинити у воді, щоб отримати 100 см3 розчину з масовою часткою Розв’язування. Маса розчину, який необхідно приготувати, складає m=ρ·V; m=1.15 г/ см3·100 см3 = 115г. масова частка
Відповідь: 23 г
Задача 2. Необхідно приготувати 200 см3 розчину з масовою часткою сульфатної кислоти 6% (густина розчину ρ=1,04 г/ см3). Який об’єм розчину з масовою часткою Розв’язування. Маса розчину, який потрібно приготувати, дорівнює m=ρ·V; m= 1,04·200=208 (г). Визначаємо масу
Визначаємо масу 60% розчину сульфатної кислоти, у якому міститься 12,5 г сульфатної кислоти:
Об’єм 60% розчину складе:
Відповідь: 13,9 см3 об’єму розчину
Задача 3. Обчислити масу глауберової солі Розв’язування. Визначаємо масу і кількість речовини m( m(
Обчислюємо масу кристалогідрату: m( m( Відповідь: m(
Задача 4. Яку кількість потрібно взяти 40%-го розчину КОН та води, щоб отримати 160 г з масовою часткою розчину 15%. Розв’язування. Скласти пропорцію за правилом хреста: Розраховуємо масу розчину (40%) КОН: mр-ну=3+5=8(м.ч.)(15%)
На 8 м.ч. розчину – 3 м.ч. КОН На 160г розчину – x x = (160·3)/8=60 г (40% КОН)
Знаходимо m(H2O) = 160-60=100 г.
Задача 5. Обчислити скільки см3 20% хлоридної кислоти потрібно взяти для виготовлення 500 см3 її 0,1М розчину. Густина кислоти 1,1 г/ см3. Розв’язування. Для виготовлення 500 см3 0,1М розчину хлоридної кислоти потрібно мати 0,05моль хлоридної кислоти. За масою це дорівнює: 36,5 г·0,05=1,83 г. 1 см3 20%-го розчину 100:20=1,1:х; х=(1,1·20):100=0,22 г кислоти у 1 см3 20% розчину. Для остаточного розв’язання складаємо пропорцію: 1 см3: 0,22 = х см3: 1,83 г; х=8,32 см3. Відповідь: 8,32 см3 розчину хлоридної кислоти.
Задача 6. Визначити молярну концентрацію еквівалента і молярність 12% розчину Розв’язування. Молярна концентрація має величину моль/дм3 і обчислюється за формулою:
Визначимо: M(
Молярна концентрація еквівалента визначається за формулою:
VIII. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електролітична дисоціація - розпад електролітів на іони під час розчинення їх у воді. Електроліти - речовини, розчини або розплави яких проводять електричний струм (кислоти, основи і майже всі солі). Розчини електролітів вони є провідники другого роду. Неелектроліти - речовини, розчини або розплави яких не проводять електричний струм (більшість органічних сполук, а також речовини, в молекулах яких є тільки ковалентні неполярні або малополярні зв'язки).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.202.45 (0.187 с.) |
 а)
_2_С2Н5ОН (1см3)
__1_ І2 (1-2 кр.)
а)
_2_С2Н5ОН (1см3)
__1_ І2 (1-2 кр.)
 ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ І ВПРАВ
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ І ВПРАВ ;
;
 .
.
 ;
;
 ;
;
 .
.
 ;
;
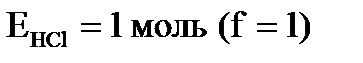 ;
;
 .
.
 ;
де 2-|с.о| - абсолютне значення ступеню окиснення елемента(Ме) у сполуці, 3- кількість моль атомів(Ме):
;
де 2-|с.о| - абсолютне значення ступеню окиснення елемента(Ме) у сполуці, 3- кількість моль атомів(Ме):
 .
.
 ;
; ,
, ,
, ,
, .
. .
.
 дорівнює:
дорівнює: ;
; ;
;
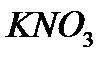 дорівнює:
дорівнює:

 .
.
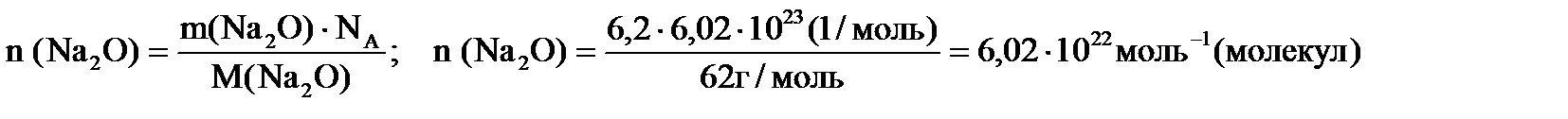 .
.
 ;
; .
.



 , де
А-атомна маса елемента
N - нейтрон
, де
А-атомна маса елемента
N - нейтрон



 ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  .
. ;
;  ;
;  - ковалентний неполярний;
- ковалентний неполярний;
 ;
;  ;
;  ;
;  – іонний;
– іонний; 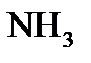 – ковалентний полярний;
– ковалентний полярний;  – металічний;.
– металічний;.







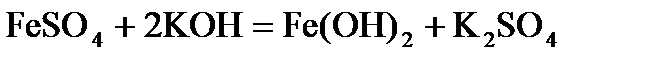



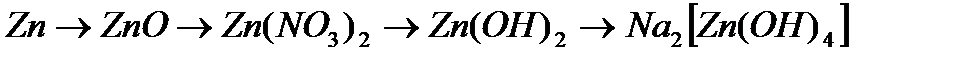

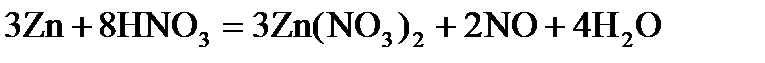



 - калій гексаціаноферат (ІІІ);
- калій гексаціаноферат (ІІІ); - натрій тетрагідроксидоалюмінат;
- натрій тетрагідроксидоалюмінат; - тетраамінкупрум (ІІ) сульфат;
- тетраамінкупрум (ІІ) сульфат;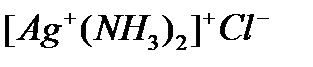 - діамінаргентум (І) хлорид;
- діамінаргентум (І) хлорид; – діаміндихлоридоплатина (ІІ);
– діаміндихлоридоплатина (ІІ); - тетраамінплатина (ІІ) тетрахлорплатинат (ІІ).
- тетраамінплатина (ІІ) тетрахлорплатинат (ІІ). .
. - внутрішня координаційна сфера;
- внутрішня координаційна сфера; - комплексоутворювач;
- комплексоутворювач; - ліганд; 4 – координаційне число.
- ліганд; 4 – координаційне число. ;
;
 ;
;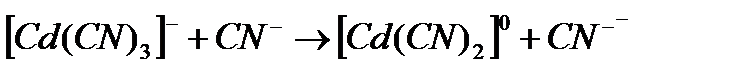 ;
; ;
; .
.

 : натрій гексафлуоридоалюмінат.
: натрій гексафлуоридоалюмінат.

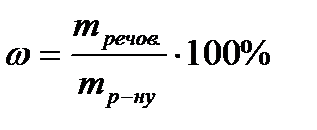 ,
, або
або 
 ,
, ,
, ;
;  .
. ;
;  ;
; ;
;  ,
, – густина розчину (г/см3).
– густина розчину (г/см3). .
. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ 20%. Густина розчину ρ=1,15 г/ см3.
20%. Густина розчину ρ=1,15 г/ см3. дорівнює
дорівнює , звідки
, звідки  ;
;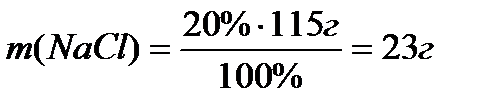
 60% (густина ρ´=1,5 г/ см3) потрібна для цього?
60% (густина ρ´=1,5 г/ см3) потрібна для цього? (безводної), необхідну для приготування 208 г 6% розчину, виходячи із поняття масової частки розчиненої речовини
(безводної), необхідну для приготування 208 г 6% розчину, виходячи із поняття масової частки розчиненої речовини  (
( ):
): тоді
тоді  ;
; .
. , звідки
, звідки  ;
; .
.  ;
; 
 60%.
60%. , яку потрібно взяти для приготування 300 г розчину з масовою часткою натрій сульфату 8%.
, яку потрібно взяти для приготування 300 г розчину з масовою часткою натрій сульфату 8%. , необхідної для приготування 300 г 8% розчину:
, необхідної для приготування 300 г 8% розчину: ) = w(
) = w(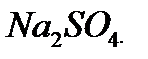 )·m;
)·m; ) =0,08·300 =24 г, а також
) =0,08·300 =24 г, а також
 ;
; 
 )= n(
)= n( )· M(
)· M( );
); )=0,169 моль·322 г/моль = 54,4 г.
)=0,169 моль·322 г/моль = 54,4 г. ) =54,4 г.
) =54,4 г.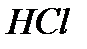 , густина якого має масу m= ρV = 1,1·1=1,1 г. Масу
, густина якого має масу m= ρV = 1,1·1=1,1 г. Масу  у 1,1 г розчину хлоридної кислоти 20% (тобто у 1 см3 20% розчину) знаходимо з пропорції:
у 1,1 г розчину хлоридної кислоти 20% (тобто у 1 см3 20% розчину) знаходимо з пропорції: , густина якого 1,122 г/см3.
, густина якого 1,122 г/см3. ,
, ) = 152 г/моль; Мекв (
) = 152 г/моль; Мекв ( ) = M:2=152:2=76г/моль.
) = M:2=152:2=76г/моль.
 ,
,



