
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация координационных соединенийСтр 1 из 4Следующая ⇒
Введение Комплексные (координационные) соединения представляют собой обширный класс химических веществ, количество которых значительно превышает число обычных, "простых" неорганических соединений. Основополагающие представления о комплексных соединениях ввел в науку швейцарский ученый Альфред Вернер(1898). В развитие химии комплексных соединений большую роль сыграли труды Л. А. Чугаева и его многочисленных учеников – И. И. Черняева, А.А. Гринберга и др. Общепризнанного определения понятия «комплексное соединение» нет. Это обусловлено разнообразием комплексных соединений и их характерных свойств. В лабораторной практике химики чаще всего имеют дело с соединениями в твердом и растворено состоянии. Для этих условий можно дать следующее определение комплексных соединений: комплексными называются соединения, в узлах кристаллов которых находятся комплексы, способные к самостоятельному существованию в растворе. Следует подчеркнуть, что такое определение, конечно, далеко не исчерпывает существа проблемы и применимо лишь в известных пределах. К очень важным комплексным соединениям относят так называемые хелаты или клешнеобразные соединения, в которых центральный атом и лиганд образуют цикл. Знание строения и свойств комплексных соединений, закономерности их образования позволяют ориентироваться в вопросах природы химической связи, теории растворов, стереохимии неорганических веществ. Практическое значение комплексных соединений трудно переоценить. Приведем лишь некоторые примеры: 1. Комплексные соединения входят в состав важнейших биологически активных и лекарственных веществ: гемоглобина (комплекс железа), хлорофилла (комплекс магния), инсулина (комплекс цинка), витамина В12 (комплекс кобальта), ряда противораковых препаратов (комплексы платины). 2. В органическом синтезе многие комплексные соединения являются катализаторами или промежуточными продуктами (соединения ртути в реакции Кучерова, комплекс титана при полимеризации олефинов, соединения меди при окислении углеводородов и т.д.). 3. В металлургии комплексные соединения используются для получения и очистки металлов. 4. Комплексные соединения широко применяются в качестве реактивов при качественном и количественном анализе.
Поэтому, темой данной курсовой является тема хелатных соединений 1. Химия комплексных соединений (Координационная теория Вернера) Координационные соединения Состав многих химических соединений объясняется с позиций теории валентности, например: Н2О, NH3, HF и т.д. Такие соединения можно назвать простыми или соединениями низшего порядка. Однако образование других соединений, а их большинство, невозможно понять исходя из представлений о валентности. Они как бы составлены из двух или нескольких простых соединений. Они называются соединениями высшего порядка или комплексными, координационными соединениями. Примеры координационных соединений: CoCl3*6NH3,AgCl*2NH3, Fe(CN)3*3KCN, PtCl4*2KCl, CoCl3*3NH3, PdCl2*2NH3. Приведенные эмпирические формулы характеризуют состав комплексных соединений, но ничего не говорят об их строении. В 1893 г швейцарский химик Альфред Вернер предложил теорию строения координационных соединений. Эта теория получила название координационной теории. Основные понятия координационной Теории 1. Центром любого координационного соединения является центральный атом или комплексообразователь. Обычно в качестве центрального атома выступает положительный ион металла, чаще всего, переходного металла. 2. Частицы, непосредственно связанные с центральным атомом, называются лигандами. Лигандами обычно являются анионы или нейтральные молекулы. 3. Центральный атом может образовывать с лигандами определенное число химических связей. Оно называется координационным числом (к.ч). Приведем наиболее часто встречающиеся значения координационных чисел, характерных для некоторых комплексообразователей: к.ч.=6 Co3+, Cr3+, Fe3+, Fe2+,Rh3+, Ir3+, Pt4+. к.ч.=4 Zn2+, Cd2+, Hg2+, Pt2+, Pd2+. к.ч.=2 Ag+, Cu+, Au+. 4. Число связей, которые данный лиганд может образовывать с центральным атомом, называется его координационной емкостью или дентатностью. Существуют лиганды монодентатные (H2O, NH3, OH-, Cl- и др.), бидентатные (NH2-C2H4-NH2, SCN, C2O4), тридентатные (NH2-C2H4-NH-C2H4- NH2) и т.д. 5. Центральный атом вместе со всеми лигандами образуют внутреннюю координационную сферу. Следует иметь в виду, что при формировании внутренней сферы координационное число центрального атома насыщается, прежде всего, за счет нейтральных лигандов, а если их не хватает, оставшиеся вакансии заполняются анионами. При составлении координационных формул частицы, входящие в состав внутренней сферы, принято заключать в квадратные скобки.
6. Заряд внутренней сферы равен алгебраической сумме степени окисления центрального атома и зарядов всех лигандов. К примеру: [Co3+(NH3)6 0]3+; [Ag+(NH3)2 0]+; [Fe3+ (CN) 6 -] 3- ; [Pt4+ Cl- 6]2- ; [Co3+ (NH3)0 6]Cl- 3]0; [Pd+ (NH3)20Cl2- ] 0 7. В тех случаях, когда заряд внутренней сферы не равен нулю, в соединении имеется внешняя координационная сфера, заряд которой нейтрализует заряд внутренней сферы. Итак, строение рассматриваемых соединений описывается следующими координационными формулами: [Co(NH3)6]Сl3; [Ag(NH3)2]Cl; K 3[Fe (CN)6 ]; K2[PtCl6]; [Co (NH3)3Сl3]; [Pd (NH3)2Cl2]. Координационная изомерия Координационными изомерами называют вещества, имеющие одинаковый состав, но различное распределение заместителей в составе комплексных ионов, входящих в молекулу соединения. Примерами координационных изомеров могут служить: [Co(NH3)6][Cr(CN)6] и [Cr (NH3)6][Co(CN)6] [Pt (NH3)4][PdCl4 ] и [Pd(NH3)4][PtCl4] [PtII(NH3)4][PtIVCl6] и [PtIV(NH3)4Cl2][PtIICl4] Следовательно, координационная изомерия проявляется у веществ, имеющих два атома комплексообразователя в молекуле. Строение координационных соединений определяется, прежде всего, способом получения. Они обычно получаются в результате реакций двойного обмена. [Pt(NH3)4] Cl2 + К2[PdCl4] = [Pt(NH3)4][PdCl4]↓ + 2KCl [Pd(NH3)4] Cl2 + К2[PtCl4] = [Pd(NH3)4][PtCl4]↓ + 2KCl Связевая изомерия Изомерия связи возникает тогда, когда монодентантные лиганды могут координироваться через два разных атома. Например, ион NO2- может присоединяться к центральному атому через азот или через кислород. Это обуславливает существование у иридия, кобальта, и некоторых других метало двух изомеров:[(NH3)5 –Ir-NO2]Cl2 и [(NH3)5-Ir-ONO]Cl2. Таким образом, этот вид изомерии возможен для координационных соединений, в состав которых входят амбидентатные лиганды. Амбидентатными называются монодентатные лиганды, содержащие два разных атома, с помощью которых может осуществляться связь с центральным атомом. Геометрическая изомерия Еще в 1893 г. при создании координационного учения А. Вернер внес пространственные представления в теорию строения комплексных ионов и установил наличие геометрической изомерии. Геометрическим изомером называют вещества, имеющие одинаковый состав, но разное расположение лигандов вокруг центрального атома. Геометрическая изомерия обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя либо рядом (цис -положение), либо напротив (транс -положение). Этот тип изомерии часто называется цис - транс -изомерией. Примером может служить дихлородиамминплатина:
(оранжевые кристаллы) (желтые, менее растворимые в воде кристаллы) Где: А- Cl- , Х- NH3. Цис - и транс - изомеры отличаются друг от друга физическими и химическими свойствами. Изучение геометрической изомерии имело большое значение для установления пространственного строения комплексных соединений. На основании того, что для некоторых комплексов МА2В2 и МА4В2 удавалось синтезировать по два изомера, Вернер приписал им квадратное и октаэдрическое строение. Подавляющее большинство комплексных МА2В2 изомеров не имеет. Для них Вернер постулировал тетраэдрическую структуру. Все предположения были в позднее подтверждены современными методами исследования строения вещества.
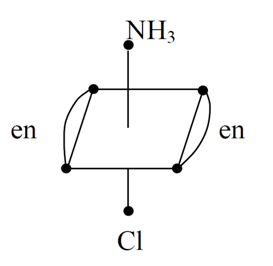
Оптическая изомерия Оптическими изомерами называют вещества с одинаковой относительной молекулярной массой, молекулы которых не имеют центра и плоскости симметрии, вследствие чего они способны вращать плоскость поляризации света. Впервые оптическая активность была открыта Араго в 1811 г на примере пластинок, вырезанных из кристаллического кварца. Впоследствии оно изучалось Л. Пастером на органических соединениях. Им же были предложены некоторые методы оптического активирования комплексных соединений, т. е. расщепления соединений на оптически антиподы, относящиеся друг к другу как предмет к своему зеркальному изображению. Одним из предложенных методов разделения веществ на оптические антиподы было их взаимодействие с другими оптическими деятельными веществами, например с кислотами. А. Вернер в 1911г. Впервые разделил цис-изомер вещества состава [CoЕn2NH3Cl]Cl2 на оптические антиподы, что было прекрасным подтверждением координационной теории. Строение обоих антиподов изображалось формулами:
У транс -изомера имеется центр и плоскость симметрии, и поэтому оно не имеет оптических антиподов:.
3. Химическая связь в комплексных соединениях. Теория поля лигандов Разработана в 30-40-х годах 20-го века, объединила в себе основные положения теории кристаллического поля и метода молекулярных орбиталей. Прежде всего, полезно вспомнить основные положения метода молекулярных орбиталей. 1. Молекула рассматривается как единая система ядер и электронов, а не как совокупность атомов, сохраняющих индивидуальность. 2. Подобно тому, как электроны в атомах располагаются на атомных орбиталях (АО), электроны в молекуле располагаются на молекулярных орбиталях (МО). 3. Молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей. 4. В образовании молекулярных орбиталей участвуют только те АО, которые имеют близкую по величине энергию и приблизительно одинаковую симметрию относительно оси связи. 5. При взаимодействии двух АО в результате их линейной комбинации образуются две МО с большей и меньшей энергией по сравнению с энергией исходных АО. В результате сложения АО образуется МО с повышенной межъядерной электронной плотностью, т.е. с меньшей энергией. Такую орбиталь называют связывающей. В результате вычитания АО образуется МО с большей энергией, называемая разрыхляющей.
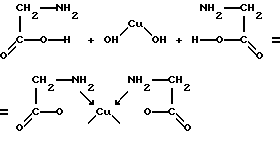
6. В соответствии с принципом Паули на молекулярной орбитали, как и на атомной, не может быть больше двух электронов. 7. Все имеющиеся в молекуле электроны распределяются по МО в порядке увеличения энергии, в соответствии с принципом Паули и правилом Хунда. 8. Переход электрона с АО на связывающую МО увеличивает энергию связи, а переход на разрыхляющую МО уменьшает прочность связи. 9. Стабильность молекулы определяется разностью между числом связывающих и разрыхляющих электронов. Если эта разность равна нулю, молекула не образуется. Хелаты. Хелатный эффект К очень важным циклическим соединениям относят так называемые хелаты или клешнеобразные соединения, в которых центральный атом и полидентантный лиганд образуют цикл. Например, при взаимодействии гидроксида меди с аминоуксусной кислотой образуется нейтральный комплекс:
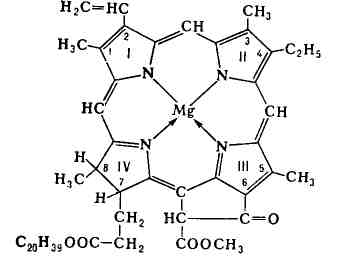
Каждая молекула аминоуксусной кислоты использует обе функциональные группы. В одном случае она соединяется с центральным атомом через две аминогруппы по донорно-акцепторному механизму, а во втором – через кислород карбоксильной группы обычной ковалентной связью. Комплексообразователь при этом оказывается как бы втянутым внутрь лиганда, охвачен связями наподобие клешни рака. Отсюда и происходит название хелат. Примерами других хелатов могут служить комплексы с этилендиамином NH2-C2H4-NH2, этилендиаминтетрауксусной кислотой (ЭДТА), щавелевой кислотой. К хелатам также относятся такие важные для жизни соединения, как хлорофилл и гемоглобин:
Комплексообразователем в хлорофилле выступает магний, а в гемоглобине – железо. В одной плоскости с металлом располагаются четыре атома азота органического лиганда. По другую сторону от плоскости железо присоединяем молекулу белка(глобина), а по другую молекулу кислорода. Такой продукт называется оксигемоглобином. Он образуется в легких, где гемоглобин присоединяет кислород воздуха и далее в виде оксигемоглобани разносится по всему организму. Хлорофилл играет важнейшую роль в процессах фотосинтеза, протекающих во всех зеленых растениях. Наличие в хелатах циклических группировок сильно увеличивает их устойчивость по сравнению с соединениями подобного состава, но не имеющими циклов. Такое повышение устойчивости называют хелатным эффектом. Этот термин был введен Г.Шварценбахом в 1952 году для пояснения экспериментально обнаруженного факта существенно более высокой устойчивости комплексов ионов металлов с полидентатными реагентами по сравнению с комплексами этих же металлов с монодентатными лигандами. Хелатный эффект (ХЭ) количественно выражается следующим соотношением: ХЭ = lg βMZ - lgβMAm, где Z – m-дентатный лиганд, а lgβMAm = lgKMA1 + lgKMA2 + … +lgKMAn
Хелатный эффект – это разность между логарифмами константы устойчивости хелатного комплекса и общей константой устойчивости комплекса, образованного этим же ионом металла с соответствующим монофункциональным лигандом. Г.Шварценбах предложил так называемое энтропийное толкование хелатного эффекта. Из общих физико-химических соображений ΔGo = -RTlnK =ΔHo – TΔSo. Шварценбах считал, что высокая устойчивость хелатов с полидентатными лигандами связана с увеличением энтропийного вклада в свободную энергию образования комплекса. Для комплексов с монодентатными лигандами реакцию образования можно записать следующим образом: M(H2O)6 + 6 NH3 = M(NH3)6 + 6 H2O, тогда как для полидентатных лигандов процесс пойдет несколько иначе: M(H2O)6 + Y = MY + 6 H2O. В соответствии с этими уравнениями при комплексообразовании с монодентатными лигандами общее число свободно колеблющихся частиц в растворе не изменяется, а в случае полидентатных – увеличивается, что приводит к увеличению энтропии системы. Практическая часть. Синтез №1 — получение хлорида триэтилендиаминкобальтата(III) [CoЕn3]Cl3 Оборудование: весы, плоскодонная коническая колба, стакан, мерный цилиндр, магнитная мешалка, фарфоровая чашка, водяная баня, воронка Бюхнера, колба Бунзена. Методика синтеза: В плоскодонную коническую колбу ёмкостью 100 мл поместить 5 г CoCl2*6H2O и растворить соль в 10 мл воды. Добавить 16 мл 30%-го раствора этилендиамина(C2H4(NH2)2), частично нейтралезованного 4 мл 20% НCl(нейтрализацию проводить под тягой). Затем добавляем 30 мл 3%-го наствора Н2О2. Реакционную смесь перемешивать на магнитной мешалке 40 мин. Полученный раствор бурого цвета переливаем в фарфоровую чашку емкостью 100 мл и упариваем на водяной бане до объема 30 мл. горячий раствор перелить в стакан и охлодить до комнатной температуры, добавить 8 мл концентрированной HCl b 20мл этилового спитра. Смесь выдержать при 0̊ в течении 15 мин. Выпавшие кристаллы оранжевого цвета отфильтовать на воронке Бюхнера, промыть 10 мл смеси вода–этиловый спирт(1:1), а затем 5 мл этилового спирта и 5 мл эфира. Полученное вещество вусышить и перенести ы бюкс. Уравнение реакции синтеза: 2CoCl2 +6En+ 2HCl=2[Co(En)3]Cl3+2H2O Расчеты:
Цвет полученного соединения: оранжевый Результаты исследования спектра поглащения раствора:
Наблюдения: Имеющийся в лаборатории этилендиамин имел жёлтоватый цвет, сильно дымящийся, условная концентрация жидкого этилендиамина составляла 70%. Имеющаяся в лаборатории перекись водорода была концентрированной, для приготовления раствора нужной концентрации разбавил перекис в 10 раз. С полученным соединением оранжевого цвета проведены следующие опыты и реакции: 1) В результате проведенной реакции выпадает белый осадок 2) В результате проведенной реакции выпадает бурый осадок 3) В результате проведенной реакции выпадает чёрный осадок 4)
В результате проведенной реакции раствор окрашивается в розовый цвет, но для того, чтобы образовался аммиачный комплекс необходимо к раствору
Синтез №2— получение диметилглиоксимата никеля(II) [Ni(N2(OH)2C2(CH3)2)2] Оборудование: весы, стакан мерный цилиндр, воронка Бюхнера. Методика синтеза: 1 г хлорида никеля растворяем в 25 мл воды. Затем добавляем спиртовой раствор аммиака до слабого запаха. Затем к раствору добавляем спиртовой раствор диметилглиоксима до образования рыхлого осадка диметилглиоксимата алого цвета. Осадок отфильтровываем и промываем 2-3 раза водой и высушиваем на воздухе. Уравнение реакции синтеза: NiCl2+2H2dmg+2NH3= [Ni(Hdmg)2]+NH4Cl Расчеты:
Цвет полученного соединения: алый. Получившееся вещество (
В результате проведенной реакции выпадает чёрный осадок Синтез №3— получение тригидрата триоксалатоферрата(III) калия К3[Fе(С2O4)3]* ЗН2O Оборудование: Весы, стакан, магнитная мешалка, водяная баня, баня со льдом, воронка Бюхнера. Методика синтеза: В стакан ёмкостью 25мл. поместить 3 г твёрдого хлорида железа(III). Смесь перемешивать на магнитной мешалке до растворения соли. В другой стакан ёмкостью 50 мл внести 9.13г оксалата калия, добавить 25 мл воды и нагреть содержимое стакана на водяной бане до растворения соли(не доводя до кипения). Все дальнейшие операции проводить в условиях защиты от освещения. К полученному теплому раствору оксалата калия при перемешивании прилить раствор хлорида железа(III) и охладить в бане со льдом. Наблюдается образование светло-зеленых кристаллов оксалатного комплекса железа(III). Раствор с осадком оставить на 1 час в бане со льдом для более полной кристаллизации. Затем осадок отфильтровать на воронке Бюхнера, промыть на фильтре 10 мл этанола, высушить током воздуха перенести в бюкс и взвесить. Уравнение реакции синтеза: 3K2C2O4+FeCl3=K3[Fe(C2O4)3]+3KCl Расчеты:
Цвет полученного соединения: зеленый Результат исследования спектра поглощения раствора:
Качественные реакции, доказывающие состав полученных в результате синтеза веществ: 4 В результате проведенной реакции, выпадает ярко-синий осадок берлинской лазури
В результате реакции, раствор не окрашивается в кроваво-красный, т. к. не образуется Fe(SCN)3, следовательно, ион Fе3+ находится во внутренней сфере.
В результате проведения реакции, выпадает желтый осадок
В результате проведения реакции, выпадает черный осадок
Заключение:
Список используемой литературы: 1) Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов. — М.: Высш. школа, 1981.—679с., ил. 2) Угай Я.А. Общая и неорганическая химия: Учебник для вузов. — М.: Высш. школа,2002.— 527с., ил. 3) Практикум по неорганической химии. НГУ – 1987г. Выпуск I 4) Практикум по неорганической химии. НГУ – 1987г. Выпуск II 5) Гликина Ф.Б., Ключников Н.Г. Химия комплексных соединений. – 3-е изд.—М.: Просвещение, 1982.—160с. 6) Глинка Н.Л. Общая химия. Учебник для студ. Высш. учеб.—М.: Интеграл Введение Комплексные (координационные) соединения представляют собой обширный класс химических веществ, количество которых значительно превышает число обычных, "простых" неорганических соединений. Основополагающие представления о комплексных соединениях ввел в науку швейцарский ученый Альфред Вернер(1898). В развитие химии комплексных соединений большую роль сыграли труды Л. А. Чугаева и его многочисленных учеников – И. И. Черняева, А.А. Гринберга и др. Общепризнанного определения понятия «комплексное соединение» нет. Это обусловлено разнообразием комплексных соединений и их характерных свойств. В лабораторной практике химики чаще всего имеют дело с соединениями в твердом и растворено состоянии. Для этих условий можно дать следующее определение комплексных соединений: комплексными называются соединения, в узлах кристаллов которых находятся комплексы, способные к самостоятельному существованию в растворе. Следует подчеркнуть, что такое определение, конечно, далеко не исчерпывает существа проблемы и применимо лишь в известных пределах. К очень важным комплексным соединениям относят так называемые хелаты или клешнеобразные соединения, в которых центральный атом и лиганд образуют цикл. Знание строения и свойств комплексных соединений, закономерности их образования позволяют ориентироваться в вопросах природы химической связи, теории растворов, стереохимии неорганических веществ. Практическое значение комплексных соединений трудно переоценить. Приведем лишь некоторые примеры: 1. Комплексные соединения входят в состав важнейших биологически активных и лекарственных веществ: гемоглобина (комплекс железа), хлорофилла (комплекс магния), инсулина (комплекс цинка), витамина В12 (комплекс кобальта), ряда противораковых препаратов (комплексы платины). 2. В органическом синтезе многие комплексные соединения являются катализаторами или промежуточными продуктами (соединения ртути в реакции Кучерова, комплекс титана при полимеризации олефинов, соединения меди при окислении углеводородов и т.д.). 3. В металлургии комплексные соединения используются для получения и очистки металлов. 4. Комплексные соединения широко применяются в качестве реактивов при качественном и количественном анализе. Поэтому, темой данной курсовой является тема хелатных соединений 1. Химия комплексных соединений (Координационная теория Вернера) Координационные соединения Состав многих химических соединений объясняется с позиций теории валентности, например: Н2О, NH3, HF и т.д. Такие соединения можно назвать простыми или соединениями низшего порядка. Однако образование других соединений, а их большинство, невозможно понять исходя из представлений о валентности. Они как бы составлены из двух или нескольких простых соединений. Они называются соединениями высшего порядка или комплексными, координационными соединениями. Примеры координационных соединений: CoCl3*6NH3,AgCl*2NH3, Fe(CN)3*3KCN, PtCl4*2KCl, CoCl3*3NH3, PdCl2*2NH3. Приведенные эмпирические формулы характеризуют состав комплексных соединений, но ничего не говорят об их строении. В 1893 г швейцарский химик Альфред Вернер предложил теорию строения координационных соединений. Эта теория получила название координационной теории. Основные понятия координационной Теории 1. Центром любого координационного соединения является центральный атом или комплексообразователь. Обычно в качестве центрального атома выступает положительный ион металла, чаще всего, переходного металла. 2. Частицы, непосредственно связанные с центральным атомом, называются лигандами. Лигандами обычно являются анионы или нейтральные молекулы. 3. Центральный атом может образовывать с лигандами определенное число химических связей. Оно называется координационным числом (к.ч). Приведем наиболее часто встречающиеся значения координационных чисел, характерных для некоторых комплексообразователей: к.ч.=6 Co3+, Cr3+, Fe3+, Fe2+,Rh3+, Ir3+, Pt4+. к.ч.=4 Zn2+, Cd2+, Hg2+, Pt2+, Pd2+. к.ч.=2 Ag+, Cu+, Au+. 4. Число связей, которые данный лиганд может образовывать с центральным атомом, называется его координационной емкостью или дентатностью. Существуют лиганды монодентатные (H2O, NH3, OH-, Cl- и др.), бидентатные (NH2-C2H4-NH2, SCN, C2O4), тридентатные (NH2-C2H4-NH-C2H4- NH2) и т.д. 5. Центральный атом вместе со всеми лигандами образуют внутреннюю координационную сферу. Следует иметь в виду, что при формировании внутренней сферы координационное число центрального атома насыщается, прежде всего, за счет нейтральных лигандов, а если их не хватает, оставшиеся вакансии заполняются анионами. При составлении координационных формул частицы, входящие в состав внутренней сферы, принято заключать в квадратные скобки. 6. Заряд внутренней сферы равен алгебраической сумме степени окисления центрального атома и зарядов всех лигандов. К примеру: [Co3+(NH3)6 0]3+; [Ag+(NH3)2 0]+; [Fe3+ (CN) 6 -] 3- ; [Pt4+ Cl- 6]2- ; [Co3+ (NH3)0 6]Cl- 3]0; [Pd+ (NH3)20Cl2- ] 0 7. В тех случаях, когда заряд внутренней сферы не равен нулю, в соединении имеется внешняя координационная сфера, заряд которой нейтрализует заряд внутренней сферы. Итак, строение рассматриваемых соединений описывается следующими координационными формулами: [Co(NH3)6]Сl3; [Ag(NH3)2]Cl; K 3[Fe (CN)6 ]; K2[PtCl6]; [Co (NH3)3Сl3]; [Pd (NH3)2Cl2]. Классификация координационных соединений Многочисленные комплексные соединения могут быть классифицированы по разным признакам.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 639; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.218.230 (0.131 с.) |


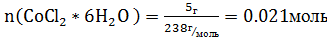


 практическая
практическая 


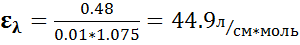

 , нами показано наличие ионов
, нами показано наличие ионов  во внешней сфере.
во внешней сфере.
 , нами показано наличие ионов Co3+ в растворе.
, нами показано наличие ионов Co3+ в растворе.
 нами показано наличие ионов Co3+ в растворе.
нами показано наличие ионов Co3+ в растворе.
 добавить большое количество аммиака, что говорит об устойчивости полученного комплекса.
добавить большое количество аммиака, что говорит об устойчивости полученного комплекса.
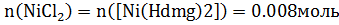
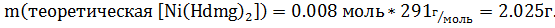
 .
.
 само по себе доказывает, что в его состав входит ионы Ni2+. В ходе проведения качественных реакций экспериментально обнаруживаем высокую устойчивость соединения,
само по себе доказывает, что в его состав входит ионы Ni2+. В ходе проведения качественных реакций экспериментально обнаруживаем высокую устойчивость соединения,  не прореагировал с высоко концентрированным NaOH. Лишь при растворении в тетрахлорметане (CCl4) прореагировал с Na2S:
не прореагировал с высоко концентрированным NaOH. Лишь при растворении в тетрахлорметане (CCl4) прореагировал с Na2S:
 , нами показано наличие ионов Ni2+ в растворе. В связи с тем, что
, нами показано наличие ионов Ni2+ в растворе. В связи с тем, что 

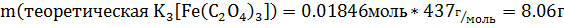
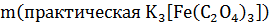 =4.68г
=4.68г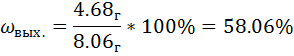

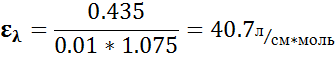

 , нами показано наличие ионов Fe3+ в растворе.
, нами показано наличие ионов Fe3+ в растворе.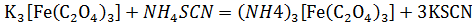

 следовательно, ионы K+ находятся во внешней сфере.
следовательно, ионы K+ находятся во внешней сфере.

 следовательно, в растворе находятся ионы Fe3+ .
следовательно, в растворе находятся ионы Fe3+ .


