Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические свойства белков и их классификация. Потребность в белках. Азотистый баланс. Белковая недостаточность. Квашиокор.Стр 1 из 9Следующая ⇒
Уровни организации белковых молекул. Первичная, вторичная, третичная и четвертичная структуры белка и их краткая характеристика. Аминокислотный состав белков, пептидная связь и ее физико-химическая характеристика. Первичная структура является полипептидная цепь - нить аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными > прочными. Вторичная структура - белковая нить закручена в виде спирали. Между группами -СООН и -NH2 образуются водородные связи. Далее нить аминокислот (полипептид) свертывается, образуя глобулу, для каждого белка специфичную. Таким образом, возникает третичная структура. Связи, поддерживающие третичную структуру белка слабые (гидрофобные взаимодействия, ковалентные дисульфидные -S-S-связи). Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными. Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков. Белки бывают: полноценными — содержат весь набор аминокислот и неполноценными; состоят только из аминокислот - простые и сложные. Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом). 2. Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков - гемоглобина и миоглобина. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Лабильность пространственной структуры белков. Факторы, вызывающие денатурацию белков. Белки теплового шока и шапероны. Представление о прионах. Болезни, связанные с нарушением правильного сворачивания белков. Лабильность - свойство белков незначительно изменять информацию посредством разрыва одних и образования других слабых связей без потери биологической активности. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои нативные, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы (повышение температуры, давления, механическое воздействие), химические факторы (кислоты, щелочи, органические растворители). В организме есть белки предотвращающие денатурацию - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки другие белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса. Прионы - особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека. Болезни: амиотрофический латеральный склероз, болзень Паркисона, фронто-темпоральная деменция, болезнь Альцгйемера, болезнь Хантингтона.
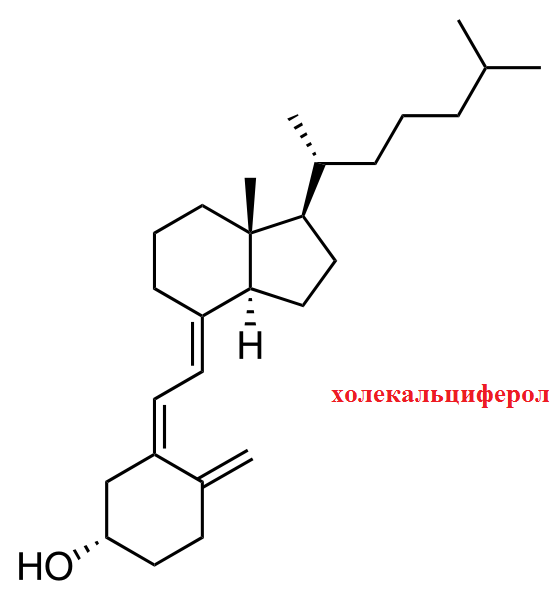
5. Основные свойства белковых фракций крови и значение их определения для диагностики. Методы исследования. Эмбриоспецифические белки и их значение. Энзимодиагностика. Белки плазмы крови: образуют буферную систему крови и поддерживают рН крови в пределах 7,37-7,43, поддерживают осмотическое давление, удерживая воду в сосудистом русле, транспортируют метаболиты, витамины, ионы металлов, лекарства, определяют вязкость крови, являются резервом аминокислот для организма, выполняют защитную роль. Эмбриоспецифические белки - их синтез репрессирован в организме взрослого человека. Результаты поиска эмбриоспецифических белков в сыворотке крови больных с различной патологией позволили предложить иммунохимический тест на первичный рак печени. Энзимодиагностика - методы диагностики болезней, патологических состояний и процессов, основанные на определении активности энзимов (ферментов) в биологических жидкостях. Витамины группы D, их строение и физиологическая роль. Образование 1,25- дигидроксихолекальциферола и его роль в регуляции обмена кальция и фосфора. Витамин D — группа биологически активных веществ, в том числе холекальциферол и эргокальциферол.
Витамин D обеспечивает всасывание фосфатов в кишечнике, уменьшает экскрецию кальция и фосфатов в почке, в небольшом количестве обеспечивает кальцификацию костей. 1,25-дигидроксихолекальциферол оказывает на кишечник, почки и кости несколько влияний, которые повышают всасывание кальция и фосфатов в экстрацеллюлярное пространство и обеспечивают регуляцию этих веществ по принципу отрицательной обратной связи. Регуляция действия ферментов, аллостерические механизмы, фосфорилирование - дефосфорилирование. Примеры метаболических путей, регулируемых этими механизмами. Классификация ферментов, ее принципы. Характеристика оксидоредуктаз. В живой клетке скорость ферментативных реакций находится под строгим контролем, что позволяет каждой метаболической цепочке реакций постоянно изменяться, приспосабливаясь к меняющимся потребностям клетки в продукте. В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом. Существует несколько способов регуляции действия ферментов: изменение активности фермента при его постоянной концентрации; изменение концентрации фермента, обычно в результате ускорения (индукции) или торможения (репрессии) синтеза фермента. Аллостерическим механизмом регуляции активности ферментов называют регуляторный механизм, в котором контроль активности фермента реализуется путем изменения конформации белковой молекулы, индуцируемого связыванием метаболита-регулятора в особом (аллостерическом) центре, пространственно удаленном от активного центра. Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента- донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование - отщепление остатка фосфорной кислоты от молекулы фосфорсодержащего соединения. КФ 1: Оксидоредуктазы, КФ 2: Трансферазы, КФ 3: Гидролазы, КФ 4: Лиазы, КФ 5: Изомеразы, КФ 6: Лигазы. Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
Представление о процессах окислительного фосфорилирования. Переносчики электронов в дыхательной цепи. Сопряжение переноса электронов с переносом протонов. НАДН-дегидрогеназа как компонент дыхательной цепи. Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий. Переносчики расположены по своему окислительно-восстановительному потенциалу, транспорт электрона на всём протяжении цепи протекает самопроизвольно. Все компоненты дыхательной цепи могут существовать как в восстановленной, так и в окисленной форме. От дегидрогеназ, которые восстанавливают НАД+ до НАДН, цепь начинается дегидрогеназой. При окислении субстратов происходит значительное уменьшение свободной энергии, сопровождающее перенос пары электронов от НАДН к молекулярному кислороду. Окислительное фосфорилирование, коэффициент Р/О. Строение митохондрий и структурная организация дыхательной цепи. Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании. Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий. Коэффициент Р/О – это отношение количества неорганического фосфата, включенного в молекулу АТФ АТФ-синтазой к количеству атомов кислорода, включенного в молекулу Н2О, при переносе одной пары электронов по дыхательной цепи. Наружная мембрана, межмембранное пространство, внутренняя мембрана, матрикс. Цитохром c — один из компонентов дыхательной цепи митохондрий. 61. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал). Повреждение мембран в результате перекисного окисления липидов. Защита от токсического действия кислорода: неферментативные и ферментативные антиоксиданты.
Главным источником АФК в клетках являются митохондрии. Три категории АФК: первичные, вторичные и третичные. Первичные АФК образуются при окислении некоторых молекул и обладают регуляторным или умеренным антимикробным действием. К ним относятся оксид азота NO, обладающий сосудорасширяющим действием, и супероксид ОО-. Обычно при помощи специализированного фермента супероксиддисмутазы он превращается в перекись водорода Н2О2 и в дальнейшем – в гипохлорит ClO-. Оба эти соединения используются макрофагами для борьбы с бактериями. При недостаточной нейтрализации супероксида его избыток, взаимодействуя с NO, образует пероксинитрит или переводит трехвалентное железо Fe3+ в двухвалентное Fe2+, которое при взаимодействии с Н2О2, НClО и липоперекисями образует гидроксильный радикал ОН* или липоксильный радикал LO. Эти радикалы, как и пероксинитрит, представляют категорию вторичных радикалов, именно эта категория обладает сильным токсическим действием вследствие своей способности необратимо повреждать мембранные липиды, а также молекулы ДНК, углеводов и белков. При соединении вторичных радикалов с молекулами антиоксидантов и других легко окисляющихся соединений образуются третичные радикалы. Их роль может быть различной. Различают ферментативные и неферментативные звенья антиоксидантной системы. Ферментативное звено антиоксидантной системы представлено глутатионпероксидазой, супероксиддисмутазой и каталазой. Они имеют определенную специализацию как по отношению к конкретным видам радикалов и перекисей, так и по локусам возникновения активных форм кислорода. Неферментативное звено антиоксидантной системы состоит из соединений низкомолекулярной и белковой природы 62. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал). Главным источником АФК в клетках являются митохондрии. Три категории АФК: первичные, вторичные и третичные. Первичные АФК образуются при окислении некоторых молекул и обладают регуляторным или умеренным антимикробным действием. К ним относятся оксид азота NO, обладающий сосудорасширяющим действием, и супероксид ОО-. Обычно при помощи специализированного фермента супероксиддисмутазы он превращается в перекись водорода Н2О2 и в дальнейшем – в гипохлорит ClO-. Оба эти соединения используются макрофагами для борьбы с бактериями. При недостаточной нейтрализации супероксида его избыток, взаимодействуя с NO, образует пероксинитрит или переводит трехвалентное железо Fe3+ в двухвалентное Fe2+, которое при взаимодействии с Н2О2, НClО и липоперекисями образует гидроксильный радикал ОН* или липоксильный радикал LO. Эти радикалы, как и пероксинитрит, представляют категорию вторичных радикалов, именно эта категория обладает сильным токсическим действием вследствие своей способности необратимо повреждать мембранные липиды, а также молекулы ДНК, углеводов и белков. При соединении вторичных радикалов с молекулами антиоксидантов и других легко окисляющихся соединений образуются третичные радикалы. Их роль может быть различной. Различают ферментативные и неферментативные звенья антиоксидантной системы.
Инсулин, его строение и биологическое значение. Роль инсулина и глюкагона в регуляции углеводного обмена. Фосфорилирование и дефосфорилирование как один из возможных путей регуляции активности ферментов, участвующих в обмене углеводов. Инсулин - гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Воздействие инсулина на обмен углеводов заключается в том, что он участвует в образовании из глюкозы сложного полисахарида гликогена, который синтезируется и накапливается в печени. Этот гликоген является резервным источником энергии и фактическим резервом глюкозы в организме. Инсулин влияет также и на другие виды обмена: он стимулирует образование жиров, усиливает поглощение аминокислот тканями. Установлено, что инсулин совместно с гормоном роста обеспечивает развитие организма, увеличение его массы и размеров. Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента- донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование - отщепление остатка фосфорной кислоты от молекулы фосфорсодержащего соединения. Классификация липидов и их биологическая роль в жизнедеятельности клетки. Метаболизм липопротеинов, транспорт липидов между органами и тканями. Представление о нарушениях обмена липидов при сердечно-сосудистых заболеваниях. Простые липиды: жирные кислоты, жирные альдегиды, жирные спирты, предельные углеводороды с длинной алифатической цепочкой, сфингозиновые основания, воски; Сложные липиды: полярные, фосфолипиды, гликолипиды, фосфогликолипиды, сфинголипиды, мышьяколипиды, нейтральные, Ацилглицериды Триглицериды (Жиры) Диглицерид Моноглицериды Церамиды Эфиры стеринов N-ацетилэтаноламиды Оксилипиды: Оксилипиды липоксигеназного пути Оксилипиды циклооксигеназного пути. Липиды выполняют самые разнообразные функции: снабжают энергией клеточные процессы, формируют клеточные мембраны, участвуют в межклеточной и внутриклеточной сигнализации. Метаболизм липопротеинов - это динамический процесс, включающий в себя как разнообразные перемещения липидов и апопротеинов между от- дельными классами липопротеинов, так и целый ряд реакций, катализируе-мых ферментами. Целый ряд заболеваний обусловлен нарушением липидного обмена. Важнейшими среди них следует назвать атеросклероз и ожирение. Уровни организации белковых молекул. Первичная, вторичная, третичная и четвертичная структуры белка и их краткая характеристика. Аминокислотный состав белков, пептидная связь и ее физико-химическая характеристика. Первичная структура является полипептидная цепь - нить аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными > прочными. Вторичная структура - белковая нить закручена в виде спирали. Между группами -СООН и -NH2 образуются водородные связи. Далее нить аминокислот (полипептид) свертывается, образуя глобулу, для каждого белка специфичную. Таким образом, возникает третичная структура. Связи, поддерживающие третичную структуру белка слабые (гидрофобные взаимодействия, ковалентные дисульфидные -S-S-связи). Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Если пептидные цепи уложены в виде клубка, то такие белки называются глобулярными. Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков. Белки бывают: полноценными — содержат весь набор аминокислот и неполноценными; состоят только из аминокислот - простые и сложные. Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом). 2. Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков - гемоглобина и миоглобина. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина. Физико-химические свойства белков и их классификация. Потребность в белках. Азотистый баланс. Белковая недостаточность. Квашиокор. ФХ свойства. 1) Амфотерность связана с наличием в молекуле белка катионообразующих групп – аминогрупп и анионообразующих – карбоксильных группу. 2) Растворы белков обладают буферными свойствами за счет их амфотерности. 3) Растворимость. Поскольку молекула белка содержит полярные амино – и карбоксильные группы, то в растворе поверхностные остатки АК гидратируются – происходит образование коацервата. 4) Коацервация - слияние водных оболочек нескольких частиц, без объединения самих частиц. 5) Коагуляция – склеивание белковых частиц и выпадение их в осадок. 6) Денатурация - существенное изменение вторичной и третичной структуры белка, т. е. нарушение системы нековалентных взаимодействий, не затрагивающее его ковалентной (первичной) структуры. По растворимости: водорастворимые, солерстворимые, спирторастворимые, нерастворимые. По конформационной структуре: фибриллярные, глобулярные. По химическому строению: протеины (альбумины, глобулины, гистоны, склеропротеины) – состоят только из аминокислот, протеиды (нуклео, гемпро, липопро, фосфопро, глюкопротеиды) – помимо АК имеют в составе небелковую часть (углеводы, липиды, металлы, нуклеиновые кислоты). Обмен веществ, сокращения мышц, раздражительность нервов, способность к росту и размножению и даже высшая форма движения материи – мышление. Связывая значительные количества воды, белки образуют плотные коллоидные структуры, определяющие конфигурацию тела. Разность между количеством азота, который попадает в организм с пищей, и количеством азота, выводимого из организма с мочой, калом, потом. Белковая недостаточность может быть следствием количественного или качественного дисбаланса питания, также врожденные нарушения обмена аминокислот. Квашиоркор — вид тяжёлой дистрофии на фоне недостатка белков в пищевом рационе. Лабильность пространственной структуры белков. Факторы, вызывающие денатурацию белков. Белки теплового шока и шапероны. Представление о прионах. Болезни, связанные с нарушением правильного сворачивания белков. Лабильность - свойство белков незначительно изменять информацию посредством разрыва одних и образования других слабых связей без потери биологической активности. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои нативные, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы (повышение температуры, давления, механическое воздействие), химические факторы (кислоты, щелочи, органические растворители). В организме есть белки предотвращающие денатурацию - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки другие белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса. Прионы - особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека. Болезни: амиотрофический латеральный склероз, болзень Паркисона, фронто-темпоральная деменция, болезнь Альцгйемера, болезнь Хантингтона. 5. Основные свойства белковых фракций крови и значение их определения для диагностики. Методы исследования. Эмбриоспецифические белки и их значение. Энзимодиагностика. Белки плазмы крови: образуют буферную систему крови и поддерживают рН крови в пределах 7,37-7,43, поддерживают осмотическое давление, удерживая воду в сосудистом русле, транспортируют метаболиты, витамины, ионы металлов, лекарства, определяют вязкость крови, являются резервом аминокислот для организма, выполняют защитную роль. Эмбриоспецифические белки - их синтез репрессирован в организме взрослого человека. Результаты поиска эмбриоспецифических белков в сыворотке крови больных с различной патологией позволили предложить иммунохимический тест на первичный рак печени. Энзимодиагностика - методы диагностики болезней, патологических состояний и процессов, основанные на определении активности энзимов (ферментов) в биологических жидкостях.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 362; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.183.187 (0.018 с.) |