
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение количества ферментов
Ферменты комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы являются адаптивными ферментами, количество их возрастает при усиленном питании и уменьшается при голодании и потреблении жира. Индуктором биосинтеза этих ферментов является инсулин. Ковалентная модификация Благодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования. Инсулин активирует протеинфосфатазу и способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза. Глюкагон, адреналин или другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибирование ацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу. При уменьшении количества инсулина и возрастании глюкагона усиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров. Метаболическая регуляция В регуляции синтеза и окисления жирных кислот играют роль три участка: 1. Активность ацетил-SКоА-карбоксилазы регулируется: · цитратом – аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии, · ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот. 2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот. 3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление. Таким образом, когда в клетке имеется избыток энергии, то усиление синтеза жирных кислот достигается поступлением в цитозоль цитрата и при наличии малонил-S-КоА. Полученные молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле.
Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление. 55. Пути образования и использования в клетке пвк. Механизм окислительного декарбоксилирования пирувата. Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А. Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов: · Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию. · Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции. · Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД.
Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН. Одна молекула глюкозы превращается при этом в две молекулы пвк. Дальнейший метаболизм пировиноградной кислоты возможен двумя путями — аэробным и анаэробным. В условиях достаточного поступления кислорода пировиноградная кислота превращается в ацетил-кофермент А, являющийся основным субстратом для цтк. Пируват также может быть превращён в анаплеротической реакции в оксалоацетат. Оксалоацетат затем окисляется до углекислого газа и воды. Если кислорода недостаточно, пировиноградная кислота подвергается анаэробному расщеплению с образованием молочной кислоты у животных и этанола у растений. При анаэробном дыхании в клетках пируват, полученный при гликолизе, преобразуется в лактат при помощи фермента лактатдегидрогеназы и NADP в процессе лактатной ферментации, либо вацетальдегид и затем в этанол в процессе алкогольной ферментации. Пировиноградная кислота является «точкой пересечения» многих метаболических путей. Пируват может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.218.215 (0.004 с.) |
 Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.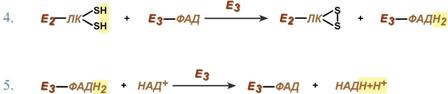 Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2).
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2).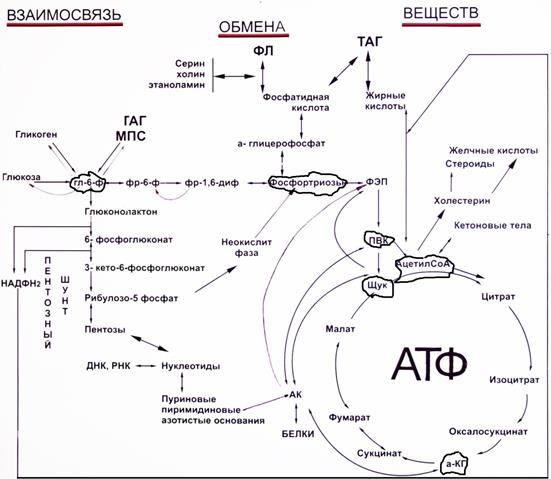 56. Взаимосвязь обмена ж, б, у, н. кислот. Ключевые метаболиты.
56. Взаимосвязь обмена ж, б, у, н. кислот. Ключевые метаболиты.


