
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простые липиды. Классификация. Структура. Биологическая роль.Стр 1 из 14Следующая ⇒
Образование и биологическая роль липопротеинов крови. Биохимическое проявление атеросклероза. Липопротеины. Структура. Биологическая роль. Поскольку липиды являются гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов. · хиломикроны (ХМ), · липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП), · липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП), · липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП). Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную, ферментативную и кофакторную функции. Одним из самых ярких и клинически значимых нарушений обмена липопротеинов является атеросклероз. Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии. Стадии атеросклероза Морфологически выделяют четыре стадии атеросклероза. Первая и вторая стадии распространены широко и при правильном питании являются обратимыми, 3 и 4 стадии уже имеют клиническое значение и необратимы. Стадия – повреждение эндотелия Это "долипидная" стадия, обнаруживается даже у годовалых детей. Изменения этой стадии неспецифичны и ее могут вызывать: дислипопротеинемия, гипертензия, повышение вязкости крови, курение, вирусные и бактериальные инфекции, свинец, кадмий и т.п. На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости. Внешне это проявляется в разрыхлении и истончении (вплоть до исчезновения) защитного гликокаликса на поверхности эндотелиоцитов, расширении межэндотелиальных щелей. Это приводит к усилению выхода моноцитов и липопротеинов (ЛПНП и ЛПОНП) в интиму.
Стадия – стадия начальных изменений Отмечается у большинства детей и молодых людей. Поврежденный эндотелий и активированные тромбоциты вырабатывают медиаторы воспаления, факторы роста, эндогенные окислители. В результате через поврежденный эндотелий в интиму сосудов еще более активно проникают моноциты и способствуют развитию воспаления. Непосредственой биохимической причиной атеросклероза является модификация липопротеинов в зоне воспаления, в основном окислением, гликозилированием, ацетилированием. Моноциты, преобразуясь в макрофаги, активно поглощают измененные липопротеины при участии "мусорных" рецепторов. Под действием факторов роста гладкомышечные клетки медии мигрируют в интиму и начинают пролиферировать, превращаясь в макрофагоподобные клетки. Они также накапливают модифицированные ЛПНП. Накопление липидов в макрофагах быстро исчерпывает невысокие возможности клеток по утилизации свободного и этерифицированного ХС. Они переполняются стероидами и превращаются в пенистые клетки. Внешне на эндотелии появляются липидные пятна и полоски. Стадия – стадия осложнений На этой стадии происходят: · кальцификация бляшки и ее изъязвление, приводящее к липидной эмболии, · тромбоз из-за адгезии и активации тромбоцитов, · разрыв сосуда. ЛИПОПРОТЕИНЫ (липопротеиды), комплексы, состоящие из белков (аполипопротеинов; сокращенно - апо-липопротеины) и липидов, связь между к-рыми осуществляется посредством гидрофобных и электростатич. взаимодействий. Липопротеины подразделяют на свободные, или р-римые в воде (липопротеины плазмы крови,молока, желтка яиц и др.), и нерастворимые, т. наз. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений). Гемопротеины Подразделяются на неферментативные (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Цитохромы Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепимикросомального окисления. Флавопротеины Являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез,дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утилизации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека.Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины(железопорфирины), напротив, катализируют обратную реакцию – образование молекулы воды, связанное с освобождением энергии. Стадии транскрипции Выделяют три стадии транскрипции: инициация, элонгация и терминация. Инициация Промотор содержит стартовый сигнал транскрипции – ТАТА-бокс. Так называется определенная последовательность нуклеотидов ДНК, связывающая первый фактор инициации ТАТА-фактор. Этот ТАТА-фактор обеспечивает присоединение РНК-полимеразы к той нити ДНК, которая будет использоваться в качестве шаблона для транскрипции (матричная нить ДНК). Так как промотор ассиметричен ("ТАТА"), то он связывает РНК-полимеразу только в одной ориентации, что определяет направление транскрипции от 5'-конца к 3'-концу (5'→3'). Для связывания РНК-полимеразы с промотором необходим еще один фактор инициации – σ-фактор (греч. σ – "сигма"), но сразу после синтеза затравочного фрагмента РНК (длиной 8-10 рибонуклеотидов) σ-фактор отрывается от фермента.
Элонгация Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу ДНК на протяжении примерно 17 нуклеотидных пар. РНК-полимераза продвигается со скоростью 40-50 нуклеотидов в секунду в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии.
Терминация РНК-полимераза остановится, когда достигнет терминирующих кодонов. С помощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ – "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК. Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг. У эукариот процессингу подвергаются все виды пре-РНК, у прокариот – только предшественники рРНК и тРНК. Регуляция у прокариот Регуляция биосинтеза белка у прокариот осуществляется на уровне изменения скорости синтеза мРНК. В настоящее время принята теория оперона. В основе теории лежат следующие понятия: · оперон – группа тесно связанных между собой генов, которые программируют образование структурных белков и ферментов в клетке, · конституитивные ферменты – те, которые присутствуют в клетках всегда, независимо от ее активности и условий, · индуцибельные ферменты – те, которые программируются опероном и синтезируются при необходимости, · ген-регулятор – ген, регулирующий работу оперона, но не входящий в его состав. Он синтезирует белок-регулятор (чаще называемый белок- репрессор), который может быть в активной или неактивной форме, · ген-оператор – участок ДНК, способный связываться с белком-регулятором, и "решающий" нужно работать РНК-полимеразе или нет. Предложены две схемы регуляции скорости транскрипции: по механизму индукции (лактозный оперон) и по механизму репресии (триптофановый оперон). Лактозный оперон Лактозный оперон в целом отвечает за катаболизм лактозы. В клетке может быть две взаимоисключающие ситуации: · активность одного из ферментов катаболизма лактозы низка, если в среде имеется много глюкозы. · активность этого же фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы. На основании наблюдений была предложена схема регуляции оперона по механизму индукции: 1. При отсутствии лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются. 2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая ему связаться с геном-оператором и препятствовать работе РНК-полимеразы. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК.
Таким образом, лактоза является индуктором транскрипции. Триптофановый оперон Триптофановый оперон в целом отвечает за синтез триптофана. Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляция осуществляется по механизму репрессии. 1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан. 2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. Таким образом, при наличии триптофана в среде прекращается его внутриклеточный синтез, экономятся ресурсы и энергия бактериальной клетки. В этом случае триптофан является репрессором транскрипции. Регуляция у эукариот Существенное усложнение эукариотических организмов повлекло за собой появление новых способов регуляции активности транскрипции: Амплификация – это увеличение количества генов, точнее многократное копирование одного гена. Естественно, все полученные копии равнозначны и одинаково активно обеспечивают транскрипцию. Энхансеры (англ. to enhance – усиливать) – это участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В отличие от промоторов они значительно удалены от транскрипционного участка и могут располагаться от него в любом направлении (к 5'-концу или к 3'-концу). Сами энхансеры не кодируют какие-либо белки, но способны связываться с регуляторными белками (подавляющими транскрипцию). Сайленсеры (англ. silence – молчание) – участки ДНК, в принципе схожие с энхансерами, но они способны замедлять транскрипцию генов, связываясь с регуляторными белками (которые ее активируют). Перестройка генов. К подобным процессам относится кроссинговер – обмен участками гомологичных хромосом, и более сложный процесс – сайт-специфичная рекомбинация, которая изменяет положение и порядок нуклеотидных последовательностей в геноме. Процессинг мРНК – некоторые пре-мРНК подвергаются разным вариантам сплайсинга (альтернативный сплайсинг) в результате чего образуются разные мРНК, и соответственно, белки с разной функцией. Изменение стабильности мРНК – чем выше продолжительность жизни мРНК в цитозоле клетки, тем больше синтезируется соответствующего белка. Образование нуклеозидтрифосфатов АТФ и ГТФ. Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза, образующий АТФ в реакциях окислительного фосфорилирования.
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках. Реакции катаболизма пуринов Реакции распада пуринов можно условно разделить на 5 стадий: 1. Дефосфорилирование АМФ и ГМФ – фермент 5'-нуклеотидаза. 2. Окисление С6 в аденозине с одновременным его дезаминированием – фермент дезаминаза. Образуется инозин. 3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза. 4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина 5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки. Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует аспарагиновая кислота, глутамин, СО2, затрачивается 2 молекулы АТФ. В отличие от разветвленного синтеза пуринов этот синтез происходит линейно, т.е. пиримидиновые нуклеотиды образуются последовательно, друг за другом. Условно можно выделить 3 общих этапа синтеза и реакции синтеза УТФ и ЦТФ:
Образование карбамоилфосфата в отличие от синтеза мочевины происходит в цитозоле большинства клеток организма. Образование пиримидинового кольца Формирование пиримидинового кольца происходит после присоединения аспартата и реакций дегидратации и окисления. Первым пиримидиновым основанием является оротовая кислота. Синтез уридинтрифосфата Синтез УТФ осуществляется из УМФ в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез цитидинтрифосфата Образование цитидинтрифосфата (ЦТФ) происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося донором NH2-группы. Распад пиримидиновых нуклеотидов происходит параллельно, с использованием одинаковых реакций и ферментов. Можно отметить несколько специфичных ферментов:1. Фермент 5'-нуклеотидаза отщепляет 5'-фосфатную группу от ЦМФ, УМФ и ТМФ. 2. Аденозин-дезаминаза проводит окислительное дезаминирование цитидина. 3. Нуклеозид-фосфорилаза удаляет рибозу от уридина и тимидина. 4. Дигидроурацил-дегидрогеназа – восстановление урацила и тимина. 5. Дигидропиримидиназа осуществляет гидролитическое расщепление пиримидинового кольца. 6. Далее происходит гидролитическое отщепление аммиака и углекислого газа. 7. После окончательного разрушения пиримидинового кольца появившиеся β-аминокислоты направляются в реакции трансаминирования, после чего соответствующие кетокислоты изомеризуются и далее сгорают в ЦТК. Функция 1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Функция 1. Восстановление ФАД в окислительно-восстановительных реакциях. 2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q. Функция 1. Принимает электроны от коэнзима Q и передает их на цитохром с. 2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Функция 1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды. 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: · одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. · другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Функции триацилглицеролов · резервно-знергетическая – у среднего человека запасов подкожного жира хватает на поддержание жизнедеятельности в течение 40 дней полного голодания, · теплосберегающая – за счет толщины подкожного жира, · в составе подкожной и брыжеечной жировой ткани механическая защита тела и внутренних органов. Ковалентная модификация Благодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования. Инсулин активирует протеинфосфатазу и способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза. Глюкагон, адреналин или другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибирование ацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу. При уменьшении количества инсулина и возрастании глюкагона усиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров. Метаболическая регуляция В регуляции синтеза и окисления жирных кислот играют роль три участка: 1. Активность ацетил-SКоА-карбоксилазы регулируется: · цитратом – аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии, · ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот. 2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот. 3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление. Таким образом, когда в клетке имеется избыток энергии, то усиление синтеза жирных кислот достигается поступлением в цитозоль цитрата и при наличии малонил-S-КоА. Полученные молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле. Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление. 55. Пути образования и использования в клетке пвк. Механизм окислительного декарбоксилирования пирувата. Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А. Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов: · Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию. · Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции. · Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД.
Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН. Одна молекула глюкозы превращается при этом в две молекулы пвк. Дальнейший метаболизм пировиноградной кислоты возможен двумя путями — аэробным и анаэробным. В условиях достаточного поступления кислорода пировиноградная кислота превращается в ацетил-кофермент А, являющийся основным субстратом для цтк. Пируват также может быть превращён в анаплеротической реакции в оксалоацетат. Оксалоацетат затем окисляется до углекислого газа и воды. Если кислорода недостаточно, пировиноградная кислота подвергается анаэробному расщеплению с образованием молочной кислоты у животных и этанола у растений. При анаэробном дыхании в клетках пируват, полученный при гликолизе, преобразуется в лактат при помощи фермента лактатдегидрогеназы и NADP в процессе лактатной ферментации, либо вацетальдегид и затем в этанол в процессе алкогольной ферментации. Пировиноградная кислота является «точкой пересечения» многих метаболических путей. Пируват может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол.
Классификация по строению
Избыток У взрослых патологическое повышение уровня соматотропина или длительное введение экзогенного соматотропина в дозах, характерных для растущего организма, приводит к утолщению костей и огрублению черт лица, увеличению размеров языка — макроглосии. Сопутствующие осложнения — сдавливание нервов (туннельный синдром), уменьшение силы мышц, повышение инсулиноустойчивости тканей. Обычная причина акромегалии — аденома передней доли гипофиза. Обычно аденомы возникают в зрелом возрасте, но при редких случаях их возникновения в детстве наблюдается гипофизарный гигантизм. Недостаток Недостаток гормона роста в детском возрасте связан в основном с генетическими дефектами и вызывает задержку роста гипофизарный нанизм, а иногда также полового созревания. Задержки умственного развития, видимо, наблюдаются при полигормонной недостаточности, связанной с недоразвитием гипофиза. Во взрослом возрасте дефицит гормона роста вызывает усиленное отложение жира на теле. Лютеотропный гормон (пролактин) — регулирует лактацию, дифференцировку различных тканей, ростовые и обменные процессы, инстинкты заботы о потомстве.. По химическому строению является пептидным гормоном. Основным органом-мишенью пролактина являются молочные железы. Пролактин необходим для осуществления лактации, он повышает секрецию молозива, способствует созреванию молозива, превращению молозива в зрелое молоко. Он также стимулирует рост и развитие молочных желез и увеличение числа долек и протоков в них. Кроме молочных желез, рецепторы пролактина обнаружены почти во всех остальных органах тела, но действие этого гормона на них пока не известно. Пролактин отвечает за торможение овуляционного цикла, ингибируя секрецию фолликулостимулирующего гормона (ФСГ) и гонадотропного-рилизинг фактора (ГнТФ). У женщин пролактин способствует продлению существования жёлтого тела яичников (удлинению лютеиновой фазы цикла), тормозит овуляцию и наступление новой беременности, снижает секрецию эстрогенов фолликулами яичников и секрецию прогестерона жёлтым телом. Состояние повышенного уровня пролактина в крови называется гиперпролактинемией. Выделяют два вида гиперпролактинемии: физиологическую и патологическую. Физиологическая гиперпролактинемия не связана с заболеваниями. Концентрация пролактина может увеличиваться во время глубокого сна, сильной физической нагрузки, при кормлении грудью, беременности, половом акте, стрессе. Патологическая гиперпролактинемия обычно вызвана какими-либо заболеваниями. При гиперпролактинемии у женщин нарушается менструальный цикл. Повышение концентрации пролактина может привести к развитию бесплодия, аноргазмии, фригидности, снижению уровня сексуального влечения, увеличению размеров молочных желез вплоть до формирования макромастии (гигантских молочных желез), могут развиться кисты или аденомы молочных желез, а впоследствии даже рак молочной железы. Гормоны щитовидной железы. Йодтирамины или тириоидные гомоны, также синтезирует кальцитонин (преимущественно синтезируется паращитовидными железами). Ионы йода после всасывания в кишечнике циркулируют в крови в виде иодидов калия и натрия. Щитовидная железа способна захватывать из крови 2/3 йодит ионов. Далее в щитовидной железе происходит синтез йод тираминов. Данные гормоны по происхождению являются производными АК. Они связываются с тириоглобулином а затем могут секретироваться в кровь отщепляясь от тириоглобулинов, транспортируются по крови к различным органам и тканям. Т3 и Т4 транспортируются по крови в связанном с белками состоянии, достигнув клеток мишеней они отщепляются от белковой части, при чем Т3 слабее связан с белком чем Т4 и по этому быстрее переходит из крови в ткань. Активность Т3 выше чем Т4. Оба гормона прекрасно проходят через плазматическую мембрану, проникая внутрь клетки и тут же Т4 превращается в Т3, путем деиодирования, таким образом активной формой тириоидных гормонов внутри клетки является только Т3. Действует по цитозольному механизму. Далее гормон взаимодействует с ДНК (хроматином) и активирует транскрипцию определенных генов. Конечным эффектом является большое количество ферментативных белков и белков-рецепторов. По влиянию на белковый обмен это анаболические гормоны. При действии этих гормонов синтезируются ферменты энергетического метаболизма, приводят к усилению энергетического метаболизма, увеличению числа митохондрий, их размеров, что в конечном счете приводит к усилению синтеза АТФ, энергетического обмена и теплопродукции. По влиянию на углеводный обмен эти гормоны являются диабетогенными, усиливают всасывание глюкозы в ЖКТ, эти гормоны стимулируют синтез ферментов гликолиза и пентозофосфатного цикла, гликогенолиза что соответственно стимулирует распад гликогена. По влиянию на обмен жиров. Являются липолитическими гормонами – усиливают расщепление жиров соответственно косвенно стимулируют энергетический обмен. Гипофункция: 1) Врожденная – гипотиреоз проявляется у детей в раннем возрасте, у детей развивается кретинизм (отставание в умственном и физическом развитии) 2) У взрослых – микседема, со временем под кожей скапливается слизь, в тканях задерживается вода (ожирение, вялость, снижение основного обмена) 3) Эндемический зоб – происходит увеличение щитовидной железы – причина дефицит йода, происходит компенсаторное разрастание щитовидной железы. Снижение основного обмена, понижение температуры тела, постепенно переходит в микседему – если не лечить недостаток йода. Гипертиреоз (тиреотоксикоз): 1) Похудение 2) Тремор рук 3) Повышенная температура, сердцебиение 4) Пучеглазие (экзофтальм) 5) Нарушение деятельности нервной системы (нервной системы) Кальцийтомин, паратгормон (паратирин) – оба гормона контролируют содержание кальция в крови. По химической структуре – полипептиды. Мембранно цитозольный механизм. Кальцитамин – органы мишени – скелет и почки, функция – подавляет резорбцию костей, подавляется выход кальция и фосфат ионов из костной ткани, снижается выход белка костной ткани – коллагена. Паратерин – в костях активирует резорбцию, в крови повышается концентрация кальция и фосфат ионов, В почках увеличивает реабсорбцию кальция и подавляет реабсорбцию фосфат ионов. Гипопаратиреоз – связан с недостаточной продукцией паратгормона, в крови уменьшается концентрация кальция и возрастает концентрация фосфат ионов. При недостатке кальция происходят судороги и повышается нервно-мышечнавя возбудимость за счет повышения фосфат ионов. Гиперпаратиреоз – избыточная секреция паратгормона. Происходит патологическое рассасывание костей, кстная ткань заменяется на фиброзную происходит размягчение, рассасывание костей. За счет повышения кальция (гиперкальцемии) – снижается мышечный тонус и снижается нервно-мышечная возбудимость, избыток кальция откладывается в виде нерастворимых солей в ткани почек преимущественно. Половые гормоны. Женские половые гормоны 1) Эстрогены: 1.1. Эстродиол – самый мощный 1.2. Эстрон (фоликулин) 1.3. Эстриол 2) Прогестины (гестогены) Механизм действия: цитозольный. Влияние на обмен белков: анаболическое Обмен углеводов: антидиабетогенное действие для эстродиола, способствует за счет увеличения синтеза определенных ферментов использованию глюкозы в клетке на синтез гликогена, на дихотомический распад глюкозы, в анаэробных условиях на образования из глюкозы лактата, что является ведущим процессом в эпителии влагалица, тем самым эстрогены способствуют созданию влагалищного секрета. Липидный обмен: липолитический гормон, но он отвечает за специфическое перераспределение жира в организме, в области бедер, талии, груди (по женскому типу). Эстрогены действуют на клетки молочных желез способствуя их пролиферации, способствуют разветвлению и разрастанию молочных протоков и повышают чувствительность молочных желез к таким гормонам как пролактин и окситоцин. Специфические функции эстрогена: 1) Своеобразно защищают организм от инфекции, повышая иммунитет, стимулируют образование антител, стимулируют систему моноцитов 2) В высоких концентрациях подавляют иммунную систему 3) Способствуют снижению в крови липопротеинов низкой и очень низкой плотности, повышает липопротеины высокой плотности, тем самым предупреждая развитие атеросклероза, тем не менее эту роль эстрогены играют и в мужском организме. 4) Эстрогены способствуют сохранению кальция в костной ткани, т.к. Поддерживают баланс между остеобластами и остеокластами.
Мужские половые гормоны (андрогены). Самый активный гормон тестестерон, действует по цитозольному механизму, но проникая в клетку он превращается в еще более активную форму дигидротестестерон, в таком виде он взаимодействует с циторецепторами в нутри клетки и проникает в ядро и активирует определенные гены. Анаболический гормон, усиливает синтез белков мышечной, костной ткани, усиливает синтез белков необходимых для сперматогенеза; это диабетогенный гормон (биосинтез белков должен обеспечиваться энергией), липолитический гормон. Главная функция: формирование половых признаков, секреция андрогенов начинается активно в раннем эмбриогенезе и по мере созревания плода она усиливается, определяются первичные половые признаки, формируется эмбрион мужского пола, к моменту рождени секреция андрогенов резко снижвется: у новорожденных мальчиков и девочек примерно одинакова. Секреция андрогенов возрастает в период полового созревани, стимулируется рост трубчатых костей, в целом рост скелета, развитие мышечной ткани формирование вторичных и развитие половых признаков.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 317; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.147 (0.131 с.) |
 Другие факторы инициации раскручивают спираль ДНК перед РНК-‑полимеразой.
Другие факторы инициации раскручивают спираль ДНК перед РНК-‑полимеразой.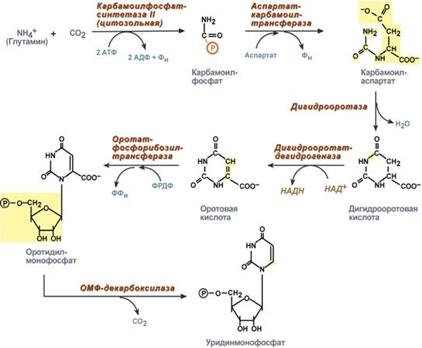 (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.
(фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.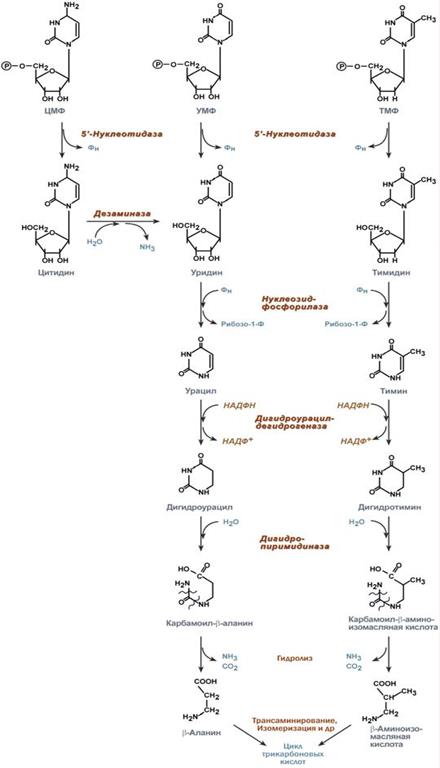 1. Образование карбамоилфосфата
1. Образование карбамоилфосфата Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.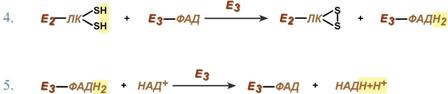 Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2).
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоамид-ацетилтрансферазой, Е2).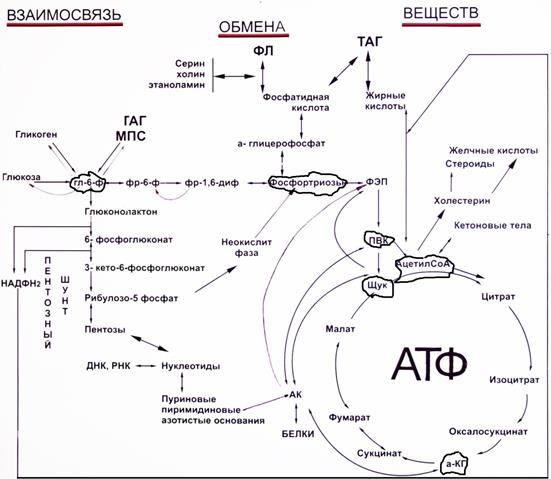 56. Взаимосвязь обмена ж, б, у, н. кислот. Ключевые метаболиты.
56. Взаимосвязь обмена ж, б, у, н. кислот. Ключевые метаболиты.


