
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 14. 2. Особенности метаболизма фагоцитирующих клеток⇐ ПредыдущаяСтр 90 из 90
Фагоцитоз обеспечивает защиту организма от бактерий. Моноциты и нейтрофилы мигрируют из кровяного русла к очагу воспаления и эндоцитозом захватывают бактерии, образуя фагосому. 1. Фагоцитоз требует увеличения потребления кислорода, который является главным источником O2-, H2O2, OH' в фагоцитирующих клетках (рис. 14.3). Этот процесс, продолжающийся 30-40 минут, сопровождается резким повышением поглощения кислорода и поэтому называется респираторным взрывом. 2. В макрофагах бактерицидное действие оказывает оксид азота NO, источником которого является реакция превращения аргинина в NO и цитруллин под действием NO-синтазы. Супероксид анион образует с оксидом азота соединения, обладающие сильными бактерицидными свойствами: NO + О2-→ ONOO- → ОН* + NO2. Пероксинитрит ONOO-, оксид азота, диоксид азота, гидроксил радикал вызывают окислительное повреждение белков, нуклеиновых кислот и липидов бактериальных клеток.
Активация NADPH-оксидазы, которая локализована на мембране клетки, вызывает образование супероксидных анионов. При фагоцитозе мембрана впячивается, затем образуется эндосома и супероксидсинтезирующая система вместе с бактериальной клеткой оказывается в эндосоме. Супероксидные анионы генерируют образование других активных молекул, включая Н2О2 и гидроксильные радикалы. Миелопероксидаза - гемсодержащий фермент, находящийся в гранулах нейтрофилов. Она поступает в эндосому, где образует НС1О. В результате мембраны и другие структуры бактериальной клетки разрушаются ТЕМА 14.3. ОСНОВНЫЕ БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ГЕМОСТАЗА Прекращение кровотечения после травмы кровеносных сосудов, раство рение сгустков крови - тромбов - и сохранение крови в жидком состоянии обеспечивает гемостаз. Этот процесс включает четыре этапа: • рефлекторное сокращение поврежденного сосуда в первые секунды после травмы; • образование в течение 3-5 минут тромбоцитарной пробки (белого тромба в результате взаимодействия поврежденного эндотелия с тромбоцитами; • формирование в продолжение 10-30 мин фибринового (красного" тромба: растворимый белок плазмы крови фибриноген под действием фермента тромбина превращается в нерастворимый фибрин, который откладывается между тромбоцитами белого тромба;
• фибринолиз - растворение тромба под действием протеолитических ферментов, адсорбированных на фибриновом сгустке. На этом этапе просвет кровеносного сосуда освобождается от отложений фибрина и предотвращается закупорка сосуда фибриновым тромбом. 1. Свертывание крови - важнейшая часть гемостаза. В процессе формирова ния фибринового тромба можно выделить четыре этапа. • Превращание фибриногена в фибрин-мономер. Молекула фибриногена состоит из шести полипептидных цепей трех типов - 2Аа, 2Вр, 2γ. Они связаны между собой дисульфидными связями и образуют три домена А- и В-участки находятся на N-концах цепей Аа и Вр соответственно Эти участки содержат много остатков дикарбоновых аминокислот и поэтому заряжены отрицательно, что препятствует агрегации молекул фибриногена (рис. 14.4). Тромбин, который относится к группе серино вых протеаз, отщепляет А- и В-пептиды от фибриногена; в результате образуется фибрин-мономер.
Фиброген состоит из шести полипептидных цепей 3 типов: 2Λα, 2Ββ и 2γ, образующих три домена (обозначены штрихами). Λ и В - отрицательно заряженные участки цепей Λα и Ββ препятствуют агрегации молекул фибриногена Образование нерастворимого геля фибрина. В молекулах фибринамономера имеются участки, комплементарные к другим молекулам фибрина, - центры связывания, между которыми образуются нековалентные связи. Это приводит к полимеризации молекул фибрина и формированию нерастворимого геля фибрина (рис. 14.5). Он непрочен, так как образован слабыми нековалентными связями.
Фибриноген, освобождаясь под действием тромбина от отрицательно заряженных пептидов 2А и 2В, превращается в фибрин-мономер. Взаимодействие комплементарных участков в доменах молекул фибрина-мономера с другими такими же молекулами приводит к образованию геля фибрина • Стабилизация геля фибрина. Фермент трансглутамидаза (фактор XIIIa) образует амидные связи между радикалами аминокислот Глн и Лиз мономеров фибрина и между фибрином и гликопротеином межклеточного матрикса фибронектином (рис. 14.6.)
• Сжатие геля осуществляет сократительный белок тромбоцитов тромбостенин в присутствии АТФ. 2. Свертывание крови может идти по внешнему или внутреннему пути. Внешний путь свертывания крови инициируется при взаимодействии белков свертывающей системы с тканевым фактором (Тф) - белком, который экспонируется на мембранах поврежденного эндотелия и активированных тромбоцитов, внутренний путь - при контакте белков свертывающей системы с отрицательно заряженными участками поврежденного эндотелия.
Коагуляции (образованию фибринового тромба) предшествует ряд последовательных реакций активации факторов свертывания крови. Эти реакции инициируются на поврежденной или измененной тромбогенным сигналом клеточной мембране и заканчиваются активацией протромбина. Каскад реакций прокоагулянтного этапа имеет ряд особенностей: • все ферменты являются протеазами и активируются частичным протеолизом; • все реакции локализованы на поврежденных мембранах клеток крови и эндотелия, поэтому тромб образуется на этих участках; • максимальную активность ферменты проявляют в составе мембранных комплексов, включающих фермент, фосфолипиды клеточных мембран, белок-активатор, Са2+. • большинство факторов свертывания активируется по механизму положительной обратной связи. В прокоагулянтном каскаде реакций внешнего пути последовательно образуются три мембранных комплекса (рис. 14.7). Каждый из них включает: • белок-активатор протеолитического фермента - тканевой фактор (Тф) (не требует активации), факторы V или VIII (активируются частичным протеолизом); • отрицательно заряженные фосфолипиды мембран эндотелия или тромбоцитов. При травме или поступлении тромбогенного сигнала нарушается поперечная асимметрия мембран, на поверхности появляются отрицательно заряженные фосфолипиды, экспонируется тканевой фактор и таким образом формируются тромбогенные участки; • ионы Са2+, взаимодействуя с полярными «головками» отрицательно заряженных фосфолипидов, обеспечивают связывание ферментов прокоагулянтного пути с мембранами клеток. В отсутствии Са2+ кровь не свертывается;
Стрелка - активация факторов свертывания крови; стрелка с точками - активация факторов свертывания по принципу положительной обратной связи; - - мембранный фосфолипидный компонент ферментных комплексов, в рамке - белкиактиваторы. 1, 2 - фактор VIIa мембранного комплекса УПа-Тф-Са2+ активирует факторы IX и X; 3 - фактор 1Ха мембранного комплекса IXa-VIIIa-Ca2+ (тенназа) активирует фактор X; 4, 5 - фактор Ха мембранного комплекса Ха-Уа-Са2+ (протромбиназа) превращает протромбин (фактор II) в тромбин (фактор Па) и активирует фактор VII по принципу положительной обратной связи; 6-10 - тромбин (фактор Па) превращает фибриноген в фибрин, активирует факторы V, VII, VIII и XIII • один из протеолитических ферментов (сериновую протеазу) - фактор VII, IX или X. Эти белки содержат на N-концах молекул 10-12 остатков γ-карбоксиглутаминовой кислоты. Посттрансляционное карбоксилирование факторов VII, IX, X, а также протромбина, плазминогена и протеина С катализирует γ-глутамилкарбоксилаза. Коферментом этого фермента является восстановленная форма витамина K, которая образуется в печени под действием NADPH-зависимой витамин К-редуктазы (рис. 14.8).
Структурные аналоги витамина К - дикумарол и варфарин - являются конкурентными ингибиторами NADPH-зависимой витамин K-редуктазы. Они снижают скорость восстановления витамина К и, следовательно, активность γ-глутамилкарбоксилазы. Производные варфарина и дикумарола используют как непрямые антикоагулянты для предотвращения тромбозов. Инициирующий мембранный комплекс содержит белок-активатор Тф, фермент фактор VII и ионы Са2+. Фактор VII обладает небольшой активностью, но в комплексе VII-Тф-Са2+ его активность в результате конформационных изменений возрастает, и он частичным протеолизом активирует фактор X.
Кроме того, инициирующий комплекс активирует фактор IX. Мембранные комплексы IXа-VIIIa-Са2+ (тенназа) и VIIа-Тф-Са2+ образуют активный фактор Xа. Последний в составе протромбиназного комплекса Xа-Vа-Са2+ может превращать небольшое количество протромбина (фактор II) в тромбин (фактор На). Образовавшийся тромбин активирует (по принципу положительной обратной связи) факторы V, VIII, VII, которые включаются в состав мембранных комплексов. Протромбин -это гликопротеин плазмы крови, который синтезируется в печени. Молекула протромбина состоит из одной полипептидной цепи, содержит одну дисульфидную связь и остатки γ-карбоксиглутамата. Последние, взаимодействуя с Са2+, связывают профермент с мембраной (рис. 14.9). Фактор Xa протромбиназного комплекса гидролизует две пептидные связи в молекуле протромбина, и он превращается в тромбин. Тромбин состоит из двух полипептидных цепей, связанных дисульфидной связью, и не содержит остатков γ-карбоксиглутамата (рис. 14.10).
ВМК - высокомолекулярный кининоген; Тф - тканевой фактор. Обозначения см. на рис. 14.7 Все ферменты свертывающей системы крови являются протеазами и активируются частичным протеолизом: 1 - активируемый контактом с субэндотелием фактор XII превращает прекалликреин в калликреин; 2 - калликреин комплекса калликреин-ВМК частичным протеолизом активирует фактор XII; 3 - фактор XIIa комплекса XIIа-BMK активирует фактор XI; 4 - активированный частичным протеолизом фактор XIIa комплекса XIIa-ВМК превращает прекалликреин в калликреин по принципу положительной обратной связи; 5 - фактор XIa комплекса XIa-ВМК активирует фактор IX; 6 - фактор IXа мембранного комплекса IXа-УШа-Са2+ активирует фактор X; 7, 8 - фактор УПа мембранного комплекса УПа-Тф-Са2+ активирует факторы IX и X; 9 - фактор Xa протромбиназного комплекса активирует фактор II (протромбин); 10, 11 - фактор IIа (тромбин) превращает фибриноген в фибрин и активирует фактор XIII (трансглутамидазу); 12 - фактор XIIIa катализирует образование амидных связей в геле фибрина; 5. Таким образом, каскад реакций внешнего и внутреннего путей свертывания крови приводит к образованию протромбиназы. Этапы, одинаковые для обоих путей, называют общим путем свертывания крови. Каждое ферментативное звено реакций свертывания крови обеспечивает усиление сигнала, а положительные обратные связи обусловливают лавинообразное ускорение всего процесса, быстрое образование тромба и прекращение кровотечения. 6. Гемофилии. Снижение свертываемости крови приводит к гемофилиям - заболеваниям, сопровождающимся повторяющимися кровотечениями. Причина кровотечений при этих заболеваниях - наследственная недостаточность белков свертывающей системы крови. Гемофилия А обусловлена мутацией гена фактора VIII, локализованного в X-хромосоме. Дефект этого гена проявляется как рецессивный признак, поэтому этой формой болезни страдают только мужчины. Гемофилия А сопровождается подкожными, внутримышечными и внутрисуставными кровоизлияниями, опасными для жизни. Гемофилия В связана с генетическим дефектом фактора IX, который встречается гораздо реже. 7. Противосвертывающая система крови ограничивает распространение тромба и сохраняет кровь в жидком состоянии. К ней относятся ингибиторы ферментов свертывания крови и антикоагулянтная система (антикоагулянтный путь).
• Антитромбин III - белок плазмы крови, который инактивирует ряд сериновых протеаз: тромбин, факторы IXa, Xa, XIIa, плазмин, калликреин. Этот ингибитор образует комплекс с ферментами, в составе которого они теряют свою активность. Активатором антитромбина III является гетерополисахарид гепарин. Гепарин поступает в кровь из тучных клеток соединительной ткани, взаимодействует с ингибитором, изменяет его конформацию, повышая его сродство к сериновым протеазам (рис. 14.12). • Ингибитор тканевого фактора (антиконвертин) синтезируется клетками эндотелия и локализуется на поверхности плазматической мембраны. Он образует с фактором Xa комплекс, который связывается с фосфолипидами мембран и тканевым фактором. В результате этого комплекс УПа-Тф-Са2+ не образуется и становится невозможной активация факторов X и IX. • a 2-Макроглобулин взаимодействует с активными сериновыми протеазами и подавляет их протеолитическую активность. • а1-Антитрипсин ингибирует тромбин, фактор XIa, калликреин, а также панкреатические и лейкоцитарные протеазы, ренин, урокиназу. • Антикоагулянтная система (система протеина С) включает последовательное образование двух ферментных комплексов. Взаимодействие тромбина с белком-активатором тромбомодулином (Тм) в присутствии ионов Са2+ приводит к образованию первого мембранного комплекса
• Гепарин связывается с антитромбином III, изменяет его конформацию и увеличивает сродство к сериновым протеазам. • Присоединение протеазы к комплексу гепарин-антитромбин III снижает сродство гепарина к ингибитору. Гетерополисахарид освобождается из комплекса и может активировать другие молекулы антитромбина III антикоагулянтной системы Па-Тм-Са2+. В его составе тромбин, с одной стороны, теряет способность активировать факторы V и VIII, а также превращать фибриноген в фибрин, а с другой - частичным протеолизом активирует протеин С. Активированный протеин С (Са), взаимодействуя с белком активатором S, образует с помощью Са2+ на мембране комплекс протеин Са-S-Са2+. В этих условиях активированный протеин С (Са) катализирует гидролиз белков-активаторов факторов Va и VIIIa (рис. 14.13).
8. Фибринолиз - это гидролиз фибрина в составе тромба с образованием растворимых пептидов, которые удаляются из кровотока. Этот этап гемостаза предотвращает закупорку сосуда фибриновым тромбом. Формирование фибринового тромба сопровождается осаждением на нем профермента плазминогена и его активаторов. Неактивный плазминоген синтезируется в печени и поступает в кровь. В крови он превращается в активный фермент плазмин частичным протеолизом. Эту реакцию катализируют протеолитические ферменты: тканевой активатор плазминогена (ТАП), урокиназа, фактор XIIa и калликреин (рис. 14.14).
1 - плазминоген под действием активаторов (ТАП, калликреина, урокиназы, фактора XIIa) частичным протеолизом превращается в плазмин; 2 - плазмин гидролизует фибрин с образованием растворимых пептидов; 3 - ТАП поступает в кровоток и ингибируется специфическими ингибиторами I и II типа; 4 - плазмин ингибируют неспецифические ингибиторы сериновых протеаз Образующийся плазмин разрушает фибриновые волокна. Освобождающиеся из тромба плазмин и его активаторы поступают в кровоток. В крови плазмин инактивируется неспецифическими ингибиторами сериновых протеаз, а активаторы плазминогена - ингибиторами активаторов плазминогена I и II типа. Наследственная или приобретенная недостаточность белков фибринолитической системы сопровождается тромбозами. ТЕМА 14.4. ОСНОВНЫЕ СВОЙСТВА БЕЛКОВЫХ ФРАКЦИЙ КРОВИ И ЗНАЧЕНИЕ ИХ ОПРЕДЕЛЕНИЯ ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ Белки плазмы крови: • образуют буферную систему крови и поддерживают рН крови в пределах 7,37-7,43; • поддерживают осмотическое давление, удерживая воду в сосудистом русле; • транспортируют метаболиты, витамины, ионы металлов, лекарства; • определяют вязкость крови, играя важную роль в гемодинамике кровеносной системы; • являются резервом аминокислот для организма; • выполняют защитную роль. 1. Общий белок плазмы крови составляет 60-80 г/л, альбумин - 40- 60 г/л, глобулины 20-30 г/л. Белки плазмы крови электрофоретически можно разделить на фракции, количество которых в зависимости от условий электрофореза может составлять от пяти до шестидесяти. При электрофорезе на бумаге белки делятся на пять фракций: альбумин (55-65%), - α1- глобулины (2-4%), α 2-глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%). Альбумин имеет наибольшую, а γ-глобулины наименьшую подвижность в электрическом поле. Большинство белков плазмы крови синтезируется в печени, однако некоторые образуются и в других тканях. Например, γ-глобулины синтезируются В-лимфоцитами, а пептидные гормоны в основном секретируют эндокринные железы. 2. Белок альбумин синтезируется в печени, имеет небольшую молекулярную массу и составляет большую часть белков плазмы крови. Благодаря высокому содержанию дикарбоновых аминокислот альбумин удерживает катионы, главным образом Na+, Са2+, Zn2+, и играет основную роль в сохранении коллоидно-осмотического давления. Альбумин является важнейшим транспортным белком. Он транспортирует жирные кислоты, неконъюгированный билирубин, триптофан, тироксин, трийодтиронин, альдостерон, многие лекарства. 3. Глобулины составляют четыре фракции: α1, α2, β и γ. В эти фракции входят белки, которые выполняют специфические и защитные функции, например, тироксин- и кортизолсвязывающие белки, трансферрин, церулоплазмин (ферроксидаза), интерфероны, иммуноглобулины. 4. Содержание белков в плазме крови может изменяться при патологических состояниях. Такие изменения называются диспротеинемией. • Гиперпротеинемия -это повышение концентрации белков в плазме крови. Гиперпротеинемия может быть вызвана потерей воды организмом при полиурии, диарее, рвоте или обусловлена повышением содержания γ-глобулинов и некоторых других белков при острых воспалительных процессах, травмах, миеломной болезни. Их называют белками острой фазы, и к ним относят, например, С-реактивный белок (называемый так потому, что взаимодействует с С-полисахаридами пневмококков), гаптоглобин (образует комплекс с гемоглобином, который поглощается макрофагами, что предотвращает потерю железа), фибриноген. • Гипопротеинемия в основном является следствием нарушения синтеза или потери организмом альбумина, то есть является гипоальбуминемией. Она наблюдается при нефрите, гепатите, циррозе печени, ожогах, продолжительном голодании. Уменьшение содержания альбумина в крови приводит к снижению осмотического давления, а также нарушению распределения жидкости между сосудистым руслом и межклеточным пространством, что проявляется в виде отеков.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 574; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.0.25 (0.039 с.) |
 Рис. 14.3. Образование активных форм кислорода в процессе респираторного взрыва активированными макрофагами, нейтрофилами и эозинофилами.
Рис. 14.3. Образование активных форм кислорода в процессе респираторного взрыва активированными макрофагами, нейтрофилами и эозинофилами. Рис. 14.4. Строение фибриногена.
Рис. 14.4. Строение фибриногена. Рис. 14.5. Образование геля фибрина.
Рис. 14.5. Образование геля фибрина. Рис. 14.6. Образование амидных связей между остатками Глн и Лиз в мономерах фибрина
Рис. 14.6. Образование амидных связей между остатками Глн и Лиз в мономерах фибрина Рис. 14.7. Прокоагулянтный этап внешнего пути свертывания крови и превращение фибриногена в фибрин.
Рис. 14.7. Прокоагулянтный этап внешнего пути свертывания крови и превращение фибриногена в фибрин. Рис. 14.8. Посттрансляционное карбоксилирование остатков глутаминовой кислоты в молекулах сериновых протеаз свертывающей системы крови; роль Са2+ в связывании этих ферментов на тромбогенных участках клеточных мембран
Рис. 14.8. Посттрансляционное карбоксилирование остатков глутаминовой кислоты в молекулах сериновых протеаз свертывающей системы крови; роль Са2+ в связывании этих ферментов на тромбогенных участках клеточных мембран


 эндотелия формируются три ферментных комплекса, каждый из которых содержит один из протеолитических ферментов - фактор калликреин или фактор и белок-активатор высокомолекулярный кининоген (ВМК). Калликреин - сериновая протеаза, субстратами которой являются фактор XII и некоторые белки плазмы крови, например плазминоген. Комплекс фактор XIIa-ВМК превращает прекалликреин в калликреин, который вместе с ВМК по принципу положительной обратной связи активирует фактор XII, включающийся в комплекс XIIa-BMK. В его составе фактор XIIa протеолитически активирует фактор XI, который в комплексе с ВМК превращает фактор IX в активный IXа. Последний включается в состав мембранного комплекса IXа-УШа-Са2+, который частичным протеолизом образует фактор Xа, являющийся протеолитическим ферментом протромбиназы Xа-Vа-Са2+) (рис. 14.11).
эндотелия формируются три ферментных комплекса, каждый из которых содержит один из протеолитических ферментов - фактор калликреин или фактор и белок-активатор высокомолекулярный кининоген (ВМК). Калликреин - сериновая протеаза, субстратами которой являются фактор XII и некоторые белки плазмы крови, например плазминоген. Комплекс фактор XIIa-ВМК превращает прекалликреин в калликреин, который вместе с ВМК по принципу положительной обратной связи активирует фактор XII, включающийся в комплекс XIIa-BMK. В его составе фактор XIIa протеолитически активирует фактор XI, который в комплексе с ВМК превращает фактор IX в активный IXа. Последний включается в состав мембранного комплекса IXа-УШа-Са2+, который частичным протеолизом образует фактор Xа, являющийся протеолитическим ферментом протромбиназы Xа-Vа-Са2+) (рис. 14.11). Рис. 14.11. Схема внутреннего и внешнего путей свертывания крови:
Рис. 14.11. Схема внутреннего и внешнего путей свертывания крови: Рис. 14.12. Инактивация антитромбином III сериновых протеаз.
Рис. 14.12. Инактивация антитромбином III сериновых протеаз.
 Разрушение этих белков-активаторов приводит к торможению каскада реакций внешнего пути свертывания крови и остановке образования тромба.
Разрушение этих белков-активаторов приводит к торможению каскада реакций внешнего пути свертывания крови и остановке образования тромба. Рис. 14.14. Фибринолитическая система крови:
Рис. 14.14. Фибринолитическая система крови: Рис. 14.16. Прокоагулянтный этап свертывания крови и образование геля фибрина
Рис. 14.16. Прокоагулянтный этап свертывания крови и образование геля фибрина Рис. 14.17. Роль тромбина на прокоагулянтном этапе и в антикоагулянтном пути свертывания крови
Рис. 14.17. Роль тромбина на прокоагулянтном этапе и в антикоагулянтном пути свертывания крови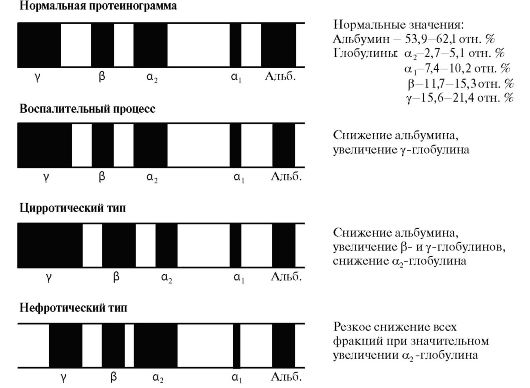 Рис. 14.18. Протеинограммы белков плазмы крови в норме и при некоторых патологических состояниях
Рис. 14.18. Протеинограммы белков плазмы крови в норме и при некоторых патологических состояниях


