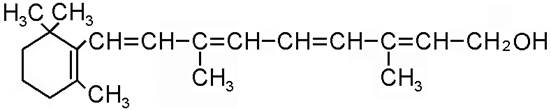Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Витамины. Классификация и номенклатура. Витаметрия. Жирорастворимые витамины.Стр 1 из 8Следующая ⇒
Витамины. Классификация и номенклатура. Витаметрия. Жирорастворимые витамины. Витамины – это необходимые для нормальной жизнедеятельности низкомолекулярные органические соединения, синтез которых в организме ограничен или отсутствует. Отличительные признаки витаминов: 1) витамины не выполняют пластических функций; 2) витамины не играют энергетической роли (т.е. не используются как источник энергии); 3) витамины не синтезируются в организме или синтезируются в недостаточных количествах; 4) дефицит витаминов вызывает специфические нарушения обмена веществ с характерными клиническими проявлениями; 5) выполняют специфические функции, которые невозможно заменить другими органическими соединениями; 6) витамины необходимы в миллиграммах или микрограммах в сутки (!).
Классификация витаминов Принята классификация по растворимости: 1) жирорастворимые (A, D, E, K); 2) водорастворимые (все остальные: В_, С, Р, Н); 3) витаминоподобные вещества – синтезируются в организме, но в недостаточном количестве (парааминобензойная к-та, коэнзим Q, холин, инозит, пангамовая к-та). Номенклатура витаминов представлена химическим названием и буквенным обозначением. Напр., витамин А – ретинол, витамин РР – никотинамид или никотиновая кислота, витамин В6 – пиридоксин, пиридоксаль или пиридоксамин. Также существует клиническое название витамина, которое состоит из названия патологического проявления недостатка витамина с приставкой анти-. (напр., витамин А – антиксерофтальмический витамин, витамин D – антирахитический витамин). Жирорастворимые витамины могут откладываться в печени в виде резервов (A, D, K), витамин Е может накапливаться в жировой ткани. Так как эти витамины нерастворимы в воде, то они не могут свободно проникать в кровь и выводиться с мочой. При избыточном поступлении этих витаминов могут развиваться токсические эффекты (в основном, витамина А и D). Водорастворимые витамины выводятся с мочой, поэтому их избытка не наблюдается. Возможен небольшой резерв фолиевой к-ты и витамина В12 в печени. Токсические эффекты не наблюдаются. Жирорастворимые витамины Витамин А Витамеры: А1 – ретинол и А2 – ретиналь. Клиническое название: антиксерофтальмический витамин.
По химической природе: циклический непредельный одноатомный спирт на основе кольца b-ионона.
Может разрушаться кислородом, т.е. является антиоксидантом. Роль витамина А в метаболизме: 1. Участвует в росте и дифференцировке клеток эмбриона, развивающегося организма. Участвует в делении и дифференцировке быстро пролиферирующих тканей (хрящевые, костные, эпителиальные ткани), т.к. витамин А может инициировать репликацию и участвует в образовании хондроитинсульфата. 2. Участвует в фотохимическом процессе зрения. В состав зрительного пигмента родопсина входит 11-цис-ретиналь, который при освещении переходит в 11-транс-ретиналь, активирующий фосфодиэстеразу, которая расщепляет цГМФ, в результате чего ионные каналы мембраны закрываются, возникает гиперполяризация мембраны и генерируется нервный импульс. При этом родопсин разлагается на белок опсин и 11-транс-ретиналь. В темноте наблюдается регенерация родопсина: транс-ретиналь ® (алкоголь-ДГ, НАД·Н2 → НАД) транс-ретинол ® (изомераза) цис-ретинол ®(алкоголь-ДГ, НАД·Н2 → НАД) цис-ретиналь ® (+опсин) родопсин Гиповитаминоз А проявляется нарушением темновой адаптации. Если наблюдается в растущем организме, то имеет место задержка роста. Гиповитаминоз А может перерасти в авитаминоз А, проявляющийся гемеролопией ("ночной слепотой"). При недостатке витамина А нарушается эпителизация, наблюдается избыточное ороговение эпителия (сухость кожи, сухость роговицы глаз – ксерофтальмия). Ксерофтальмия может привести к развитию микрофлоры, кератомаляции (размягчению роговицы), затем к её помутнению и амблеопии (слепоте). Причины гипо- и авитаминозов А: - недостаток в пище - нарушение всасывания в кишечнике - заболевания печени, при которых провитамин (кератин) не превращается в витамин - повышенная потребность в витамине А – у растущего организма, беременных, ночных водителей) Суточная потребность витамина А 1,0 - 2,5 мг, а провитамина А (каротина) 2,0 – 4,0 мг. Каротин (провитамин А) – димер витамина А. Содержится в растительных продуктах. (Различают альфа-, бета- и гамма-каротин.) Источники витамина А:
- животные жиры (рыбий жир, печень, яичный желток, сливочное масло); - каротин растительного происхождения (морковь, свекла, томаты, зеленый горошек).
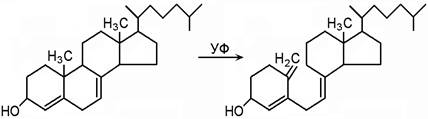
Витамин D Антирахитический витамин. Существуют два витамера: D2 – эргокальциферол и D3 – холекальциферол. Витамин D2 содержится в грибах. Витамин D3 синтезируется в организме под действием УФО (ультрафиолетового облучения): 7-дегидрохолестерол → холекальциферол (D3)
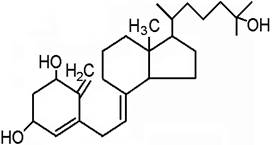
Роль витамина D в обмене веществ: Витамин D3 (холекальциферол) подвергается в организме превращению. Он поступает в печень, где под действием 25-гидроксилазы превращается в 25-гидроксихолекальциферол, затем в почках под действием ПТГ и 1-гидроксилазы – в 1,25-дигидроксихолекальциферол (гормон кальцитриол)
кальцитриол Функции кальцитриола 1. регулирует всасывание кальция и фосфора в кишечнике путем активации синтеза в энтероцитах кальций-связывающего белка (кальбиндина D); 2. в костях способствует минерализации ткани, поддержанию нормальной концентрации кальция и фосфора в межклеточном пространстве. (повышает активность щелочной фосфатазы, повышает концентрацию кальций-связывающего белка и остеокальцина) Гиповитаминоз D приводит к снижению уровня кальция в крови, снижению кальция и фосфора в межклеточном пространстве, нарушению минерализации костной ткани. Авитаминоз D – рахит. Различают рахит I типа (при недостатке витамина D) и рахит II типа (при недостатке рецепторов). Проявляется рахит деформациями скелета ("рахитические четки", Х-образные или О-образные голени, килевидная грудная клетка). Недостаток витамина D у взрослых сопровождается остеомаляцией, а в крови увеличивается активность щелочной фосфатазы. Причины гиповитаминозов D: - недостаток витамина D в пище - недостаток УФ (солнечного) облучения - недостаток парат-гормона Суточная потребность вит. D 0,012-0,025 мг. Источники витамина D: яичный желток, рыбий жир, сливочное масло (лучше летнее), печень, молоко.
Витамин Е Устар.: антистерильный витамин, антиоксидантный энзим. В химическом плане это альфа-, бета-, гамма- и дельта-токоферолы, но преобладающим является альфа-токоферол. Витамин Е устойчив к нагреванию. Роль витамина Е в обмене веществ 1. регулирует интенсивность свободно-радикальных реакций. Препятствует перекисному окислению липидов биомембран; 2. повышает активность витамина А. Гиповитаминоз Е специфической картины не имеет. Наиболее специфичны гемолитическая анемия недоношенных и патологии мембран. Суточная потребность витамина Е 20-25 мг. Источники витамина Е: растительные масла (!), а также печень, желток яиц, проросшие зерна; масло облепихи.
Витамин К Антигеморрагический витамин. Витамеры: К1 – филлохинон и К2 – менахинон. Роль витамина К в обмене веществ Это кофактор карбоксилирования глутаминовой кислоты (ГЛУ) в белке крови протромбине для его превращения в тромбин. протромбин → тромбин [карбоксилирование гамма-углеродного звена остатка глутамата] Антагонист витамина К – варфарин (крысиный яд), он близок по структуре к витамину К, является антикоагулянтом. Витамин К поступает в организм с зелеными растениями (шпинат, крапива), жирами, а также синтезируется микрофлорой кишечника.
Гиповитаминоз К проявляется геморрагиями. Авитаминоз К чаще наблюдается при нарушении всасывания его в кишечнике. {водорастворимая форма витамина К - викасол }
Классификация витаминов Принята классификация по растворимости: 1) жирорастворимые (A, D, E, K); 2) водорастворимые (все остальные: В_, С, Р, Н); 3) витаминоподобные вещества – синтезируются в организме, но в недостаточном количестве (парааминобензойная к-та, коэнзим Q, холин, инозит, пангамовая к-та). Номенклатура витаминов представлена химическим названием и буквенным обозначением. Напр., витамин А – ретинол, витамин РР – никотинамид или никотиновая кислота, витамин В6 – пиридоксин, пиридоксаль или пиридоксамин. Также существует клиническое название витамина, которое состоит из названия патологического проявления недостатка витамина с приставкой анти-. (напр., витамин А – антиксерофтальмический витамин, витамин D – антирахитический витамин). Жирорастворимые витамины могут откладываться в печени в виде резервов (A, D, K), витамин Е может накапливаться в жировой ткани. Так как эти витамины нерастворимы в воде, то они не могут свободно проникать в кровь и выводиться с мочой. При избыточном поступлении этих витаминов могут развиваться токсические эффекты (в основном, витамина А и D). Водорастворимые витамины выводятся с мочой, поэтому их избытка не наблюдается. Возможен небольшой резерв фолиевой к-ты и витамина В12 в печени. Токсические эффекты не наблюдаются.
Водорастворимые витамины Витамин С Аскорбиновая кислота, антискорбутный витамин (скорбут = цинга). Является лактоном. Легко окисляется: О=С─┐ О=С─┐ | │ | │ НО-С │ -2Н О=С │ ║ О ◄═══► | О НО-С │ +2Н О=С │ | │ | │ НС─┘ НС─┘ | | НО-СН НО-СН | | Н2С-ОН Н2С-ОН аскорбат дегидроаскорбат Енольные гидроксилы неустойчивы, особенно в присутствии кислорода. В кислой среде витамин С сохраняется лучше. Роль витамина С в обмене веществ 1. участвует в реакциях гидроксилирования (ЛИЗ→ОЛИ, ПРО→ОПР), что требуется для "сшивок" молекул коллагена в соединительной ткани; 2. участвует в триптофана и диоксиметила с образованием нейромедиаторов (норадреналин и др.); 3. необходим для синтеза кортикостероидов; 4. необходим для образования нейромедиаторов. Гиповитаминоз С проявляется поражением соединительной ткани – повышенная хрупкость сосудов, пипехии (точечные кровоизлияния на коже), кровоточивость десен.
Авитаминоз С – цинга (скорбут): кровоизлияния во внутренние органы, более выраженные повреждения соединительной ткани. Суточная потребность витамина С 100-150 мг. Она возрастает при инфекционных заболеваниях, стрессовых состояниях, лактации, беременности – до 300 мг/сут. Источники витамина С: овощи, фрукты, зеленые растения; главные – черная смородина, шиповник, грецкий орех, цитрусовые. В России основным источником его является картофель (10 мг/100 г) и квашенная капуста. Причины гиповитаминоза С: 1. витамин С неустойчив; 2. он необходим в относительно больших количествах; 3. в организме отсутствуют запасы витамина С.
Витамин Р Витамин проницаемости. Витамеры: рутин, катехины, цитрин. Это витамин-спутник витамина С. Гиповитаминоз Р: поражение сосудов, нарушение их проницаемости. Роль в обмене веществ Витамин Р тормозит активность гиалуронидазы, чем сохраняет соединительную ткань. А также участвует в окислительно-восстановительных реакциях. Потребность в витамине Р не установлена.
Витамин В1 и В6 Витамин В1 Тиамин, антиневритный витамин.
Тиамин устойчив в кислой среде (до 140ºС), а в щелочной среде быстро разрушается. Роль витамина В1 в обмене веществ 1. из него образуется ТПФ (тиаминпирофосфат) – кофермента декарбоксилаз кетокислот (пируват-ДК-комплекс, альфа-КГ-ДК) и транскетолазы; 2. участвует в передаче нервного импульса; 3. является коферментом транскетолазы. Гиповитаминоз В1: накопление ПВК и альфа-КГ в крови из-за нарушения их превращений, поражение нервной ткани из-за недостатка глюкозы. Авитаминоз В1 – болезнь бери-бери: полиневриты, отеки, сердечно-сосудистая недостаточность (иногда до некрозов), нарушения секреции и моторики ЖКТ (атония кишечника). Чаще развивается при хроническом алкоголизме, когда витамин В1 не всасывается. Суточная потребность витамина В1 2-3 мг. Потребность возрастает при углеводной пище (0,5 мг витамина на каждые 1000 ккал). Источники тиамина: дрожжи, хлеб грубого помола, каши, крупы (овсяная, гречневая, фасоль).
Витамин В6 Антидерматитный витамин. Пиридоксин → пиридоксаль → пиридоксамин [нарисовать формулы]
(все три эти соединения обладают витаминным действием) Роль витамина В6 в обмене веществ 1. он необходим для образования ПФ (пиридоксальфосфата) – кофермента амино-ТФ, декарбоксилаз АК, дезаминаз АК; 2. необходим для превращения триптофана в витамин РР; 3. нужен для превращения дельта-аминолевулиновой кислоты в гем. {Т.е., вит.В6 нужен для обмена аминокислот} Гиповитаминоз В6: анемия из-за нарушения обмена АК, плюс дерматиты, стоматиты, глосситы, конъюнктивиты. Суточная потребность в витамине В6 2-3 мг. Источники: печень, дрожжи, хлеб грубого помола, горох. Также он синтезируется микрофлорой кишечника. Гиповитаминоз возможен при длительном употреблении антибиотиков, особенно, противотуберкулезных препаратов.
Витамины В2 и РР Витамин В2 Рибофлавин
Устойчив в кислой среде, но разрушается в нейтральной и щелочной. Легко окисляется по двойной связи, что позволяет ему участвовать в о/в реакциях в виде коферментов (ФМН, ФАД): - окисляет восстановленную форму НАД·Н (компонент НАД·Н-дегидрогеназы в дыхательной цепи), - окисляет жирные к-ты, янтарную к-ту, аминокислоты. Авитаминоз В2: поражение эпителия слизистых, кожи, глаз; сухость слизистых губ, полости рта, трещины губ; дерматиты, сухость конъюнктивы, переходящая в конъюнктивиты, кератиты, васкуляризация глазных яблок. Суточная потребность 2-4 мг. Источники: дрожжи, печень; хлеб грубого помола, соя, яйца, молоко.
Витамин РР Антипеллагрический витамин. Витамеры: никотиновая к-та, никотинамид, ниацин.
Устойчив при кипячении. Роль витамина РР в обмене веществ Используется для синтеза НАД и НАДФ – коферментов дегидрогеназ. Гиповитаминоз РР: усталость, слабость. Более выраженный – пеллагра: диарея, дерматиты, деменция (слабоумие). Суточная потребность витамина РР 20-25 мг. Источники: дрожжи, печень, грибы, соя, бобы, мясо, мука пшеничная грубого помола. Может синтезироваться в организме из аминокислоты триптофана при участии витамина В6. Поэтому гиповитаминоз РР бывает при белковом голодании и при гиповитаминозе В6.
9. Витамины Н (биотин) и В3 (пантотеновая кислота) Витамин В3 Пантотеновая кислота. [рис. формулы НОСН2-С((СН3)2)-СН(ОН)-СО-NH-СН2-СН2-СООН] Состоит из масляной кислоты с b-аланином. Роль в обмене веществ Участвует в образовании КоА, который в свою очередь участвует: 1. синтезе и распаде жирных кислот; 2. транспорте ацильных остатков (пр., АцКоА) 3. в реакциях окислительного декарбоксилирования пирувата и a-кетоглутаровой кислоты. {Т.е. витамин В3 необходим для обмена Б, Ж, У} Авитаминоз – представлен разными формами; характерны дерматиты, поражения слизистой оболочки внутренних органов, поражение ЖВС (надпочечники, тимус), поражение нервной ткани. Авитаминозы практически не встречаются. Суточная потребность 10 мг. Этот витамин широко распространен, содержится в печени, яйцах. овсяных хлопьях, дрожжах. Также синтезируется микрофлорой кишечника.
Витамин Н (биотин ) Антисеборейный витамин. Структура: тиофен, соединеный с мочевиной+ боковая цепь (валериановая кислота). Устойчив при нагревании. Роль биотина в обмене веществ Биотин – кофермент карбоксилирования (превращение ацетил-КоА в малонил-КоА в синтезе ВЖК) и кофермент транскарбоксилирования в синтезе пуриновых оснований. Авитаминоз Н – себорея: покраснение и шелушение сальной кожи на волосистой части головы. Суточная потребность витамина Н 0,010 мг. Источники: печень, яйца, молоко. Авитаминоз бывает при употреблении сырых яиц, содержащих авидин (антивитамин Н).
Витаминоподобные соединения Парааминобензойная кислота Роль: входит в состав фолиевой кислоты, участвует в пигментации. При авитаминозах нарушение пигментации.
Холин Относится к витаминоподобным веществам. НО-СН2-СН2-N(CH3)3 Роль в обмене веществ 1. холин входит в состав сложных липидов (фосфатидилхолин); 2. источник метильных групп при синтезе различных соединений. В организме синтезируется из серина и метионина в необходимых количествах. Но метионин – незаменимая АК! Антивитомины Это вещества, которые нарушают использование витаминов. Их 2 группы: 1. антивитамины, прямо воздействующие на снижение активности витаминов, например авидин на витамин А, аскорбатоксидаза на витамин С; 2. структурные аналоги витаминов, похожие на витамины, но оказывающие противоположное действие, например сульфаниламиды похожи по структуре на ПАБК. Такие вещества используют для гибели микроорганизмов, которые их не различают.
Классификация гормонов Существует несколько видов классификации. По месту образования гормонов: 1. гормоны гипоталамуса; 2. гормоны гипофиза; 3. гормоны щитовидной железы; 4. гормоны поджелудочной железы; 5. гормоны паращитовидных желез; 6. гормоны надпочечников; 7. гормоны половых желез; 8. гормоны местного действия. По химическому строению: 1. белково-пептидные гормоны: гормоны гипоталамуса, гипофиза, поджелудочной железы, паращитовидных желез; 2. производные аминокислот: адреналин, норадреналин, тироксин, трийодтиронин; 3. стероиды: в их основе лежит структура циклопентанпергидрофенантрена, образуются из холестерина (половые гормоны, коры надпочечников). По механизму действия (по расположению рецепторов): 1. гормоны, действующие через внутриклеточный рецептор - липофильные гормоны - стероиды и тиреоидные гормоны; 2. гормоны, действующие через рецепторы, находящиеся на поверхности клетки - гидрофильные гормоны. Они действуют через внутриклеточный посредник - мессенджер. Гормон - первый посредник, а цАМФ, ионы Са2+, фосфатидилинозиды - вторые (чаще цАМФ, которая образуется из АДФ) посредники. [рис. цАМФ] Механизм действия гормонов Липофильные гормоны. Гормон диффундирует через плазматическую мембрану и связывается внутренними рецепторами, образуется комплекс «гормон-рецептор», который активируется и действует на ДНК. G+R®GR®GR*®ДНК. В ДНК выделяют гормон-чувствительный элемент (ГЧЭ). Под его влиянием изменяется транскрипция, что влияет на деградацию мРНК. Гормоны влияют на процессинг белка. Гормоны действуют непосредственно на ДНК, активируют ферменты, стимулируя их синтез.
Гидрофильные гормоны. Самый распространенный второй посредник - цАМФ-аденилатциклазная система. Она состоит из 2 частей: собственно аденилатциклазный компонент и протеинкиназный компонент. В плазматической мембране находятся рецепторы 2 типов: Rs - стимулирующий и Ri - ингибирующий. Внутри мембран находится G-белок (Gs, Gi) (читается джи-белок). G-белок распадается на a и bg субъединицы, которые могут взаимодействовать между собой. a-субъединица и ГТФ действуют на аденилатциклазу, превращая ее в активную форму. Эта активная аденилатциклаза находится на внутренней поверхности ЦПМ. Под влиянием АЦ АТФ превращается в цАМФ+ФФн. Разрушается цАМФ с помощью фермента - фосфодиэстеразы. После образования АЦ включается протеинциклазный компонент. цАМФ + протеинкиназа (фермент, вызывающий фосфорилирование других белков) ®активированая протеинкиназа. Протеинкиназа – тетрамер, содержащий 2 субъединицы R (регуляторная субъединица) и 2 субъединицы C (каталитическая субъединица). R2C2+4цАМФ«R2(4цАМФ) +2C (активная протеинкиназа). Активная протеинкиназа вызывает фосфорилирование белков. Белок+ АТФ®(над стрелкой 2С) фосфопротеин (серин-фосфат, треонин-фосфат) +АДФ. В результате образования фосфорилированных белков могут быть: 1. усиленный распад гликогена: фосфорилаза В®фосфорилаза А; 2. изменение транспорта ионов; 3. изменение метаболизма углеводов, липидов; 4. регулируется генная транскрипция. Таким образом, фосфорилирование белков является важнейшим регуляторным механизмом.
Ионы Са2+. Образуют соединение с белком - кальмодулин. Комплекс Са2+-кальмодулин активирует ферменты (аденилатциклазу, фосфодиэстеразу, Са2+-зависимую протеинкиназу). Есть группа гормонов, для которой второй посредник неизвестен - инсулин, гормон роста, пролактин.
Гормоны щитовидной железы В щитовидной железе образуются 3 гормона, 2 из которых близки по действию и образуются из тирозина: 1. 3,5,3’-трийодтиронин (Т3); 2. 3,5,3’,5’–тетрайодтиронин (Т4); 3. тиреокальцитонин. Т3 и Т4 образуются из АК – тирозина.
Образование тиреотропных гормонов происходит на белке тиреоглобулине. Сначала молекулы тирозина включаются в белковую структуру.
Особенности образования тиреоидных гормонов: - они связаны со структурой тиреоглобулина в ЩЖ; - для синтеза необходим йод. ЩЖ способна концентрировать йод в виде йодидов, при этом происходит: 1. окисление йодидов с помощью тиреопероксидазы; 2. йодирование тирозина; 3. конденсация (соединение) йод-тирозина. Тиреоглобулин, который содержит Т3 и Т4, разрушается с образованием этих гормонов под влиянием тиреотропного гормона (тиреоглобулин«(над стрелкой ТТГ, под - KI) Т3+Т4. KI тормозит распад тиреоглобулина и поэтому применяется для лечения гипертериоза. В кровь поступают свободные тиронины, но в крови они транспортируются с тироксин-связывающим глобулином (ТСГ). Биологически более активны свободные тиронины, но их немного.
Механизм действия тиреоидных гормонов. Тиреоидные гормоны проникают через плазматическую мембрану и связываются с ядерными рецепторами (рецепторы есть в ядре и цитоплазме). Сродство Т3 в 10 раз больше, чем Т4. Эти гормоны (Т3, Т4) индуцируют синтез белков, активируют транскрипцию мРНК.
Влияние на обмен веществ: 1. увеличивают поглощения кислорода почти во всех тканях, кроме мозга и половых желез; 2. повышают активность Na +,K + -АТФ-азы, но если активность повышается, концентрация АТФ снижается, следовательно усиливаются окислительные процессы; 3. снижают отношение кислорода к АТФ. Тиреоидные гормоны повышают синтез белка, при их нормальной концентрации наблюдается положительный азотистый баланс, но при очень высокой концентрации этих гормонов проявляется обратный эффект.
Нарушения секреции. Гипофункция – гипотиреоз - у детей может привести к нарушению умственного и физического развития, кретинизм. У взрослых - микседема (слизистый отек). Развитие эндемичного зоба связано с недостатком йодидов в воде и пище. Железистая ткань не развивается, а вместо нее образуется соединительная ткань, что приводит к увеличению массы ЩЖ. Гиперсекреция тиреоидных гормонов – гипертиреоз – проявляется в виде тиреотоксикоза - увеличение ЩЖ, но за счет железистой ткани. При этом повышаются окислительные процессы в организме. Наблюдается отрицательный азотистый баланс, потеря массы тела, повышается возбудимость, пучеглазие, дрожание конечностей.
Кальцитонин образуется в клетках ЩЖ. Это пептид, состоящий из 32 АК. Он снижают уровень Са2+ в крови, но механизм действия недостаточно изучен.
Гормоны паращитовидных желез Парат-гормон, состоит из 84 АК, регулирует уровень Са2+, стимулирует выход кальция (и фосфора) из костей в кровь; Повышают реабсорбцию кальция в почках, но стимулируется выход фосфора; Стимулирует образование кальцитриола из витамина Д3 в почках; Повышает всасывание кальция в кишечнике. Действует через цАМФ.
Гормоны половых желез Гонады - яйчники и семенники - железы смешанного типа. По химической природе их гормоны - стероиды. Андрогены (мужские) синтезируются в семенниках и коре надпочечников. Эстрогены (женские) - в яичниках и коре надпочечников. Синтезируются из холестерола, который образуется из Ац-КоА. Ац-КоА® холестерол® прегненолон ®прогестерон ®кортикостероиды. Из прогестерона также образуются андрогены (тестостерон), а из них - эстрогены. Эстрогены: эстрадиол, эстрон (образуется из эстрадиола в плаценте), эстриол, прогестерон.
Андрогены: тестостерон, андростерон (образуется из тестостерона).
Органы-мишени для эстрадиолов - матка и молочные железы, для андрогенов - простата, семенные пузырьки, мышцы. Механизм действия – цитозольный - гормоны соединяются с цитозольными рецепторами и действуют на ген. Основной эффект - синтез специальных белков репродуктивной системы.
Влияние на обмен веществ. Эстрогены: 1. синтезируют специфические белки; 2. обуславливают положительный азотистый баланс; 3. активируют пентозный цикл; 4. препятствуют накоплению липидов в жировой ткани и печени. Эстрогены имеют цикличность секреции: в фолликулярной фазе синтезируются эстрогены, в лютеиновой фазе - прогестерон.
Андрогены: 1. синтезируют специальные белки половой сферы; 2. стимулируют синтез мышечных белков; 3. стимулируют синтез белков печени и почек; 4. ускоряют развитие костной ткани; 5. ускоряют аэробное окисление; 6. обладают анаболическим эффектом; 7. влияют на развитие половых органов, вторичных половых признаков, половое влечени.
30 Ингибирование ферментов.(необратимое ингибирование, примеры, механизмы) Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. Следует различать ингибирование и инактивацию. Инактивация – это, например, денатурация белка в результате действия денатурирующих агентов.
По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые. Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Все процедуры по очистке белка не влияют на связь ингибитора и фермента. Пр.: действие фосфорорганических соединений на фермент – холинэстеразу. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление.
Биохимия крови Белковый состав крови Функции белков крови: 1. поддерживают онкотическое давление (в основном за счет альбуминов); 2. определяют вязкость плазмы крови (в основном за счет альбуминов); 3. определяют устойчивость форменных элементов в кровотоке (предупреждают склеивание клеток крови между собой); 4. участвуют в поддержании КЩС (кислотно-щелочного равновесия), образуя белковую буферную систему; 5. транспортируют метаболиты, биорегуляторы, микроэлементы, ксенобиотики (в основном за счет альбуминов). Напр., тироксинсвязывающий белок транспортирует гормон тироксин (Т4); 6. участвуют в регуляции гемостаза, являясь компонентами свертывающей и противосвертывающей систем; 7. участвуют в реакциях иммунитета (γ-глобулины, комплемент); 8. являются резервом аминокислот. Общий белок В норме общий белок крови 65-85 г/л. Общий белок – это сумма всех белковых веществ крови. ► Гипопротеинемия – снижение альбуминов. Причины: 1. дефицит аминокислот в организме (из-за нарушения поступления, низкобелковой диете, нарушении переваривания и всасывания); 2. усиление распада белков (голодание, повышение потребности в энергии и строительном материале при беременности и травме); 3. выведение белков из кровеносного русла: выход в ткани (экссудация, транссудация) либо из организма – выход в мочу при нарушении фильтрации почками; 4. нарушение белоксинтезирующей функции печени. ► Гиперпротеинемия может быть в двух вариантах: а) парапротеинемия – появление патологических белков; б) повышение за счет белковой фазы воспаления. Альбумины В норме 35-50 г/л. Гипоальбуминемия – причины см. выше (гипопротеинемия). При снижении альбуминов ниже 30 г/л возникают отеки. Гиперальбуминемия – при переливании альбуминов с лечебной целью и при сгущении крови (относительная гиперальбуминемия). Истинной не встречается. Глобулины в норме 20-30 г/л I. α1 -глобулины α-антитрипсин – ингибирует трипсин, пепсин, эластазу, некоторые другие протеазы крови. Выполняет антивоспалительную функцию крови. Повышенный уровень антитрипсина характерен для острой фазы воспаления, поэтому он называется белком острой фазы. α1-серомукоиды – гликопротеины сыворотки крови. Являются компонентами клеточных мембран и появляются в крови вследствие обновления кклеток. Обнаруживаются в печени в ответ на воспаление (в любом органе). Повышается содержание серомукоидов в ответ на воспаление и процессы распада (при деструктивных процессах). α1-фетопротеин – фетальный белок. В норме в больших количествах во внутриутробном периоде. Концентрация у взрослого человека не более 15мг/мл. Уровень фетопротеинов используется как маркерна уровне внутриутробного развития. Также используется как онкомаркер – маркер рака печени. В организме плода выполняет важные функции: заменяет альбумин, защищает от избытка материнского эстрогена, участвует в развитии печени. II. α2 -глобулины α-макроглобулин – защищает функционирующие белки от протеолитических ферментов. Это белки острой фазы воспаления. Их концентрация увеличивается при потере альбуминовой фракции с мочей, а также в острую фазу воспаления. Гаптоглобин – связывает и транспортирует свободный гемоглобин в клетки ретикулярной системы. Сберегает железо (Fe), обезвреживает гемоглобин. Снижается гаптоглобин при гемолизе, повышается – в острую фазу воспаления. Церрулоплазмин выполняет ряд функций: 1) транспортирует ионы меди (II) – связывает и удерживает Cu++ в кровеносном русле; 2) катализирует окисление Fe2+ в Fe3+; 3) обладает противовоспалительным действием; 4) является антиоксидантом – обезвреживает активные формы кислорода и ПОЛ (перекисное окисление липидов). Повышение церрулоплазмина – при остром воспалительном процессе, циррозе печени, заболеваниях печени воспалительного характера. Понижение – при нарушении его синтеза в печени (а также наследственные факторы). Болезнь Вильсона-Коновалова: церрулоплазмин не удерживается в крови, а выходит в ткани и с мочой, а также откладывается в прозрачных средах глаза. III. β-глобулины Трансферрин – белок, транспортирующий ионы Fe3+. Повышение трансферрина – при дефиците железа в организме. Понижение – при остром воспалительном процессе (!) или при нарушении функций печени. У пациентов с врожденной гипо- или атрансферринемией не удается вылечить анемию. Гемопексин – связывает и транспортирует гем в клетки ретикулоэндотелиальной системы. Повышение гемопексина – при гемолизе. Понижение – при остром воспалении. Фибриноген (норма 2-4 г/л) – компонент свертывающей системы крови. При формировании сгустка превращается в фибрин. Фибриноген содержится в плазме крови, а в сыворотке крови его нет. Гиперфибриногенемия – при острой фазе воспаления и тромботических заболеваниях. Гипофибриногенемия – при нарушении синтеза его в печени (развивается гипокоагуляция). С-реактивный белок – реагирует с С-полисахаридом пневмококка, реагирует с полисахаридами многих бактерий, клеточных стенок чужеродных клеток. Эта реакция необходима для фагоцитоза, следовательно, С-реактивный белок обладает противовоспалительным действием, способствует фагоцитозу, обеспечивает взаимодействие клеток иммунной системы. В норме содержится в количестве 5 мг/л. Повышение концентрации – при бактериальной инфекции и неинфекционных воспалениях – растет в тысячи раз, поэтому его называют маркером острого воспаления. IV. γ-глобулины (иммуноглобулины, антитела) Повышение титра иммуноглобулинов: Ig M – острый инфекционный процесс; Ig G – хронический воспалительный процесс и после острого заболевания; Ig A – секреторный иммуноглобулин поверхности слизистых оболочек; Ig E – антитела аллергии; Ig D – его функция неизвестна. Гипергаммаглобулинемия характеризует острый бактериальный воспалительный процесс или иммунопатологию. Обеспечивается плазматическими клетками. Гипогаммаглобулинемия характеризует подавление звена гуморального иммунитета (при лучевой болезни, иммунодефиците, истощении организма). Качественные изменения заключаются в появлении парапротеинов (продуктов аномального синтеза иммуноглобулинов), патологии клеток иммунной системы (их опухоли). Напр., криоглобулин (чувствительный к холоду) переходит в гель при температуре ниже 37ºС (это обратимый процесс). Он обуславливает холодовую аллергию.
Ферменты плазмы крови Классифицируются: 1. Функционирующие ферменты (собственно плазменные). Напр., ренин (повышает АД через ангиотензин II), холинестераза (расщепляет ацетилхолин). Их активность выше в плазме крови, чем в тканях. Повышение или понижение их активности имеет значение в диагностике. 2. Нефункционирующие ферменты (плазмонеспецифические). Появляются в плазме крови из клеток тканей и органов. В крови не выполняют какой-либо функции, а выполняют ее в тканях. Это внутриклеточные ферменты. Их активность в плазме значительно ниже, чем в тканях. Напр., АлАТ, АсАТ, ГГТП (гамма-
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 152; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.18.66 (0.276 с.) |