Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вторичная структура белка стабилизируется преимущественноСтр 1 из 4Следующая ⇒
Вторичная структура белка стабилизируется преимущественно А. пептидными связями Б. дисульфидными связями В. водородными связями Г. ионными связями Д. гидрофобными взаимодействиями Ионные связи в третичной структуре белка могут возникать между радикалами аминокислот А. аспарагин и глутамат Б. гистидин и аргинин В. глутамин и аспартат Г. глутамат и аспартат Д. аспартат и аргинин 6. Наличие цистеина в полипептидных цепях способствует образованию связей: А. ионных Б. гидрофобных В. пептидных Г. водородных Д. дисульфидных 7. Участок полипептидной цепи может принимать α-спиральную конформацию, если в его состав входит большое количество остатков аминокислот А. глутаминовой и аспарагиновой Б. лизина и аргинина В. пролина и глицина Г. аланина и лейцина Д. аспарагиновой кислоты и гистидина 8. Фрагмент полипептидной цепи: -про-лиз-гли-про-вал-гли-про-сер-гли- вероятнее всего принадлежит белку А. альбумину Б. гистону В. глобулину Г. кератину Д. коллагену 9. В кислой среде находится изоэлектрическая точка пептида: А. глу-мет-асп-фен-цис Б. лей-сер-про-гис-тир В. ала-три-вал-иле-про Г. тре-иле-лиз-арг-ала Д. вал-гли-сер-три-цис В пептиде с изоэлектрической точкой 7,8 произошла замена аминокислоты гистидин на аминокислоту триптофан. В результате изменения структуры пептида А. его растворимость в воде увеличилась Б. молекулярная масса пептида увеличилась В. суммарный электрический заряд молекулы увеличился Г. изоэлектрическая точка сместилась в щелочную сторону Д. гидрофобные свойства уменьшились 11. В электрическом поле при pH 7.0 к катоду движется пептид: А. иле-арг-про-сер-глу Б. асп-ала-три-глу-цис В. фен-асп-мет-тир-лиз Г. арг-гис-тре-сер-лиз Д. цис-про-вал-лей-три При проведении электрофореза в условиях, где рН буферного раствора выше, чем изоэлектрическая точка белка, последний А. остаётся на линии старта Б. движется к аноду В. движется к катоду Г. подвергается гидролизу Д. денатурирует Смесь пептидов разделяли методом ионообменной хроматографии на анионообменнике. При элюции в первой фракции будет содержаться пептид, обладающий А. наибольшим отрицательным зарядом Б. наименьшей гидрофильностью В. наибольшим положительным зарядом
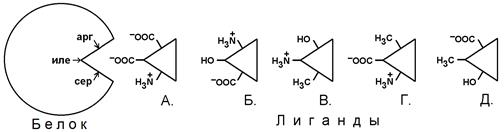
Г. наименьшим размером молекулы Д. наибольшей гидрофобностью Смесь пептидов разделяли методом ионообменной хроматографии на катионообменнике. При элюции в первой фракции будет содержаться пептид, обладающий А. наибольшим отрицательным зарядом Б. наименьшей гидрофобностью В. наибольшим положительным зарядом Г. наименьшим размером молекулы Д. наибольшей гидрофильностью Смесь пептидов разделяли методом обращенно-фазовой хроматографии на силикагеле с ковалентно связанными углеводородами. При элюции в первой фракции будет содержаться пептид А. наиболее гидрофобный Б. наиболее гидрофильный В. с наибольшей молекулярной массой Г. с наименьшим электрическим зарядом Д. с наименьшим размером молекулы На рисунке схематично изображено строение активного центра белка. С наибольшей вероятностью с активным центром будет взаимодействовать лиганд
17. Альбумин в организме выполняет функцию: А. каталитическую Б. рецепторную В. структурную Г. транспортную Д. сократительную В молекуле фосфопротеина фосфат соединяется сложноэфирной связью с радикалом аминокислоты А. глицин Б. метионин В. серин Г. триптофан Д. цистеин Атом железа простетической группы гемоглобина присоединяется координационными связями к радикалу аминокислоты А. аланин Б. глицин В. триптофан Г. гистидин Д. тирозин Пиррольные кольца простетической группы гемоглобина взаимодействуют с белковой частью молекулы при помощи А. пептидных связей Б. ионных связей В. сложноэфирных связей Г. гидрофобных взаимодействий Д. гликозидных связей 56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
Вторичная структура белка стабилизируется преимущественно А. пептидными связями Б. дисульфидными связями В. водородными связями Г. ионными связями Д. гидрофобными взаимодействиями
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 430; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.145.114 (0.023 с.) |