Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Принцип ионообменной хроматографии ⇐ ПредыдущаяСтр 10 из 10
Ионообменная хроматография позволяет разделить молекулы, основываясь на ионных взаимодействиях. Неподвижная фаза имеет заряженные функциональные группы, которые взаимодействуют с анализируемыми ионизированными молекулами противоположного заряда. Этот вариант хроматографии классифицируется на два типа — катионную и анионную ионообменную хроматографию: · Катионная ионообменная хроматография задерживает положительно заряженные катионы, так как неподвижная фаза имеет отрицательно заряженные функциональные группы, например, фосфат (PO43−). · Анионная ионообменная хроматография задерживает отрицательно заряженные анионы, так как неподвижная фаза имеет положительно заряженные функциональные группы, например, +N(R)4.
41. Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Один из типов распределительной хроматографии, как и адсорбционная, осуществляется на колонках, в которых в качестве стационарной фазы применяют влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку; разделяемые вещества, подвергающиеся многократному распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества в чистом виде. Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических лабораториях, в том числе клинических, для разделения пептидов, аминокислот и других веществ. В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол–уксусная кислота–вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
43. Аффинная хроматография, или хроматография по сродству. Это наиболее специфичный метод выделения индивидуальных белков, основанный на избирательном взаимодействии белков с лигандами, прикреплёнными (иммобилизированными) к твёрдому носителю. В качестве лиганда может быть использован субстрат или кофермент, если выделяют какой-либо фермент, антигены для выделения антител и т.д. Через колонку, заполненную иммобилизованным лигандом, пропускают раствор, содержащий смесь белков. К лиганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом. Белок, адсорбированный на колонке, можно снять, промыв её раствором с изменённым значением рН или изменённой ионной силой. В некоторых случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом. Аффинная хроматография отличается высокой избирательностью и помогает очистить выделяемый белок в тысячи раз.
44. Гель-фильтрация. Для выделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства. Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор". Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы. Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул.
45. Электрофорез белков. Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам. 46. До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
· по форме молекул (глобулярные или фибриллярные); · по молекулярной массе (низкомолекулярные, высокомолекулярные и др.); · по химическому строению (наличие или отсутствие небелковой части); · по выполняемым функциям (транспортные, защитные, структурные белки и др.); · по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.); · по локализации в организме (белки крови, печени, сердца и др.); · по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные); · по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами); · по схожим участкам первичной структуры и родственным функциям (семейства белков).
Одной из самых старых и распространенных классификаций белков является классификация по форме молекулы. Она делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
47. По химическому строению белки делят на простые и сложные. Белки, содержащие в своём составе только полипептидные цепи, состоящие из аминокислотных остатков, называют простые белки. Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд. Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют сложные белки. Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины.
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами. В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам. Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами. Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют " холопротеин ".
48. Альбумины и глобулины. Эти белки относятся к белкам, широко рас- пространенным в органах и тканях животных. Наиболее богаты ими белки сыворотки крови, молока, яичный белок, мышцы и др. В плазме крови человека в норме содержится около 7% белков, представленных преиму- щественно альбуминами и глобулинами. Альбумины и глобулины – это глобулярные белки, различающиеся по растворимости (табл. 1.6). Необходимо отметить, что само определение ≪альбумины≫ и ≪глобули- ны≫ основано на их растворимости в дистиллированной воде и полунасы- щенном растворе (NH4)2SO4. Альбумины и глобулины отличаются друг от друга также по молекулярной массе – соответственно 40000–70000 и 150000 дальтон и более. определена первичная структура его единственной полипептидной цепи (575 аминокислотных остатков). Альбумин имеет относительно низкую
изоэлектрическую точку (4,7) и высокий отрицательный заряд при рН 8,6, благодаря чему он мигрирует с большой скоростью в электрическом поле к аноду. Принято считать, что примерно 75–80% осмотического давления белков сыворотки крови приходится на альбумины; кроме того, основной функцией их считают транспорт жирных кислот. Однако точная функция альбуминов не совсем ясна. Известны случаи, когда у некоторых людей в крови фактически отсутствуют альбумины (врожденная аномалия), но они практически здоровы. Глобулины, представленные α1-фракцией, содержатся в крови в комп- лексе с билирубином и с липопротеинами высокой плотности. Глобулины, мигрирующие при электрофорезе в виде α2-фракции, содержат глобулин и неизвестный гликопротеин. β-Глобулины включают ряд важных в функ- циональном отношении белков, в частности трансферрин – белок, ответст- венный за транспорт железа. С этой же фракцией связан церулоплазмин – белок, транспортирующий ионы меди. Отсутствие этого белка приводит к развитию гепатоцеребральной дистрофии, при которой наблюдается отравление организма ионами свободной меди. В основе болезни лежит врожденный дефицит синтеза церулоплазмина. Наконец, во фракции β- глобулинов содержится протромбин, являющийся предшественником тром- бина – белка, ответственного за превращение фибриногена крови в фибрин при свертывании крови. Фракция γ-глобулинов является наиболее гетерогенной. Известно мно- жество антител, различающихся первичной структурой. Электрофоретиче- ски они открываются главным образом в γ-глобулиновой и частично в β2-глобулиновой фракциях. 49Протамины и гистоны, краткая характеристика. Протамины и гистоны. Данная группа белков отличается рядом характер- ных физико-химических свойств, своеобразием аминокислотного состава и представлена в основном белками с небольшой молекулярной массой. Протамины обладают выраженными основными свойствами, обусловлен- ными наличием в их составе от 60 до 85% аргинина. Так, сальмин, выделенный из молок семги, состоит на 85% из аргинина. Высоким содержанием аргинина отличается другой хорошо изученный белок – клу- пеин, выделенный из молок сельди: из 30 аминокислот в нем на долю аргинина приходится 21 остаток. Расшифрована первичная структура клу- пеина. Протамины хорошо растворимы в воде, изоэлектрическая точка их водных растворов находится в щелочной среде. По современным представ- лениям, протамины скорее всего являются пептидами, а не белками, поскольку их молекулярная масса не превышает 5000. Они составляют белковый компонент в структуре ряда сложных белков. Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20–30%. Молекулярная масса гистонов намного больше нижнего предела молекулярной массы белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играют важную роль
в регуляции экспрессии генов
50) Коллагеновые белки. Особенности аминокислотного состава, строения, пространственной организации и функций склеропротеинов Коллагеновый белок - белок животного происхождения. Это фибриллярный белок, составляющий основу соединительной ткани организма. Коллагеновый белок характеризуется высокой растворимостью, высокими водосвязывающей и водоудерживающей способностями. Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм. Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствиетриптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных треххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет. Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва». Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершествование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста ирегенерации, как они меняются во время эмбрионального развития и при патологии. Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл. Склеропротеины (от склеро... и протеины), альбуминоиды, протеиноиды, простые белки животного происхождения; нерастворимы в воде и разбавленных растворах солей, кислот и щелочей. Наиболее важные С. — коллаген, кератин и фиброин шёлка. Все С. имеют фибриллярную структуру. Находясь в организмах в твёрдом или пластическом состоянии, С. обеспечивают механическую прочность органов, защищают от воздействий внешней среды, а также образуют опорные сетчатые структуры внутри клеток и мембран, влияя на проницаемость последних. В природном состоянии С. (за исключением эластина) не подвергаются гидролизупротеолитическими ферментами и поэтому не имеют питательной ценности. К С. относятся также ретикулин, встречающийся в коже млекопитающих, белки биссуса и паутины, флагеллин (в жгутиках термофильных бактерий), конхиолин (в раковинах двустворчатых моллюсков), йодсодержащие спонгин (в морских губках), горгониниантипатин (в кораллах).
51.Сложные белки. Определение, классификация по простетической группе. Типы связей.
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизесложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада. В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества. В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы · Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции.. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса. · Липопротеиды, содержащие в качестве простетической части связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов. Они обеспечивают транспорт липидов в крови, являются компонентами биологических мембран. Связи между белковой частью молекулы и липидом — гидрофобные или ионные. · Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин итрансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов) Между белком и простетической группой образуются координационные связи. · Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом. Простетическая группа у таких белков — нуклеиновая кислота. Различают дезоксирибонуклеопротеины (простетическая группа — ДНК) и рибонуклеопротеины (простетичесая группа — РНК). Им принадлежит важная роль в хранении, передаче и реализации генетической информации. Между белком и молекулой нуклеиновой кислоты образуются ионные связи · Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока. Используются для регуляции процессов жизнедеятельности (фосфорилирование / дефосфорилирование). Между белком и остатком фосфорной кислоты формируются сложноэфирные связи, в образовании которых участвует OH-группа серина. · Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем —гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др. 52) Нуклеопротеины. Химический состав, локализация в клетке. Общая характеристика белковых и нуклеотидных компонентов
2 типа нуклеопротеинов: 1)дезоксирибонуклеопротеины (ДНП) 2)рибонуклеопротеины (РНП) k86 Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеино- вых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин ≪нуклеопротеины≫ связан с названием ядра клетки, однако ДНП и РНП содержатся и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразные состав, структуру и функции независимо от лока- лизации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в мито- хондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП. Пристальное внимание исследователей привлечено к структуре и функ- ции макромолекул, включающих комплексы белков и нуклеиновых кислот. Этот особый интерес вызван тем, что многообразие проявлений жизни непосредственно связано с этими полимерными молекулами. Биохимики имеют достаточно оснований для утверждения, что природа синтезирован- ных в клетках белков зависит в первую очередь от природы ДНП, точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков. ДНК хранит наследственную информацию. Подтверждением этого слу- жит явление трансформации, наблюдаемое у бактерий и открытое также в культуре клеток человека. Сущность явления заключается в превращении одного генетического типа клеток в другой путем изменения природы ДНК. Так, удалось получить штамм капсулированных и вирулентных пневмо- кокков из исходного штамма, не обладающего этими признаками, путем внесения в среду ДНК, выделенной из капсулированного (и вирулентного) штамма. С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны, кроме того, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др. У большинства клеток эукариот, когда ядро находится в интерфазе, из ДНК и белковых молекул образуются так называемые филаменты – нити, имеющие меняющуюся толщину (в среднем около 10 нм, реже 2 нм). Оказывается, что толщина филаментов определяется наличием или от- сутствием белков, окружающих двухспиральную структуру ДНК, а длина их – молекулярной массой ДНК. Известно, что одна хромосома содержит одну молекулу ДНК, имеющую длину несколько сантиметров. Вообще ДНП входит в состав мононуклеосом, являющихся составной частью хромосомы. Таким образом, в состав хроматина входят молекула ДНК, пять различных классов белков – гистонов и так называемые негистоновые белки. Количество ДНК в ядре составляет до 6 пг (10–12 г) на одну клетку у животных. У E.coli содержание ДНК равно 0,01 пг. Относительно белкового состава ДНП известно, что все 5 классов гистонов различаются по размерам, аминокислотному составу и величине заряда (всегда положительный). Так, выделяют гистоны, богатые лизином (H1), молекулярная масса которых составляет в среднем 20000, и богатые аргинином с мол. массой до 15000. Они обозначаются следующими символами: H1 – богатые лизином, Н2А – богатые аргинином и лизином, Н2В – умеренно богатые аргинином и лизином, Н3 – богатые аргинином, Н4 – богатые глицином и аргинином. Природа негистоновых белков пока не достаточно выяснена. Негисто- новые белки в настоящее время интенсивно изучаются. В их состав входят сложные белки, ферменты, а также регуляторные белки. По своим свойст- вам последние отличаются от гистонов и представлены кислыми белками. В различных нуклеопротеинах количество нуклеиновой кислоты колеблет- ся от 40 до 65% (например, в рибосомах про- и эукариот). В вирусных нуклеопротеинах количество нуклеиновых кислот не превышает 2–5% от общей массы. Так, у вируса табачной мозаики (ВТМ) на долю РНК *, прав- да, с огромной молекулярной массой – около 2000000, приходится всего около 2%. Остальная часть этой гигантской вирусной частицы приходится на долю однотипных белковых субъединиц (рис. 2.3). Ионная связь между РНК и белковыми молекулами ВТМ весьма непрочная и легко разрывается даже в ≪мягких≫ условиях, что позволяет отделить РНК от белка. Интерес- но, что после удаления разрывающего ионную связь агента при смешивании этих продуктов происходят полная регенерация исходного ВТМ, восстанов- ление всех его физических параметров и биологических свойств, включая способность поражать зеленый лист. Это явление самосборки, впервые открытое у ВТМ, в дальнейшем было обнаружено также у бактериофагов, представленных нуклеопротеинами. Акад. А.С. Спирин и одновременно М. Номура разделили 70S рибосомы (рибонуклеопротеины) на их состав- * Растительные вирусы чаще всего содержат РНК, а вирусы, поражающие клетки животных, содержат как РНК (вирус саркомы Рауса и др.), так и ДНК (вирус папилломы). Бактериофаги также содержат РНК или ДНК в комплексе с белками. ляющие и разработали условия для самосборки полноценных функционирующих рибосом. В основе этого удивительного явления самосборки лежит, по-видимому, программа, содержащаяся в первичной структуре как белка, так и нуклеиновой кислоты и определяющая, какое количество белковых молекул и в какой последовательности должно присоединиться к единственной молекуле РНК (в случае ВТМ) или к 3 молекулам РНК (в рибосомах), чтобы обеспечить высокую точность реконструкции надмо- лекулярных структур. В настоящее время и ядерный хроматин (ДНП), и рибосомы, и вирусные нуклеопротеиды обычно рассматривают именно как надмолекулярные комплексы или структуры, а отнесение этих образований в раздел Слож- ные белки≫ –в значительной степени дань традиции.
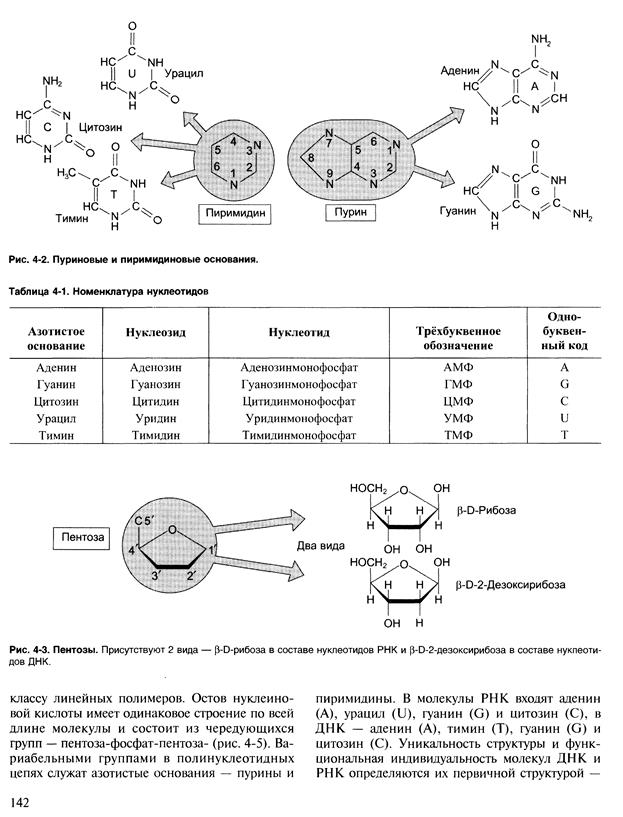
53) Типы нуклеиновых кислот. Химический состав мононуклеотидов ДНК и РНК. Молекулярная масса нуклеиновых кислот, локализация в клетке, функции. *Северин с 140-149*
54) Строение хромосом. Уровни компактизации ДНК в хромосомах.
нуклеопротеидные структуры в ядре эукариотической клетки, в которых сосредоточена большая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. Одна хромосома содержит одну молекулу ДНК, имеющую длину несколько сантиметров, также гистоновых белков.
Молекула каждой хромосомы очень длинная, поэтому для компактности она плотно намотанная на специфические белки-гистоны. Это явление называется суперскручивание или суперкомпактизация. Уровни компактизации ДНК: из лекций Могильной 1) Двойная спираль ДНК. Диаметром 2 нм, длиной 190 см. 2) Нуклеосома – нить, глобула, состоящая из 8 белковый молекул. Имеет вид бус на нати. Нить- ДНК, бусы –белки. Вокруг глобулы располагаются намотанная ДНК из 140 нуклеотидных пар. Толщина 11 нм 3) Хроматиновая нить. «Хроматиновая фибрилла». Д=30нм 4) Формирование петельных доменов толщиной. «Вытянутые петли». Толщина 300нм 5) Суперспирализация хромомеры в составе петельного дОмена. «Компактные петли» Толщина 700 нм 6) Конденсация хроматиновых нитей. Формировние розеток (глыбок хроматина) и прикрепление хроматиновых нитей к белкам ядерного матрикса. «Метафазная хромосома» Толщина нити 1400 нм
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.17.45 (0.158 с.) |