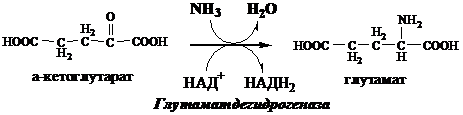Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов (см. раздел 8) (см. схему Б). Синтез карнитина Карнитин - переносчик жирных кислот через мембрану митохондрий (см. раздел 8) (см. схему А на с. 501). Синтез креатина Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы (см. схему Б на с. 501). Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования (см. схему В на с. 501).
Схема А
Схема Б
Схема А
Схема Б
Схема В Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. (см. схему А на с. 502). Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы (см. раздел 2). Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе (см. схему Б на с. 502). Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в
Схема A
Схема Б крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др. Реакции трансметилирования используются также для: · синтеза адреналина из норадреналина; · синтеза анзерина из карнозина; · метилирования азотистых оснований в нук-леотидах и др. (см. раздел 10);
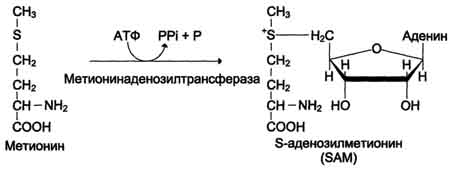
· инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты (см. подразд. IX, раздел 12). Регенерация метионина Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). В связи с этим большое значение приобретает возможность регенерации метионина с участием заменимых аминокислот (Сер, Гли). В результате отщепления метильной группы SAM превращается в S-аденозилгомоцистеин (SAT), который при действии гидролазы расщепляется на аденозин и гомоцистеин. S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин Гомоцистеин может снова превращаться в ме тионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом слу чае служит N5-метил-Н4-фолат:
Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента. Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метиони-не и гомоцистеине обеспечиваются только мети-онином пиши. Общая схема метаболизма метионина, связанная с обменом одноуглеродных фрагментов, представлена на рис. 9-27. Первичным донором одноуглеродныхкфраг-ментов является серии. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-метил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин может использоваться также для синтеза цистеина.
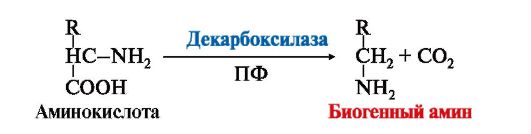
Рис. 9-27. Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 - регенерация метионина. №17. Обезвреживание биогенных аминов. Роль моноаминооксидаз, общий вид реакций, кофактор. Метилирование катехоламинов. 1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая является основным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО) (рис. 9.25).
ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга. 3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:
4. Серотонин - нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В). Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов
• метилирование с участием SAM под действием метилтрансфераз - характерно для гистамина, адреналина, норадреналина:
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:
№ 18. Токсичность аммиака, его образование и обезвреживание. В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза. Обмен глутамата В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис. Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки. В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:
Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе. В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений. Обмен аспарагина Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Обмен аланина Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина. В кишечнике:
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью. В мышцах: Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы. Этот процесс называется глюкозо-аланиновый цикл:
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК. № 19. Транспорт аммиака в печень и почки. Синтез глутамина, Распад глутамина. Роль глутамина в метаболизме клетки. В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
Рис. 9-11. Метаболизм амидного азота глутамина в почках. нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
Рис. 9-12. Пути использования глутамина в организме. Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина. Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины. В мозге и некоторых других органах может протекать восстановительное аминирование α -кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже). Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы. Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
Схема глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13). Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7). Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеиаза и глутаминсинтетаза. № 20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса. Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота (рис. 9-15). Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина). В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта". Реакции синтеза мочевины Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником
одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием
Рис. 9-13. Глюкозо-аланиновый цикл.
Рис. 9-14. Обмен аммиака. Основной источник аммиака - аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.
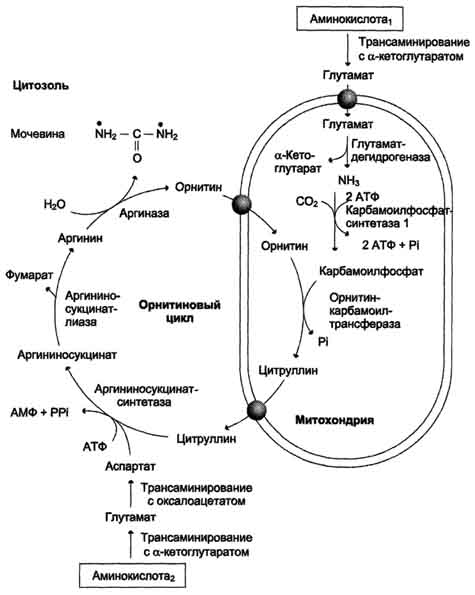
Рис. 9-15. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании. карбамоилфосфата под действием карбамоилфосфатсинтетазы I (см. схему А ниже). Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота - цитруллин (см. схему Б на с. 483). В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины (см. схему А на с. 483).
Схема А
Схема Б
Схема А Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина (см. схему Б ниже). Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения (рис. 9-16). Суммарное уравнение синтеза мочевины: СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень с кровью ворот-вены. Роль других источников, в том числе гсительного дезаминирования глутаминовой эты в печени, существенно меньше. Аспартат, необходимый для синтеза аргининокцината, образуется в печени путём трансаминирования
Схема Б
Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля. аланина с оксалоацетатом. Алании поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат (рис. 9-17). Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пиру ват, образующийся в этом цикле из аланина, используется для глюконеогенеза. Ещё одним источником аспартата для орнитинового цикла является Трансаминирование глутамата с оксалоацетатом.
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 837; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.244 (0.082 с.) |








 Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).
Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин). Рис. 9.25. Схема синтеза и инактивации ГАМК
Рис. 9.25. Схема синтеза и инактивации ГАМК Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость. Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.
Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках. 6. Инактивация биогенных аминов происходит двумя путями:
6. Инактивация биогенных аминов происходит двумя путями: окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.