
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В. Защита клеток от действия протеазСтр 1 из 10Следующая ⇒
Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: · эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены. · в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены. №4. Всасывание продуктов переваривания в кишечнике. γ-глутамильный цикл в гепатоцитах, его биологическое значение. Медицинское значение определения γ-глутамилтранспептидазы в крови. Конечным результатом переваривания белков является образование свободных аминокислот, поступающих в клетки слизистой оболочки кишечника, путем вторично-активного транспорта за счет градиента концентрации натрия (симпорт). Всасывание L-аминокислот является активным, требующим затраты энергии процессом. Транспорт их осуществляется двумя путями: • через воротную систему печени; • по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Аминокислоты конкурируют друг с другом за специфические участки связывания белков-переносчиков. Так, всасывание лейцина в больших количествах уменьшает всасывание изолейцина и валина. В крови максимальная концентрация аминокислот достигается через 30-50 минут после приема белковой пищи. Свободные аминокислоты, в отличие от белков пищи, лишены видовой специфичности и не обладают антигенными свойствами. Скорость проникновения аминокислот через мембраны клеток различается, что указывает на существование транспортных систем, обеспечивающих перенос аминокислот через мембраны. Известно пять специфических транспортных систем для переноса определенной группы близких по строению аминокислот:
• нейтральных с короткой боковой цепью (аланин, серин, треонин); • нейтральных с длинной или разветвленной боковой цепью (валин, лейцин, изолейцин); • с катионными радикалами (лизин, аргинин); • с анионными радикалами (глутаминовая и аспарагиновая кислоты); • иминокислот (пролин, оксипролин). Переносчики аминокислот первой и пятой групп, а также переносчик метионина относятся к числу Na+-зависимых. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Одной из основных транспортных систем для нейтральных аминокислот является γ-глутамильный цикл, который функционирует в почках, поджелудочной железе, печени и селезенке, в мозге и других тканях он содержится в очень небольших количествах (рис. 9.3).
Е1 - γ-глутамилтранспептидаза (γ-ГТ); Е2 - γ-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием фермента γ-ГТ. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты Ключевую роль в работе системы играет мембранный фермент γ -глутамилтранспептидаза (γ-ГТ). Этот гликопротеин катализирует перенос γ-глутамильной группы с глутатиона (γ -глутамилцистеинилглицин) или другого γ-глутамильного пептида на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион содержится во всех тканях животных. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачивается три молекулы АТР. γ-ГТ в больших количествах содержится в почках, поджелудочной железе, печени и других тканях. Активность фермента в сыворотке крови в норме составляет 30-50 МЕ/л (мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для женщин. Определение активности γ-ГТ в сыворотке крови используется для диагностики заболеваний печени и сердца. γ-ГТ-тест используется также в качестве маркера рака поджелудочной железы, печени, предстательной железы и для обнаружения людей из группы раннего риска алкоголизма, для контроля за лечением хронического алкоголизма.
№ 6. Биосинтез заменимых аминокислот. Из 12 заменимых аминокислот (табл. 29.1) 9 образуются из амфиболических метаболитов, а три Центральное место в биосинтезе аминокислот занимают глутаматдегидрогеназа, глутаминсинтаза и трансаминазы. Благодаря совместному действию этих ферментов катализируется включение неорганического иона аммония в а-аминогруппу аминокислот. Глутамат Восстановительное аминирование а-кетоглутарата катализируется глутаматдегидрогеназой (рис. 29.1). Помимо того что эта реакция приводит к образованию L-глутамата из амфиболического метаболита, а-кетоглутарата, она является ключевой стадией биосинтеза многих других аминокислот. Глутамин Биосинтез глутамина из глутамата катализируется глутаминсинтетазой (рис. 29.2). Данная реакция имеет как сходство с реакцией, катализируемой
Рис. 29.1. Реакция, катализируемая глутаматдегидрогеназой. Восстановительное аминирование а-кетоглутарата ионами NH происходит за счет
Рис. 29.2. Реакция, катализируемая глутаминсинтетазой.
Рис. 29.3. Образование аланина путем переаминировання пирувата. Донором аминогруппы может быть глутамат или аспартат. Другим продуктом реакции служит а-кетоглутарат или оксалоацетат. глутаматдегидрогеназой, так и отличия от нее. В обоих случаях «фиксируется» неорганический азот, который в одном Случае включается в аминогруппу, а в другом — в амидную группу. Обе реакции сопряжены с сильно экзергоническими реакциями: в случае глутаматдегидрогеназы с окислением Аланин и аспартат L-аланин образуется из пирувата путем переами-нирования с глутаматом, а Аспарагин Образование аспарагина из аспартата, катализируемое аспарагинсинтетазой (рис. 29.4), сходно с синтезом глутамина (рис. 29.2). Аспарагинсинтетаза млекопитающих в качестве источника азота использует не ион аммония, а глутамин и, следовательно, не «фиксирует» неорганического азота. Бактериальные же аспарагинсинтетазы используют ион аммония, следовательно, «фиксируют» неорганический азот. Как и в случае других реакций, сопровождающихся образованием Серин Серин образуется из гликолитического промежуточного продукта D-3-фосфоглицерата (рис. 29.5). а-гидроксильная группа при участии NAD+ окисляется в оксогруппу; далее в результате переаминирования образуется фосфосерин, который затем дефосфорилируется, образуя серин.
Глицин Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин (рис. 29.6) и серин; в последнем случае катализ осуществляется серингидроксиметилтрансферазой (рис. 29.7). Пролин У млекопитающих и некоторых других организмов пролин образуется из глутамата путем обращения реакций катаболизма пролина (рис. 29.8). Гидроксипролин Поскольку пролин служит предшественником гидроксипролина, то обе аминокислоты рассматривают как принадлежащие к глутаматному семейству аминокислот. Хотя в тканях млекопитающих встречаются как 3-, так и 4-гидроксипролин, в последующем изложении - речь будет идти исключительно о
Рис. 29.4. Реакция, катализируемая аспарагинсинтетазой. Обратите внимание на сходство и различия с реакцией, катализируемой глутаминсинтетазой (рис. 29.2). Природа донора аминогруппы
Рис. 29.5. Биосинтез серина. а-АК—а-аминокислота, а-КК—а-кетокислота. Гидроксипролин, как и гидроксилизин, содержится в тканях практически только в составе коллагена, на долю которого приходится большая часть белка в организме млекопитающих. В коллагене одна треть аминокислотных остатков приходится на глицин и еще одна треть на пролин и гидроксипролин. Гидроксипролин, представленный в коллагене весьма большим числом остатков, стабилизирует тройную спираль коллагена по отношению к действию протеаз. В отличие от гидроксилизина, гидроксильная группа которого служит местом присоединения остатков галактозы и глюкозы, гидроксильные группы гидроксипролина в коллагене остаются незамещенными. Уникальной особенностью метаболизма гидроксипролина и гидроксилизина является то обстоятельство, что эти аминокислоты, входящие в состав
Рис. 29.6. Образование глицина из холина.
Рис. 29.7. Реакция, катализируемая серингидрокси-метилтрансферазой. Реакция легко обратима. белков пищи, не включаются в коллаген. Не существует
Рис. 29.8. Биосинтез пролина из глутамата путем обращения реакций катаболизма пролина. Гидроксилирование пролина (или лизина) катализируется пролилгидроксилазой (или лизилгидроксилазой) - ферментами, находящимися в микросомальной фракции многих тканей (кожи, печени, легких, сердца, скелетной мышцы, гранулирующих раневых поверхностей). Эти ферменты являются пептидилгид-роксилазами, поскольку гидроксилирование происходит только после включения пролина или лизина в полипептидную цепь (см. гл. 55). Обе гидроксилазы являются оксигеназами со смешанной функцией и функционируют при участии молекулярного кислорода, аскорбата, ионов
Рис. 29.9. Реакция, катализируемая пролилгидроксилазой. Субстратом служит богатый пролином пептид. В результате реакции один атом молекулярного кислорода поступает в сукцинат, а другой — в пролин (установлено с использованием Цистеин Цистеин, не относящийся к незаменимым аминокислотам, образуется из незаменимого метионина и заменимого серина. Сначала происходит превращение метионина в гомоцистеин с образованием на промежуточных стадиях Тирозин Тирозин образуется из фенилаланина в реакции, катализируемой фенилаланингидроксилазой (рис. 29.11), поэтому фенилаланин относится к незаменимым аминокислотам, а тирозиннет (при условии, что диета содержит достаточное количество фенилаланина). Реакция необратима, и поэтому тирозин не может заменить пищевой фенилаланин. Фенилала-нингидрокснлазный комплекс является оксигеназой со смешанной функцией, она имеется в печени млекопитающих и отсутствует в других тканях. В результате
Рис. 29.10. Превращение гомоцистеина и серина в гомосе-рин и цистеин. Атом серы поступает в цистеин от метионина, углеродный скелет — от серина. реакции один атом молекулярного кислорода включается в пара-положение фенилаланина, а другой восстанавливается, образуя воду (рис. 29.11). Восстановительные эквиваленты, первоначально поставляемые NADPH, затем передаются непосредственно участвующему в реакции тетрагидробиоптерину—птеридину, подобному по структуре фрагменту фолиевой кислоты. Гидроксилизин 5-Гидроксилизин (а, е-диамино-8-гидроксикапроат) входит в состав коллагена и отсутствует в большинстве других белков млекопитающих. Г идроксилизин в составе коллагена происходит из пищевого лизина, но не пищевого гидроксилизина. Перед гидроксилированием лизин должен включиться в пептидную цепь. Гидроксилирование остатка лизина в составе пептида катализируется лизилгидроксила-зой—оксигеназой со смешанной функцией, аналогичной пролилгидроксилазе (рис. 29.9).
Рис. 29.11. Реакция, катализируемая фенилаланин-гидроксил азой. Она осуществляется с участием двух типов активности. Активность II катализирует восстановление дигидробиоптерина за счет NADPH, активность I— восстановление 7. Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот (пример). Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α -кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в
Рис. 9-22. Включение безазотистого остатка аминокислот в общий путь катаболизма. процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными Анаплеротические реакции – это реакции клеточного метаболизма, повышающие кон центрацию субстратов ЦТК, образуя их в других метаболических путях. Например: 1.Образование α кетоглутарата и оксалоацетата в реакциях трансаминирования аминокислот; Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке 9-22 выделены пять анаплеротических реакций: 1. Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах. 2. Аминокислоты → Глутамат → α-Кетоглутарат Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз. 3. Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8). 4. Аминокислоты → Фумарат 5. Аминокислоты → Оксалоацетат Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции. № 8. Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярное, восстановительное). Схемы реакций, биороль. Существует несколько способов дезаминирования аминокислот: · окислительное; · непрямое (трансдезаминирование); · неокислительное; · внутримолекулярное.
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 706; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.27.232 (0.047 с.) |
 Рис. 9.3. γ-Глутамильный цикл:
Рис. 9.3. γ-Глутамильный цикл: незаменимых аминокислот.
незаменимых аминокислот.



 а в случае глутаминсинтетазы с гидролизом АТР.
а в случае глутаминсинтетазы с гидролизом АТР. -аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот.
-аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот. последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.
последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.

 может различаться у разных организмов.
может различаться у разных организмов.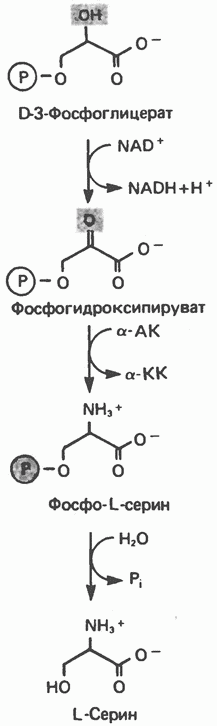


 фолат— тетрагидрофолат.
фолат— тетрагидрофолат. которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.
которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.
 и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый моль гидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы
и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый моль гидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы  включается в состав пролина, а другой — в сукцинат (рис. 29.9).
включается в состав пролина, а другой — в сукцинат (рис. 29.9).
 ).
). -аденозилметионина и
-аденозилметионина и  -аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.
-аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.

 в
в  и превращение фенилаланина в тирозин.
и превращение фенилаланина в тирозин.





