Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема обмена г-6-ф в организме. Гормональная регуляция обмена глюкозы.Стр 1 из 5Следующая ⇒
Схема обмена Г-6-Ф в организме. Гормональная регуляция обмена глюкозы. Все метаболические пути глюкозы находятся под влиянием инсулина, то есть инсулинзависимы. Инсулин повышает проницаемость тканей для глюкозы. Все ткани, кроме печени и головного мозга, инсулинзависимы, следовательно концентрация глюкозы в этих органах будет зависить от концентрации глюкозы в крови. При извлечении инсулина все 5 путей метаболизма будут нарушены.
Строение гликогена. Синтез и фосфоролиз гликогена. Гликоген – большая ветвистая молекула с молекулярной массой 106-107 Дальтон. Линейные участки молекулы гликогена связаны α(1→4) связью, точки ветвления представлены α(1→6) гликозидной связью. Синтез: Глюкоза+АТФàГ-6-Ф + АДФ (гексогеназа) à Г-1-Ф à УДФ-глюкоза à (глюкоген)n+1 Глюкогенолиз - активируется стрессом. (гормоны-адренолин и глюкагон) Фосфоролиз: (глюкоген)n+1à(глюкоген)n-1+Г-1-Ф (гликогенфосфорилаза) à Г-6-Ф (фосфоглюкомутаза) à Глюкоза + H3PO4 (фосфатаза глюкозо-6 фосфат) Гормональная регуляция метаболизма гликогена. Роль цАМФ, ионов Са в регуляции гликогенеза и гликогенолиза. В регуляции синтеза гликогена ключевую роль играет гликогенсинтаза. Фермент находится в клетке в неактивном, фосфорилированном, состоянии и называется гликогенсинтаза D, т.е. активность его зависит от глюкозо-6-фосфата (аллостерический активатор) и гормона инсулина. Инсулин активирует фермент фосфатазу, который и превращает гликогенсинтазу D в активную форму – гликогенсинтазу I. Адреналин и глюкагон, активируя аденилатциклазу, способствуют образованию цАМФ, который запускает «каскадный механизм» фосфорилирования ферментов распада и синтеза гликогена. В результате фосфорилирования образуется активная, гликогенфосфорилаза и неактивная гликогенсинтаза. В этих условиях будет осуществляться распад гликогена. Напротив, под действием инсулина, включающего механизм дефосфорилирования ключевых ферментов, появятся неактивная гликогенфосфорилаза, и активная, гликогенсинтаза. В этих условиях будет происходить синтез гликогена. Активность обоих обоих ключевых ферментов синтеза и распада гликогена в печени регулируется также Са++ – выход кальция из внутриклеточных депо в цитозоль клетки контролируется инозитолтрифосфатом (ИТФ), который освобождается фосфолипазой С при распаде входящего в состав мембраны фосфатидилинозитол пирофосфата.
Кинетическое различие в действии глюкокиназы и гексокиназы. Гексагеназа: *высокое сродство к глюкозе Кm > 0.1нм *высокая специфичность *локализация: печень, поджелудочная железа. * регулирует процесс гликолиза Гексакиназа: *низкое сродство к глюкозе Km= 10нм *низкая спецефичность *не ингибирует Г6Ф и относ АТФ/АДФ
Метаболизм галактозыи фруктозы в норме и при патологии Норма (фруктоза): Альдегид
Гликолиз ГНГ глицерин Галактокиназа
Гл-6-Ф
Гликоген клюкоза гликолиз Крови Галактоземия, вызвана недостаточностью галактозо-1-фосфатуридилтрансферазы (ГАЛТ). Это заболевание проявляется очень рано, и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Гликолиз даёт большое кол-во энергии для обеспечения функций в анаэробных условиях. В 1ой стадии затрачивается 2 молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). Во второй стадии образ 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная р-ии). Т.е. энергетич эффективность гликолиза сост 2 молеклы АТФ на 1 молекулу глюкозы. Биологич роль гликолиза: Промежуточный продукт гликолиза в эритроцитах – 2,3-дифосфоглицерат (2,3-ДФГ) – понижает сродство гемоглобина к кислороду. При недостаточности пируваткиназы сод-ние 2,3-ДФГ вдвое превышает норму, что обусловливает низкое сродство гемоглобина к кислороду. При недостаточности гексокиназы наблюдается понижение уровня 2,3-ДФГ и ненормально высокое сродство гемоглобина к кислороду. К киназным реакциям относятся: фосфоглицераткиназная и пируваткиназная. Но кроме этих 2х сущ ещё две киназные реакции, но в них АТФ не образуется, а расходуется: гексокиназная и фосфофруктокиназная. Киназные реакции гликолиза являются фосфотрансферазными, то есть осуществляется перенос макроэргического фосфата с субстрата на АДФ в фосфоглицераткиназной и пируваткиназной реакциях и с АТФ на субстрат в гексокиназной и фосфофруктокиназной.
РЕГУЛЯЦИЯ ГЛИКОЛИЗА Различают местную и общую регуляцию. Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки. Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм. Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза. Инсулин стимулирует гликолиз через: активацию гексокиназной реакции; стимуляцию фосфофруктокиназы; стимуляцию пируваткиназы. на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами. Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1), фосфофруктокиназой (3) и пируваткиназой (10) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза. Цикл трикарбоновых кислот – универсальный компонент биологического окисления, который базируется на принципе унификации. Унификация позволяет уравновешивать и оптимизировать соотношение основных субстратов, то есть если имеется избыток углеводов, то часть их перекачивается в липиды, если белка – то тоже в липиды или углеводы. Функции цикла Кребса:1) Энергетическая (цикл Кребса – конечный этап биологического окисления, в котором окисляется унифицированные соединения различного происхождения.2) Пластическая (поскольку цикл «питается» субстратами различного происхождения, то он может быть источником углеродных скелетов для различных веществ) 3) Регуляторная. 17. ЦТК,ферменты,коферменты,витамины,регаляция. Первым регуляторным фактором является концентрация ЩУК, которая в основном образуется из ПВК. ПВК же образуется из углеводов (глюкозы), поэтому при диабете или углеводном голодании наблюдается недостаток ПВК, а значит и ЩУК и сам цикл блокируется. АцетилКоА не является лимитирующим субстратом, так как в основном образуется при окислении жирных кислот. Но в то же время ЩУК – конкурентный ингибитор сукцинатдегидрогеназы, поэтому при избытке ЩУК цикл трикарбоновых кислот блокируется на 6 – ой стадии. Это торможение можно убрать глутамином, который переаминирует ЩУК в аспарагин. Второй регуляторный центр – концентрация НАД и НАД * Н2. В живых системах концентрация НАД и Над * Н2 = const. Любые факторы, ведущие к увеличению НАД * Н2 (алкогольная интоксикация) и дефекту НАД блокируют цикл Кребса. Следовательно, увеличение концентрации НАД стимулирует цикл трикарбоновых кислот. Так как АТФ является косвенно конечным продуктом, то её избыток блокирует реакции, а значит АДФ стимулирует цикл (АДФ рассматривается как аллостерический активатор изоцитратдегидрогеназы). Стимулятором Цикла является также и кислород, так как стимулирует работу АТФ. При повышении концентрации Са в клетке активируются дегидрогеназные реакции. Цикл Кребса активируется при сердечной недостаточности. Это объясняется тем, что миокард не может самостоятельно убрать избыток Са и эту роль берут на себя митохондрии, возрастает потребность в кислороде
18. Спиртовое брожение.Реакции.Сходство и отличие от гликолиза. Н SКоА Н | | СН3 – С = О + Н2N – R ----à СН2 – О = N –R - Н2О Метаболические последствия этанольной интоксикации. Этанол монополизирует основной фонд НАД, переводя его в НАД*Н. Это приводит к блокированию первого комплекса дыхательной цепи и клетки, чтобы не погибнуть от гипоксии вынуждены переключиться на ФАД – зависимое окисление. Введение этанола приводит к сдвигам в нервной системе, которые обусловлены образованием продуктов конденсации СН3СОН с биогенными аминами. При приёме этанола повышается активность каталазы, которая провоцирует перекисные процессы, в результате развивается патология печени, сердца, нервной системы. Введение этанола создаёт экстремальную ситуацию, которая сопровождается выбросом адреналина, а значит и активацией липолиза и повышения содержания жирных кислот, которые поступают в печень. Жирные кислоты должны окисляться под действием НАД – зависимых дегидрогеназ, но эти реакции блокируются и получается, что печень просто не успевает их утилизировать и жирные кислоты накапливаются в печени. Второй причиной является образование ацетил – КоА из этанола, который тоже идётна II - НЕОКИСЛИТЕЛЬНЫЙ ЭТАП. Совокупность большого количества обратимых реакций. Каждая из них - это перенос 2-х или 3-х углеродного фрагмента с одного моносахарида на другой. Между моносахаридами происходит взаимный обмен частями своих молекул. При этом из пентозофосфатов, вступающих в реакцию, образуются моносахариды с разным числом углеродных атомов. Это триозы (например, фосфоглицериновый альдегид (ФГА)), тетрозы, гексозы, гептозы (их формулы знать необязательно, но нужно знать схему реакций. Реакции неокислительного этапа катализируются ферментами трансальдолазами и транскетолазами. В состав кофермента транскетолаз входит витамин В1 (тиамин). Цикл кюри и фелига Между гликолизом, протекающим в мышцах при их интенсивной работе, и глюконеогенезом, осуществляемым печенью, существует тесная взаимосвязь (цикл Кори): образующая в мышцах молочная кислота поступает в общий кровоток, захватывается печенью и используется ею в качестве субстрата глюконеогенеза; синтезируемая при этом глюкоза отдаётся в кровототок и метаболизируется мышцами для получения энергии.
Цикл Кори:
Цикл Фелига: Вместо лактата – аланин: в мышцах ПВК + NH2=аланин В печени:аланин – NH2= ПВК Гипогликемия связана с понижением тех эндокинных желез,повышение функций которых приводит к гипергликемии..Также может возникнуть при введении больным сахарным диабетом больших доз инсулина, при этом гипогликемия сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы. При нормальном уровне глюкозы в крови почки полностью её реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9-10 ммоль/л (почечный порог), то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии. В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета. Срочный (через ЦНС) Уровень глюкозы в крови является одним из гомеостатических параметров. Регуляция уровня глюкозы в крови – это сложный комплекс механизмов, обеспечивающий постоянство энергетического гомеостаза для наиболее жизненно важных органов (мозг, эритроциты). Глюкоза – главный и едва не единственный субстрат энергетического обмена. Постоянный (через гормональное влияние): в основе которого лежит глюконеогенез. После истощения запасов гликогена, возбуждённая кора продолжает посылать импульсы в гипоталамус. Отсюда выделяются либерины, которые с током крови заносятся переднюю долю гипофиза, которая, в свою очередь, синтезирует в кровоток СТГ, АКТГ, ТТГ, которые в свою очередь стимулируют выброс трийодтиронина и тиреотропина. Эти гормоны стимулируют липолиз. Тиреотропные гормоны активируют протеолиз, в результате чего образуются свободные аминокислоты, которые как и продукты липолиза используются как субстраты глюконеогенеза и цикла трикарбоновых кислот. В ответ на повышение уровня глюкозы в крови, происходит выброс инсулина, однако вследствие того, что жирные кислоты и выделяемые гормоны выключают гликолиз в мышечной ткани, потребление глюкозы мышцами не происходит, вся глюкоза сохраняется для мозга и эритроцитов. При дефиците инсулина все пути метаболизма глюкозы блокируются, так как возникает недостаточность глюкозы – 6 – фосфат. Дефицит инсулина снижает метаболизм глюкозы и аминокислот в тканях, это снимает инсулиновый тормоз с катаболических реакций: активизируется липолиз, протеолиз, гликогенолиз. Из – за дефицита глюкоза – 6 – фосфата в мышечной ткани нарушается производство АТФ и ткань находится в состоянии энергетического голода. Это состояние расценивается организмом как снижение уровня глюкозы в крови.
Кетонемия-повышение содержания кетоновых тел в крови до 20 ммоль/л.Кетонемия сопровождается резким увеличением кетоновых тел в моче- кетонурия.Явление кетонурии и кетонемии объясняется следующим образом. И диабет, и голодание сопровождаются резким сокращением запасов гликогена в печени. Многие ткани и органы, в частности мышечная ткань, находятся в состоянии энергетического голода (при недостатке инсулина глюкоза не может с достаточной скоростью поступать в клетку). В этой ситуации благодаря возбуждению метаболических центров в ЦНС импульсами с хе- морецепторов клеток, испытывающих энергетический голод, резко усиливаются липолиз и мобилизация большого количества жирных кислот из жировых депо в печень. В печени происходит интенсивное образование кетоновых тел. Образующиеся в необычно большом количестве кетоновые тела с током крови транспортируются из печени к периферическим тканям. Периферические ткани при диабете и голодании сохраняют способность использовать кетоновые тела в качестве энергетического материала, однако ввиду необычно высокой концентрации кетоновых тел в притекающей крови мышцы и другие органы не справляются с их окислением и как следствие возникает кетонемия. Диагностика СД: Концентрация ГЛ больше 7. 2 ммоль/л указывает на СД. И нет необходимости проводить тест толерантности к глюкозе. Наличие гликозилированного Нb. При СД его концентрация увеличивается в 2-3 раза. Инс и С-пептид секретируются бета- клетками в эквимолярных количествах. В печени задерживается около 60% ИНс, поступающего с кровью воротной вены из поджелуд. железы. Поэтому отношение С-петид/ Инс в воротной вене и периф. кровообращении при н.ус. равно примерно—3/1. С-пептид удаляется обычно через почки его суточная секреция-45 мкг и пропорц. суточной секреции ИНС. Альбуминурия.- ранний признак СД. В норме с мочой-выводится в среднем 8мг А. При выделении 30-300мг, микроальбуминурия. Гликогеновын болезни Гликогенозы Агликогенозы Й тип-б-знь Помпе-отсутствие лизосомальной глюкозидазы.при этом-генерализованное поражение органов. 3-й тип:б-знь Форбса-дефект деветвящегося фермента.Накопление полисахарида 4-й тип:б-знь Андерсена-дефект фермента ветвления-лет.исход в 1-й год жизни от недостаточности 5-й тип:б-знь Мак-Ардла-недостаточность мышечной фосфорилазы 6-й тип:б-знь Херса-недостаточность фофсфорилазы в печени-развивается гепатомегалия. 34. И чужеродные вещ-ва легко 35. Существует особый вид соединений –это белково-углеводные комплексы. Различают: 1)протеогликаны (свыше 95 %углеводов) 2)гликопротеины (до 10% углвеводов) ПГ-белковые комплексы,в кот. С молекулами белка ковалентно связаны гликозамингликаны. Ф-ии ПГ: Входит в состав везикул Ф-ии гликопротеинов: 36. Гликозамингликаны-полисахариды.Их цепи подвижны и не могут образовывать глобулы.Из-за гидрофильности занимают большие объёмы,образуя гели и создавая тургор тканей. Содержит сульфатированные сахара,имеет тенденцию состоять из разных дисахаридных единиц,синтезируются внутриклеточно и покидают клетку путём экзоцитоза; сахара ковалентно связаны с белками в форме ПГ 37. Мукополисахаридозы - группа наследственных болезней соединит. ткани, обусловленных нарушением обмена гликозаминогликанов в результате генетически обусловленной неполноценности ферментов, участвующих в их расщеплении. Наследуется по аутосомно-рецессивному типу. При этом поражается система лизосомных ферментов, участвующих в катаболизме гликозаминогликанов. Вследствие ферментативной недостаточности последние накапливаются в большом количестве в органах и тканях, поэтому мукополисахаридозы относят к болезням накопления. В результате нарушается функциональное состояние различных органов и систем, а поскольку гликозаминогликаны входят в состав соединительной ткани, то одним из ведущих проявлений мукополисахаридоза является системное поражение скелета, задержка физического развития. По современной классификации, в зависимости от характера ферментативного дефекта выделяют восемь осн. типов мукополисахаридозов. Схема обмена Г-6-Ф в организме. Гормональная регуляция обмена глюкозы. Все метаболические пути глюкозы находятся под влиянием инсулина, то есть инсулинзависимы. Инсулин повышает проницаемость тканей для глюкозы. Все ткани, кроме печени и головного мозга, инсулинзависимы, следовательно концентрация глюкозы в этих органах будет зависить от концентрации глюкозы в крови. При извлечении инсулина все 5 путей метаболизма будут нарушены.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 585; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.203 (0.028 с.) |
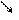
 АТФ
АТФ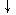

 Галактоза à галактоза-1-Ф УДФ-глюкоза
Галактоза à галактоза-1-Ф УДФ-глюкоза

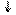 Гл-1-Ф УДФ-галактоза
Гл-1-Ф УДФ-галактоза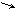
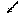
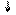 УДФ-глюкоза
УДФ-глюкоза