Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Трансаминирование. Значение. Алт и аст в сыворотке.
Трансаминирование (переаминирование) – межмолекулярный перенос аминогруппы с a-аминокислоты на a-кетокислоту без промежуточного образования аммиака.
Впервые реакции трансаминирования были открыты в 1937 г. при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц АЛА и a- кетоглутаровой кислоты приводило к образованию соответственно ПВК и глутаминовой кислот. Реакции трансаминирования являются обратимыми и универсальными для всех живых организмом, протекают при участии специфических ферментов аминотрансфераз (трансаминаз). Наиболее распространенными из них являются: - глутаматаминотрансфераза (переносит аминогруппу с любой аминокислоты на a-кетоглутаровую кислоту, которая при этом превращается в глутаминовую); - аспартатаминотрансфераза (переносит аминогруппу с любой аминокислоты на ЩУК с образованием аспарагиновой кислоты); - аланинаминотрансфераза (переносит аминогруппу с любой аминокислоты на ПВК с образованием аланина). Все аминотрансферазы в качестве кофермента содержат пиридоксальфосфат (производное витамина В6). Каждая аминотрансфераза специфична к определенным парам a-амино- и a-кетокислот. В организме человека имеется более десятка аминотрансфераз. Замещение кетогруппы в a-кетокислоте на аминогруппу представляет собой конечную стадию синтеза аминокислоты. Наоборот, замещение NН2-группы в аминокислоте на кетогруппу − первая стадия катаболизма аминокислот. Следовательно, трансаминирование может служить как для синтеза, так и для катаболизма аминокислот. Аминотрансферазы содержатся практически во всех органах, но наиболее активно реакции трансаминирования протекают в печени. Функциональное значение трансаминирования в разных органах различно. Например, работающая мышца выделяет в кровь наряду с молочной кислотой значительные количества количества аланина. АЛА образуется в мышце из ПВК путем трансаминирования. Из кровотока АЛА поглощается печенью, где в результате трансаминирования вновь превращается в ПВК, а ПВК используется для глюконеогенеаза (глюкозо-аланиновый цикл). В результате реакций трансаминирования общее количество аминокислот аминокислот в организме не изменяется, т.к. в каждой реакции одна аминокислота превращается в безазотистый остаток (в a-кетокислоту), а один безазотистый остаток – в новую аминокислоту. Напротив, дезаминирование ведет к уменьшению общего количества аминокислот, т.к. NН2-группа не используется для образования новой аминокислоты, а превращается в NН3.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы - аспартат-аминотрансфераза (AcAT) и аланин-аминотрансфераза (АлАТ). В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся дектрукцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3-5 ч после развития инфаркта миокарда уровень AcAT в сыворотке крови резко повышается (в 20-30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, уже через 2-3 дня при благоприятном исходе болезни уровень сыроточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии. поражениях клеток печени, например при гепатитах. БЕЛКИ ПЛАЗМЫ КРОВИ. альбумин, α1-, α2-, β- и γ-глобулины. Разделение на альбумин и глобулин первоначально основывалось на различии в растворимости: альбумины растворимы в чистой воде, а глобулины — только в присутствии солей.
Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связываютводу и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давлениесоставляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. Известно, что в артериальной части капилляров в результате гидростатического давления безбелковая жидкость крови проникает в тканевое пространство. Это происходит до определенного момента – «поворотного», когда падающее гидростатическое давление становится равным коллоидно-осмотическому. После «поворотного» момента в венозной части капилляров происходит обратный ток жидкости из ткани, так как гидростатическое давление стало меньше, чем коллоидно-осмотическое. При иных условиях в результате гидростатического давления в кровеносной системе водапросачивалась бы в ткани, что вызвало бы отек различных органов и подкожной клетчатки. 2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4–5 раз выше вязкостиводы и играет важную роль в поддержании гемодинамических отношений в кровеносной системе. 4. Белки плазмы принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейшихбуферных систем крови. 5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям. 6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов). 7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов вкрови. Например, 40–50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки. 8. Наконец, белки плазмы крови могут служить резервом аминокислот. Современные физико-химические методы позволили открыть и описать около 100 различных белковых компонентов плазмы крови. Особое значение приобрело электрофоретическое разделение белков плазмы (сыворотки) крови. Пониженное количество белка (гипопротеинемия) возникает по причине: недостаточного поступления белка в организм - результат длительного голодания, безбелковой диеты, нарушения деятельности желудочно-кишечного тракта; повышенной потери белка - в результате острых и хронических кровотечениях, злокачественных новообразованиях; нарушения образования белка - как результат недостаточности функции печени (гепатит, цирроз, дистрофия печени).
Повышенное количество белка (гиперпротеинемия) возникает по причине потери части внутрисосудистой жидкости - при перегревании организма, обширных ожогах, тяжелых травмах, холере, миеломной болезни Белковый состав плазмы крови очень разнообразен. Современная медицина идентифицировала более 100 различных белков плазмы. Наиболее простые белки - альбумины, глобулины и фибриноген находятся в плазме в больших количествах, остальные - в ничтожно малых. По форме и величине молекул белки крови разделяют на альбумины и глобулины. Наиболее распространенный белок плазмы крови — альбумин (более 50% всех белков, 40-50 г/л). Они выступают как транспортные белки для некоторых гормонов, свободных жирных кислот, билирубина, различных ионов и лекарственных препаратов, поддерживают постоянство коллоидно-осмотического постоянства крови, участвуют в ряде обменных процессов в организме. Синтез альбумина происходит в печени. 16. ЛИПОПРОТЕИНЫ В ТЕТРАДИ Д БЫТЬ ВИТ В1 Витамин В1 (тиамин; антиневритный), как отмечалось, был первым кристаллическим витамином, выделенным К. Функом в 1912 г. Позже был осуществлен его химический синтез. Наряду с аминогруппой витамин B1 содержит атомысеры, поэтому он был назван тиамином. В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота.
Тиамин хорошо растворим в воде. Водные растворы тиамина в кислой среде выдерживают нагревание до высокихтемператур без снижения биологической активности. В нейтральной и особенно в щелочной среде витамин B1, наоборот, быстро разрушается при нагревании. Этим объясняется частичное или даже полное разрушение тиаминапри кулинарной обработке пищи, например выпечке теста с добавлением гидрокарбоната натрия или карбоната аммония. При окислении тиамина образуется тио-хром, дающий синюю флюоресценцию при УФ-облучении. На этом свойстве тиамина основано его количественное определение. Витамин B1легко всасывается в кишечнике, но не накапливается в тканях и не обладает токсическими свойствами. Избыток пищевого тиамина быстро выводится с мочой. В превращении витамина B1в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиамин-дифосфатом (ТДФ), участвует специфический АТФ-зависимыйфермент тиаминпирофосфокиназа, содержащаяся главным образом в печени и ткани мозга. Опытами с меченным32Р АТФ доказан перенос на тиамин целиком пирофосфатной группы в присутствии фермента. ТПФ имеет следующее строение:
Если витамин B1поступает с пищей в виде ТПФ, то пирофосфатная группа отщепляется от него под действием кишечных пирофосфатаз. При отсутствии или недостаточности тиамина развивается тяжелое заболевание – бери-бери, широко распространенное в ряде стран Азии и Индокитая, где основным продуктом питания является рис. Следует отметить, что недостаточность витамина B1встречается и в европейских странах, где она известна как симптом Вернике, проявляющийся в виде энцефалопатии, или синдром Вейса с преимущественным поражением сердечно-сосудистой системы. Специфические симптомы связаны с преимущественными нарушениями деятельности и сердечно-сосудистой, и нервной систем, а также пищеварительного тракта. В настоящее время пересматривается точка зрения, что бери-бери у человека является следствием недостаточности только витамина В1. Более вероятно, что это заболевание представляет собой комбинированный авитаминоз или полиавитаминоз, при котором организмиспытывает недостаток также в рибофлавине, пиридоксине, витаминах РР, С и др. На животных и добровольцах получен экспериментальный авитаминоз Bl. В зависимости от преобладания тех или иных симптомов различают ряд клинических типов недостаточности, в частности полиневритную (сухую) форму бери-бери, при которой на первый план выступают нарушения в периферической нервной системе. При так называемой отечной форме бери-бери преимущественно поражается сердечно-сосудистая система, хотя отмечаются также явления полиневрита. Наконец, выделяют остро протекающую кардиальную форму болезни, называемую пернициозной, которая приводит к летальному исходу в результате развития острой сердечной недостаточности. В связи с внедрением в медицинскую практику кристаллического препарата тиамина летальность резко сократилась и наметились рациональные пути лечения и профилактики этого заболевания. К наиболее ранним симптомам авитаминоза В1 относятся нарушения моторной и секреторной функций пищеварительного тракта: потеря аппетита, замедление перистальтики (атония) кишечника, а также изменения психики, заключающиеся в потере памяти на недавние события, склонности к галлюцинациям; отмечаются изменения деятельности сердечно-сосудистой системы: одышка, сердцебиение, боли в области сердца. При дальнейшем развитии авитаминоза выявляются симптомы поражения периферической нервной системы (дегенеративные изменения нервных окончаний и проводящих пучков), выражающиеся в расстройстве чувствительности, ощущении покалывания, онемения и болей по ходу нервов. Эти поражения завершаются контрактурами, атрофией и параличами нижних, а затем и верхних конечностей. В этот же период развиваются явления сердечной недостаточности (учащение ритма, сверлящие боли в области сердца). Биохимические нарушения при авитаминозе В1 проявляются развитием отрицательного азотистого баланса, выделением в повышенных количествах с мочой аминокислот и креатина, накоплением в крови и тканях α-кетокислот, а также пентозосахаров. Содержание тиамина и ТПФ в сердечной мышце и печени у больных бери-бери в 5-6 раз ниже нормы.
Биологическая роль. Экспериментально доказано, что витамин B1в форме ТПФ является составной часть минимум 5 ферментов, участвующих в промежуточном обмене веществ. ТПФ входит в состав двух сложных ферментных систем – пируват - и α - кетоглутарат дегидрогеназных комплексов, катализирующих окислительноедекарбоксилирование пировиноградной и α-кетоглутаровой кислот. В составе транскетолазы ТПФ участвует в переносе гликоальдегидного радикала от кетосахаров на альдосахара (см. главу 10). ТПФ является коферментомпируватдекар-боксилазы клеток дрожжей (при алкогольной ферментации) и дегидро-геназы γ-оксикетоглутаровойкислоты. Приведенными примерами, вероятнее всего, не ограничиваются биологические функции тиамина. В частности, ТПФ участвует в окислительном декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующихся при распадеаминокислот с разветвленной боковой цепью; в растениях ТПФ является эссенциальным кофактором при синтезевалина и лейцина в составе фермента ацетолактатсинтетазы. Распространение в природе и суточная потребность. Витамин В1 широко распространен в природе. Основное количество его человек получает с растительной пищей. Много витамина B1содержится в дрожжах, пшеничном хлебе из муки грубого помола, оболочке и зародышах семян хлебных злаков, сое, фасоли, горохе, меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты витамином B1печень, почки, мозг. Некоторые бактерии, населяющие кишечник животных, способны синтезировать достаточное количество тиамина: например, количества витамина В1, синтезированного микрофлорой кишечника коров, оказывается вполне достаточно для покрытия потребностей организма. Рекомендуемые Институтом питания РАМН нормы суточного потребления тиамина для отдельных групп населения составляют от 1,2 до 2,2 мг. 18. ИНГИБИРОВАНИЕ ФЕРМЕНТНОЙ АКТИВНОСТИ. Можно выделить два основных направления ингибирования · по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым. · по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное. Необратимое ингибирование При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности. Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию. Аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман) и инсектициды (карбофос, дихлофос).
Механизм необратимого ингибирования ацетилхолинэстеразы Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к аминогруппе в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
Механизм необратимого ингибирования циклооксигеназы Обратимое ингибирование При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается. Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС. Конкурентное ингибирование При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. Например: 1. Конкурентное взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. 2. Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
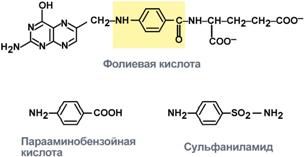
Конкурентное ингибирование сукцинатдегидрогеназы 3. Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с п -аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п -аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.
Сходство строения сульфаниламидов
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.8.247 (0.036 с.) |