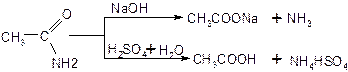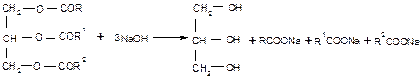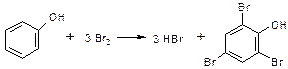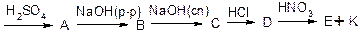Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторный практикум по органической химииСтр 1 из 10Следующая ⇒
Лабораторный практикум по органической химии (часть 1) Учебно-практическое пособие
УДК 547
Составители: доктор техн. наук, доц. И.Ю. Жукова, канд. хим. наук, доц. И.С. Кашпаров канд. хим. наук, доц. И.Н. Тягливая
Лабораторный практикум по органической химии (часть 1). Учебно-практическое пособие. — Ростов н/Д: Издательский центр ДГТУ, 2012. — 61 с.
Учебно-практическое пособие предназначено для студентов направления 240100 Химическая технология в рамках курса «Органическая химия». При составлении лабораторного практикума авторы опирались на изучение теоретического курса, который сопровождается выполнением лабораторных работ, что позволяет на практике изучить характерные общие свойства и реакции органических соединений, индивидуальные особенности отдельных веществ.
Печатается по решению методической комиссии факультета
Рецензент кандидат технических наук, доц. И.Б. Ильчибаева
СОДЕРЖАНИЕ
Введение Только на основе органической химии можно решить ряд проблем технологии переработки нефти и газа, получения исходного сырья и вспомогательных веществ для производства композиционных материалов, а также снизить негативные последствия производственной деятельности на окружающую среду.
Лабораторный практикум предусматривает закрепление теоретических знаний по дисциплине «Органическая химия». Для того, чтобы помочь студенту ориентироваться в значительном по объему материале и сконцентрировать внимание на узловых вопросах лабораторные работы предваряются краткой теоретической частью. С целью закрепления изучаемого материала также предлагаются контрольные вопросы. Ряд соединений, свойства которых исследуются в практикуме, получают и выделяют непосредственно в ходе опытов. Это дает возможность предварительно познакомиться с методами синтеза, очисткой и идентификацией органических веществ. Приведенные в практикуме лабораторные работы, охватывают курс, предусмотренный программой для технических вузов.
УКАЗАНИЯ К ПОДГОТОВКЕ И ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ
Перед выполнением лабораторной работы студенты должны изучить соответствующий теоретический материал, усвоить ход выполнения опытов, а затем ответить на предлагаемые контрольные вопросы. При этом следует уделить внимание технике безопасности при работе с конкретными соединениями.
МЕТОДИКИ ЛАБОРАТОРНЫХ РАБОТ 4.1. Лабораторная работа № 1. Опыт 2. Определение азота При сплавлении с органическим веществом металлический натрий отщепляет от него азот и углерод, образуя цианид натрия, который, реагируя с сульфатом железа (II), дает синюю окраску берлинской лазури.
На дно сухой пробирки помещают немного испытуемого вещества и небольшой кусочек металлического натрия, пробирку осторожно нагревают до обугливания органического вещества. Натрий должен плавиться вместе с веществом. Слегка встряхивают пробирку, чтобы вещество обволокло натрий. Затем нагревают нижний конец пробирки до темно-красного каления, при этом может быть небольшая безопасная вспышка натрия. Горячую пробирку резко опускают (разбивают) нижним концом в фарфоровую ступку с 7 мл воды. Эту операцию необходимо проводить в защитных очках, т.к. возможна сильная вспышка от оставшегося кусочка натрия. Содержимое ступки тщательно растирают пестиком, переносят смесь вместе с остатками стекла в другую пробирку, нагревают до кипения и отфильтровывают. Фильтрат делят на 3 равные части в чистые пробирки. К первой части фильтрата добавляют несколько кристалликов сульфатом железа (II) и кипятят эту смесь 1 минуту, охлаждают, дают постоять 3-4 минуты и подкисляют 2 н раствором соляной кислоты. Образование осадка берлинской лазури указывают на присутствие азота. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет.
Опыт 3. Определение серы При сплавлении натрий отщепляет от вещества серу с образованием сульфид натрия, который, реагируя с нитратом свинца в щелочной среде, образует сульфид свинца:
1) К 1 мл раствора нитрата свинца приливают 2 н раствор гидроксида натрия по каплям до растворения первоначально образовавшегося осадка гидроксида свинца и затем добавляют вторую часть фильтрата из предыдущего опыта. Появление темно-коричневой окраски или образование черного осадка сульфида свинца указывает, что исследуемое вещество содержало серу.
2) К 1 мл фильтрата (третья часть фильтрата из опыта 2) добавляют 1-2 капли раствора нитропруссида натрия. В присутствии серы смесь приобретает ярко-фиолетовую окраску. Нитропруссид натрия образует с сульфидом натрия нестойкое комплексное соединение.
Опыт 5. Горение алканов В фарфоровую чашку наливают 1 мл гептана и поджигают его. Почему в отличие от метана гептан горит коптящим пламенем? Вычислите массовую долю углерода в метане и гептане и составьте уравнения их горения. Опыт 2. Получение йодоформа 1) Из спирта:
CH3CH2OH + 4I2 + 3K2CO3 ® CHI3 + HCOOK + 5KI + 2H2O + 3CO2
В стакан емкостью 150 мл помещают 40 мл воды, 6 г карбоната калия и 10 мл этанола. Реакционную смесь нагревают на водяной бане до 70 0С и при перемешивании небольшими порциями добавляют 8 г растертого в порошок йода (каждую последующую порцию йода всыпают после исчезновения бурой окраски!). Через некоторое время йодоформ выпадает в виде желтых кристаллов, которые отделяются фильтрованием.
2) Из ацетона
CH3COCH3 + 3I2 ® CI3 COCH3 + 3HI
CI3 COCH3 + NaOH ® CH3COONa + CHI3
В пробирку наливают 2 мл ацетона и 1 мл воды, затем добавляют 1 мл водного раствора йода и несколько капель раствора щелочи (КОН или NaOH) до исчезновения окраски. Образуется желтый осадок йодоформа с характерным запахом.
3) Из уксусного альдегида
CH3CHO + 3I2 ® CI3 CHO + 3HI
CI3 CHO + NaOH ® HCOONa + CHI3
В пробирку к 2 мл раствора альдегида и 1 мл воды добавляют 1 мл раствора йода и несколько капель раствора щелочи до исчезновения окраски. Образуется желтый осадок йодоформа с характерным запахом. Опыт 5. Гидролиз хлороформа
CHI3 + 4NaOH ® HCOONa + 2H2O + 3NaCl
В коническую колбу, объемом 50 мл, помещают 3 мл хлороформа и 10 мл 10 % - ного раствора гидроксида натрия. Реакционную смесь нагревают несколько минут до начала кипения хлороформа на асбестовой сетке (осторожно!), после охлаждения переливают в две колбы (колбы должны быть чистыми!). В одну колбу добавляют 20 % - ной азотной кислоты до кислой реакции и 2-3 мл 1 % - ного раствора нитрата серебра; тотчас образуется обильный осадок хлорида серебра. В стакан наливают 10 мл 1 % - ного раствора нитрата серебра, а затем концентрированный раствор аммиака до полного растворения гидроксида серебра. Полученный аммиачный раствор гидроксида серебра переливают во вторую колбу со второй частью гидролизата; сразу же выделяется темный осадок металлического серебра вследствие восстановления оксида серебра, образовавшийся муравьиной кислотой.
Напишите уравнения реакции, которые протекают с гидролизатом в двух колбах.
Ароматические углеводороды
К ароматическим соединениям относятся бензол и вещества (толуол, нафталин), содержащие в своем составе бензольное ядро. Для ароматических углеводородов характерны тенденция реакции электрофильного замещения, например: 1) нитрование
нитробензол
2) алкилирование по Фриделю-Крафтсу
алкилбензол Материалы: бензойная кислота; натронная известь (NaOH+CaO), бензол, толуол, ксилол, нафталин, 3 %-ный раствор брома в четыреххлористом углероде, концентрированная серная кислота, раствор перманганата калия, 10 %-ный раствор серной кислоты, концентрированная азотная кислота, хлористый алюминий, хлороформ; антрацен.
Спирты
Этот класс соединений характеризуется наличием одной или нескольких функциональных групп – ОН. Количество гидроксильных групп определяет атомность спиртов. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксильная группа, определяют и характер спирта. Многие свойства спиртов определяются гидроксильной функциональной группой, в которой могут поляризоваться как связь водорода с кислородом, так и связь кислорода с углеводородным радикалом. Однако, кислотные свойства спиртов очень слабо выражены, даже в меньшей степени, чем у воды. При взаимодействии с сильными кислотами спирты проявляют основные свойства и образуют соли оксония. Свойства спиртов также зависят и от характера углеводородного радикала, с которым связана гидроксильная группа. Это определяет различную реакционную способность первичных, вторичных и третичных спиртов. Снижение активности водорода при переходе от первичного к третичному спирту объясняется уменьшением полярности связи О-Н вследствие увеличения электронодонорных свойств алкильных радикалов в сравнении с атомом водорода. Многоатомные спирты по свойствам близки к одноатомным, однако, в сравнении с последними обладают более выраженными кислотными свойствами. Поэтому, в отличие от одноатомных растворяют гидроксиды тяжелых металлов. Многоатомные спирты находят большое применение в синтезе высокомолекулярных соединений, медицине, технике и др.
Материалы: этиловый, пропиловый, изопропиловый и трет-бутиловый спирты; глицерин, реактив Лукаса; вода, подкрашенная перманганатом калия; бутиловый, изоамиловый спирты; медный купорос (CuSO4∙5H2O); поташ (K2CO3) (или гипосульфит калия); металлический натрий; раствор фенолфталеина; концентрированная серная кислота; КМnO4; 5 %-ный раствор бихромат калия (K2Cr2O7); 25 %-ный раствор разбавленной серной кислоты; концентрированная соляная кислота; 2 %-ный раствор сульфата меди; 10 %-ный раствор гидроксида натрия; нитрит натрия; гидросульфат калия или натрия. Опыт 3. Горение спиртов В фарфоровые чашки наливают по 10 мл этилового, бутилового и изоамилового спиртов и поджигают их. По мере увеличения молекулярной массы спирты горят более коптящим пламенем. Почему? Напишите уравнения реакций.
Опыт 6. Образование и гидролиз алкоголята
В сухую пробирку помещают кусочек чистого (свежесрезанного, очищенного от корочек и отжатого от керосина) металлического натрия величиной с небольшую горошину, затем добавляют обезвоженный этанол (~5-7 мл). Пробирку закрывают пробкой с газоотводной трубкой и охлаждают в стакане с водой, предотвращая выкипание спирта в результате экзотермической реакции. Когда выделение газа станет спокойным, подносят пробирку отверстием газоотводной трубки к пламени горелки: выделяющийся водород дает в смеси с воздухом вспышку с характерным резким звуком. Жидкость постепенно густеет, натрий покрывается слоем твердого алкоголята, и реакция замедляется настолько, что для ее ускорения требуется слегка нагреть пробирку. Если выделение водорода почти прекратится, а натрий полностью не растворится, подогревают смесь до разжижения и удаляют из нее оставшийся кусочек натрия при помощи изогнутой проволочки. Извлеченный натрий помещают в банку для остатков натрия. Полученный концентрированный раствор алкоголята при охлаждении закристаллизовывается. Добавляют в ту же пробирку 5-6 мл воды и испытывают фенолфталеином или универсальной индикаторной бумагой реакцию полученного раствора. Альдегиды и кетоны
Альдегиды и кетоны являются производными углеводородов, содержащими в своем составе карбонильную группу C=O. В отличие от кетонов, в альдегидах карбонильный углерод связан с одним атомом водорода. Это предопределяет их более высокую реакционную способность. Большинство реакций присоединения протекают за счет двойной связи карбонильной группы, которая поляризована. Реакции нуклеофильного присоединения начинаются с атаки нуклеофильным реагентом (Nu-) атома углерода и завершаются последующим присоединением электрофильного реагента (чаще всего протона Н+):
Альдегиды и кетоны по разному относятся к действию окислителей. Первые окисляются очень легко с образованием карбоновых кислот, кетоны окисляются значительно труднее с разрывом углеродной цепи около карбонильной группы.
Ряд реакций (с галогенидами фосфора (V), гидразином, гидроксиламином и др.) приводит к замещению кислорода карбонильной группы другими атомами. Материалы: 40 %-ный раствор формальдегида; метиловый красный; 10 %-ный раствор гидроксида натрия; 1 %-ный раствор нитрата серебра; 5 %-ный раствор аммиака; растворы Фелинга-1 (раствор сульфата меди) и Фелинга-2 (щелочной раствор сегнетовой соли); 1 %-ный раствор формальдегида; фуксинсернистая кислота; солянокислый гидроксиламин; безводный карбонат натрия; ацетон; гидросульфит натрия. Опыт 3. Гидролиз ацетамида
Растворяют 0,5 г ацетамида в 5 мл воды, половину полученного раствора отливают в другую пробирку. К одной части раствора приливают 3 мл 10 %-ного раствора гидроксида натрия, к другой – 3 мл 10 %-ного раствора серной кислоты. Затем нагревают смеси в каждой пробирке до кипения и определяют выделяющиеся вещества по запаху и с помощью индикаторной бумажки. Опыт 6. Омыление жиров В широкую пробирку помещают 3 г растительного или животного жира (опыты можно проводить параллельно с разными жирами), 3 мл этанола и 3 мл 40 %-ного раствора гидроксида натрия (спирт вводится для увеличения растворимости жира и ускорения реакции гидролиза). Перемешивают смесь встряхиванием (или при помощи палочки) и нагревают на водяной бане до начала кипения. Смесь быстро становится однородной, через 3-5 минут омыление заканчивается. Для проверки полноты омыления отбирают несколько капель смеси в пробирку, добавляют 5-6 мл горячей дистиллированной воды и нагревают раствор. Если проба растворяется в воде полностью, не выделяя капель жира, омыление можно считать законченным. В противном случае смесь нагревают еще несколько минут. К полученной густой жидкости добавляют при перемешивании горячий насыщенный раствор поваренной соли. Дают смеси отстояться в водяной бане, затем погружают пробирку почти до краев в стакан с холодной водой на 5-10 минут, при этом слой мыла затвердевает. Полученное мыло извлекают из пробирки палочкой или шпателем.
Опыт 7. Свойства мыла 1) к 1 мл 5 %-ного раствора мыла добавляют 0,5 мл 2 %-ного раствора хлорида кальция, хорошо взбалтывают смесь. Выпадает белый творожистый осадок нерастворимого кальциевого мыла.
2) к 1 мл 5 %-ного раствора мыла добавляют 5 капель 10 %-ного раствора серной кислоты и слегка подогревают в пламени горелки. Всплывает маслянистый слой свободных жирных кислот.
Фенолы
Фенол, его гомологи и производные являются основой для получения самых различный веществ, спектр использования которых простирается от медицины до предприятий текстильной и легкой промышленности. Химические свойства фенолов определяются взаимным влиянием друг на друга фенильного радикала и гидроксильной группы. В сравнении со спиртами фенолы проявляют значительно более ярко выраженные кислотные свойства, хотя как кислоты они слабее угольной и карбоновых кислот. В отличие от бензола фенолы легко вступают в реакции, приводящие к замещению атомов водорода. Под влиянием электрофильных реагентов замещение протекает в орто- и пара-положения по отношению к гидроксилу, т.к. группа – ОН является электродонорным заместителем (заместитель I рода). Достаточно легко протекают реакции конденсации с альдегидами с образованием цепных синтетических смол. Многоатомные фенолы по своим свойствам близки к одноатомным, особенностью является высокая склонность к окислению. Из двухатомных фенолов получают различные красители, синтетические смолы, лекарственные препараты. Материалы: фенол; резорцин; пирокатехин; гидрохинон; пирогаллол; 1 %-ный раствор фенола в воде; индикаторная бумага; эмульсия фенола; 2 н раствор гидроксида натрия; бромная вода; α – нафтол; β – нафтол; 0,1 н раствор хлорида железа (III); 2 н раствор HCl; 2 н раствор NH4OH; насыщенный раствор бромной воды; 2 н раствор гидроксида натрия; 1 %-ный раствор пирокатехина; 1 %-ный раствор резорцина; 1 %-ный раствор гидрохинона; 1 %-ный раствор пирогаллола; 1 %-ный раствор нитрата серебра; 40%-ный раствор формалина; бихромат калия; фталевый ангидрид; концентрированная серная кислота; фенолфталеин; щавелевая кислота; сульфат натрия; йодид калия. Опыт 3. Бромирование В пробирку помещают 1 мл раствора фенола, при встряхивании по каплям прибавляют бромную воду. Раствор обесцвечивается и выпадает белый осадок. Напишите уравнение реакции бромирования фенола, с образованием 2,4,6-трибромфенола.
Опыт 7. Образование трибромфенола Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды из опыта № 5. Немедленно происходит обесцвечивание бромной воды и выделение белого осадка трибромфенола:
фенол симм -трибромфенол
Опыт с фенолом показывает, что под влиянием гидроксильной группы атомы водорода в бензольном кольце приобретают большую подвижность и очень легко замещаются бромом. Опыт 17. Образование аурина
Помещают в сухую пробирку 0,05 г щавелевой кислоты (в порошке) примерно вдвое больше кристаллического фенола. Смешивают оба вещества легким встряхиванием и, смочив смесь 1-2 каплями концентрированной серной кислоты, осторожно нагревают ее в пламени горелки до начала кипения и появления интенсивно желтой окраски. Охладив пробирку, добавляют к затвердевшему продукту реакции 3-4 мл воды и встряхивают; образуется ярко-желтый раствор. При добавлении разбавленной щелочи желтая окраска жидкости переходит в красную, а при последующем подкислении – снова в желтую.
КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Приведите способы получения фенола из: а) хлорбензола; б) бензойной кислоты; в) хлористого фенилдиазония. 2. В чем причина различной способности к замещению атомов водорода в молекуле бензола и фенола? 3. Сравните свойства бензилового спирта и фенола. 4. Каким образом протекают реакция образования новолачных смол? 5. В чем общность и различие свойств одно- и двухатомных фенолов? 6. Заполните схему превращений:
Бензол
Список рекомендуемой литературы 1. Гиттис С.С. Практикум по органической химии / С.С. Гиттис, А.И. Глаз, А.В. Иванов– М.: Высшая школа, 1991. – 303с. 2. Аверина А.В. Лабораторный практикум по органической химии / А.В. Аверина, А.Я. Снегирева- М.: Высшая школа, 1980. – 184с. 3. Грандберг И.И. Практические и семинарские занятия по органической химии / И.И. Грандберг - М.: Высшая школа, 1987. – 239с. 4. Лабораторные работы по органической химии / под ред. О.Ф. Гинзбурга и А.А. Петрова - М.: Высшая школа, 1982. – 189с. 5. Некрасов В.В. Руководство к малому практикуму по органической химии / В.В. Некрасов - М.: Химия, 1975. 328с. 6. Петров А.А. Органическая химия: Учебник для вузов / Под ред. Стадничука М.Д.- 5-е изд.,перераб.и доп. – СПб.: Иван Федоров, 2002- 624с. 7. Рево А.Я. Практикум по органической химии / А.Я. Рево– М.: Высшая школа, 1971. – 208 8. Травень В.Ф. Органическая химия / В.Ф Травень. - М.: ИКЦ «Академкнига», 2005г.- 1,2 т.
Составители: ЖУКОВА Ирина Юрьевна, КАШПАРОВ Игорь Сергеевич, ТЯГЛИВАЯ Инна Николаевна
Лабораторный практикум по органической химии (часть 1). Учебно-практическое пособие.
Редактор А.А. Литвинова _________________________________________________________ В печать Объем усл. п. л. Офсет. Формат 60х84/16. Бумага тип №3. Заказ № _________. Тираж ____ экз. Цена свободная _________________________________________________________ Издательский центр ДГТУ Адрес университета и полиграфического предприятия: 344000, г. Ростов-на-Дону, пл. Гагарина, 1
Лабораторный практикум по органической химии (часть 1) Учебно-практическое пособие
УДК 547
Составители: доктор техн. наук, доц. И.Ю. Жукова, канд. хим. наук, доц. И.С. Кашпаров канд. хим. наук, доц. И.Н. Тягливая
Лабораторный практикум по органической химии (часть 1). Учебно-практическое пособие. — Ростов н/Д: Издательский центр ДГТУ, 2012. — 61 с.
Учебно-практическое пособие предназначено для студентов направления 240100 Химическая технология в рамках курса «Органическая химия». При составлении лабораторного практикума авторы опирались на изучение теоретического курса, который сопровождается выполнением лабораторных работ, что позволяет на практике изучить характерные общие свойства и реакции органических соединений, индивидуальные особенности отдельных веществ.
Печатается по решению методической комиссии факультета
Рецензент кандидат технических наук, доц. И.Б. Ильчибаева
СОДЕРЖАНИЕ
Введение Только на основе органической химии можно решить ряд проблем технологии переработки нефти и газа, получения исходного сырья и вспомогательных веществ для производства композиционных материалов, а также снизить негативные последствия производственной деятельности на окружающую среду. Лабораторный практикум предусматривает закрепление теоретических знаний по дисциплине «Органическая химия». Для того, чтобы помочь студенту ориентироваться в значительном по объему материале и сконцентрировать внимание на узловых вопросах лабораторные работы предваряются краткой теоретической частью. С целью закрепления изучаемого материала также предлагаются контрольные вопросы. Ряд соединений, свойства которых исследуются в практикуме, получают и выделяют непосредственно в ходе опытов. Это дает возможность предварительно познакомиться с методами синтеза, очисткой и идентификацией органических веществ. Приведенные в практикуме лабораторные работы, охватывают курс, предусмотренный программой для технических вузов.
УКАЗАНИЯ К ПОДГОТОВКЕ И ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ
Перед выполнением лабораторной работы студенты должны изучить соответствующий теоретический материал, усвоить ход выполнения опытов, а затем ответить на предлагаемые контрольные вопросы. При этом следует уделить внимание технике безопасности при работе с конкретными соединениями.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.44.223 (0.132 с.) |






 δ+ δ _
δ+ δ _


 δ + δ - или δ + δ - δ + δ -
δ + δ - или δ + δ - δ + δ -