Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства элементов находятся в периодической зависимости от порядкового номера.
Периодически повторяющийся характер изменения состава электронной оболочки атомов элементов объясняет периодическое изменение свойств элементов при движении по периодам и группам Периодической системы.
Проследим, например, изменение высших и низших степеней окисления у элементов IA – VIIA‑групп во втором – четвертом периодах по табл. 3. Положительные степени окисления проявляют все элементы, за исключением фтора. Их значения увеличиваются с ростом заряда ядер и совпадают с числом электронов на последнем энергетическом уровне (за исключением кислорода). Эти степени окисления называют высшими степенями окисления. Например, высшая степень окисления фосфора Р равна +V.
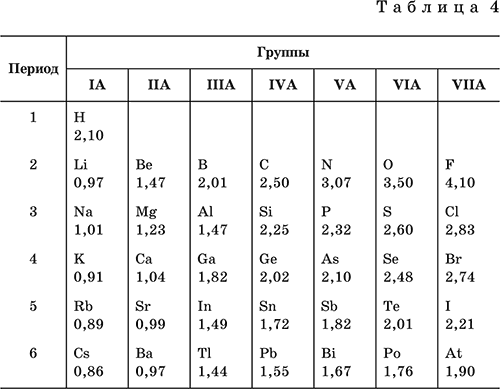
Отрицательные степени окисления проявляют элементы, начиная с углерода С, кремния Si и германия Ge. Значения их равны числу электронов, недостающих до восьми. Эти степени окисления называют низшими степенями окисления. Например, у атома фосфора Р на последнем энергетическом уровне недостает трех электронов до восьми, значит, низшая степень окисления фосфора Р равна – III. Значения высших и низших степеней окисления повторяются периодически, совпадая по группам; например, в IVA‑группе углерод С, кремний Si и германий Ge имеют высшую степень окисления +IV, а низшую степень окисления – IV. Эта периодичность изменения степеней окисления отражается на периодическом изменении состава и свойств химических соединений элементов. Аналогично прослеживается периодическое изменение электроотрицательности элементов в 1–6‑м периодах IA– VIIA‑групп (табл. 4). В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
В каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз). Фтор F обладает наивысшей, а цезий Cs – наинизшей электроотрицательностью среди элементов 1–6‑го периодов. У типичных неметаллов – высокая электроотрицательность, а у типичных металлов – низкая.
Примеры заданий частей А, В
1. В 4‑м периоде число элементов равно 1) 2 2) 8 3) 18 4) 32
2. Металлические свойства элементов 3‑го периода от Na до Сl
1) силиваются 2) ослабевают 3) не изменяются 4) не знаю
3. Неметаллические свойства галогенов с увеличением порядкового номера 1) возрастают 2) понижаются 3) остаются без изменений 4) не знаю
4. В ряду элементов Zn – Hg – Со – Cd один элемент, не входящий в группу, – это 1) Са 2) Cs 3) Cd 4) Со
5. Металлические свойства элементов повышаются по ряду 1) In – Ga – Al 2) К – Rb – Sr 3) Ge – Ga – Tl 4) Li – Be – Mg
6. Неметаллические свойства в ряду элементов Аl – Si – С – N 1) увеличиваются 2) уменьшаются 3) не изменяются 4) не знаю
7. В ряду элементов О – S – Se – Те размеры (радиусы) атома 1) уменьшаются 2) увеличиваются 3) не изменяются 4) не знаю
8. В ряду элементов Р – Si – Аl – Mg размеры (радиусы) атома 1) уменьшаются 2) увеличиваются 3) не изменяются 4) не знаю
9. Для фосфора элемент с меньшей электроотрицательностью – это 1) N 2) S 3) Сl 4) Mg
10. Молекула, в которой электронная плотность смещена к атому фосфора, – это 1) PF3 2) РН3 3) P2S3 4) Р2O3
11. Высшая степень окисления элементов проявляется в наборе оксидов и фторидов 1) СlO2, РСl5, SeCl4, SO3 2) PCl, Аl2O3, КСl, СО 3) SeO3, ВСl3, N2O5, СаСl2 4) AsCl5, SeO2, SCl2, Cl2O7
12. Низшая степень окисления элементов – в их водородных соединениях и фторидах набора 1) ClF3, NH3, NaH, OF2 2) H3S+, NH+, SiH4, H2Se 3) CH4, BF4, H3O+, PF3 4) PH3, NF+, HF2, CF4
13. Валентность для многовалентного атома одинакова в ряду соединений 1) SiH4 – AsH3 – CF4 2) РН3 – BF3 – ClF3 3) AsF3 – SiCl4 – IF7 4) H2O – BClg – NF3
14. Укажите соответствие между формулой вещества или иона и степенью окисления углерода в них
|
|||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 319; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.106.241 (0.01 с.) |