
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нарушение устойчивости лиофобных золей
При работе с коллоидными системами часто возникает проблема сохранения их в состоянии золя или, наоборот, перевода их в коагулированное состояние. Коагуляция может произойти под влиянием различных внешних факторов (изменение температуры, механическое воздействие, облучение, добавление электролитов и другие), а иногда даже без видимых на то причин. Из всех факторов наиболее хорошо изучено действие электролитов, приводящее к коагуляции. Теория коагуляции. При коагуляции лиофобных золейпроисходит слипание гранул соседних мицелл. Как следует из теории устойчивости коллоидных систем, для слипания частиц необходимо, чтобы электростатические силы отталкивания между гранулами лио-фобного золя стали незначительными. Это может произойти в том случае, если по каким-то причинам абсолютная величина К такому же эффекту приводит сжатие диффузного слоя, в результате которого толщина ионно-сольватной оболочки вокруг гранулы уменьшается, и она становится неспособной оказывать “расклинивающее действие” при сближении гранул. Подобное сжатие может произойти, если некоторая часть ионов диффузного слоя по каким-то причинам перейдет в адсорбционный слой или покинут диффузный слой. Начальная стадия коагуляции, при которой не наблюдаются определенные внешние эффекты, называется скрытой коагуляцией. При явной коагуляции наблюдаются видимые изменения в коллоидной системе (появление мутноватости и хлопьев, выпадение осадка или изменение цвета). Коагуляция всегда происходит за определенный промежуток времени. Кинетические кривые коагуляции приведены на рисунке12, из которой видно, что общее количество частиц (
Рисунок 12 Изменение относительного числа частиц во времени в процессе коагуляции
Поскольку в процессе слияния участвуют две частицы, то он описывается кинетическим уравнением второго порядка: – где ni – количество частиц i- ой кратности (i= 1, 2, 3, 4... i). Константа скорости процесса k определяется соотношением: k = 4 где D – коэффициент диффузии; R – радиус силового поля частицы, связанного со свободной поверхностной энергией частицы; Действие электролитов. В зависимости от характера воздействия ионов добавленного электролита на мицеллу различают два вида коагуляции – концентрационную и нейтрализационную. Концентрационная коагуляция происходит при действии на золь индифферентного электролита, то есть такого, у которого ионы не участвуют в ионообменном процессе с мицеллой. В этом случае ионы добавленного электролита снижают активность молекул дисперсионной среды, что приводит к переходу части ионов диффузного слоя в адсорбционный слой. В результате уменьшается величина Определение порогов коагуляции осложняется явлением привыкания. Оно заключается в том, что при добавлении электролита небольшими порциями порог коагуляции имеет большее значение, чем при внесении электролита сразу. Предполагают, что в случае медленного добавления электролита в золь между ними успевает происходить реакция, в результате которой образуется пептизаторы. Наблюдается и обратное явление, когда порог коагуляции при постепенном введении электролита ниже, чем при быстром добавлении его (отрицательное привыкание)
коагулирующим действием обладает лишь тот ион добавленного электролита, который имеет заряд, противоположный, заряду гранулы, причем его коагулирующая способность выражается тем сильнее, чем выше заряд. Для многих систем пороги коагуляции (С пк ) электролитов по отношению к одному и тому же золю обратно пропорциональны шестой степени величины заряда (z6)коагулирующего иона. Правило Шульце-Гарди справедливо только при действии неорганических электролитов. Однозарядные ионы органических электро-литов могут обладать более высокой коагулирующей способностью из-за их специфической адсорбции. При одинаковой концентрации индифферентного и нейтрализу-ющего электролита более значительное понижение При определенной концентрации добавленного электролита возможно возникновение такого состояния коллоидной частицы, когда Коагуляция смесью электролитов. Обычно в реальных условиях на коллоидную систему действует смесь электролитов. При этом возможны три эффекта воздействия электролитов – аддитивное действие, синергизм и антагонизм. Аддитивное действие характеризуется тем, что электролиты действуют как бы независимо и их коагулирующее действие в смеси определяют по правилу простого сложения. Такой эффект наблюдается, когда коагулирующие ионы одни и те же, но электролиты отличаются противоположно заряженными ионами. Например, если коагулирующим ионом является ион Сl– и по отношению к данному золю пороги коагуляции для КCl равны С 1, а для NaCl равны С 2, то в случае добавления КCl 1/3 C 1 потребуется NaCl 2/3 C 2. Синергизм действия заключается в том, что порог коагуляции смеси электролитов получается намного ниже по сравнению с порогами коагуляции отдельно взятых электролитов. Наиболее часто встречающейся причиной синергизма действия является появление в коллоидной системе многовалентного коагулирующего иона в результате реакции между электролитами. Рассмотрим коагуляцию золя при действии двух электролитов – KCN и FeCl3. Если коагулирующее действие оказывают однозарядные анионы электролитов (CN- и Cl-), то из-за протекания в их смеси реакции
появляются трехзарядные коагулирующие анионы Антагонизм действия электролитов вызывает, наоборот, увеличение порога коагуляции смеси электролитов. Пусть золь имеет отрицательно заряженные гранулы. Если к нему добавить электролит FeCl3, то коагуляцию будут вызывать трехзарядные катионы Fe3+ и порог коагуляции будет небольшим. При применении для коагуляции того же золя смеси электролитов KCN и FeCl3 порог коагуляции возрастет в 600…700 раз из-за замены коагулирующего иона Fe3+ однозарядным ионом K+
Перезарядка золей. Добавление к золю раствора электролита с одно- и двухзарядным коагулирующим иономобычно приводит к снижению Такое явление периодического чередования зон устойчивости золя с зонами коагуляции носит название неправильных рядов коагуляции.

Взаимная коагуляция золей. При сливании двух золей с про-тивоположно заряженными гранулами возможна взаимная коагуля-ция. Она сопровождается соединением двух гранул разных золей. Если взять одинаковые объемы двух золей, концентрация частиц которых также одинакова, то полнота коагуляции будет зависеть от величины Однако взаимная коагуляция может произойти и тогда, когда заряды гранул сливаемых вместе золей одинаковы. В этом случае предполагается, что частицы одного золя адсорбируют ионы-стаби-лизаторы другого электролита и тем самым снижают его устойчивость. Взаимной коагуляцией пользуются при осветлении питьевой воды. Чтобы очистить воду от высокодисперсных отрицательно заряженных частиц песка и глины к нему добавляют небольшое ко-личество Al2(SO4)3, который, гидролизуясь, образует положительно заряженый золь гидроксида алюминия. В результате взаимной коагуляции частицы взвеси оседают на дно совместно с частицами гидрок-сида алюминия.
При сливании различных виноградных вин возможно образование осадка. Возможно, коллоидные частицы их несут разноименные заряды и происходит взаимная коагуляция. Пептизация. Пептизация – это переход свежеполученного рыхлого осадка в состояние золя при действии на него некоторых электролитов, способных хорошо адсорбироваться на поверхности коллоидных частиц, а также при промывании его большим количеством дисперсионной среды. Рыхло соединенные в осадке первичные частицы избирательно адсорбируют ионы электролита, которые становятся потенциалопределяющими ионами будущей мицеллы. Вокруг части-цы восстанавливается ионная атмосфера с образованием двойного электрического слоя, возрастают В интенсификации процесса пептизации большое значение имеет встряхивание и перемешивание, обеспечивающие доступ ионов пептизатора к частицам осадка, а также повышение температуры системы. Пептизация широко применяется при получении высокодисперсных суспензий различных материалов. Моющее действие поверхностно-активных веществ также связано с процессом пептизации. С пептизацией, как с нежелательным явлением, приходится сталкиваться при проведении химических анализов. Например, свежеполученный осадок при промывании его водой переходит в коллоидное состояние и проходит сквозь фильтр. Коллоидная защита. Коллоидная защита – это увеличение устойчивости лиофобных золей путем добавления к ним небольшого количества высокомолекулярногосоединения. Коллоидная частица, адсорбировавшая на себе молекулы ВМС, принимает все его свойства. В частности, происходит повышение порога коагуляции. Для проявления защитного действия необходимо определенное количество ВМС, которое должно покрыть поверхности коллоидных частиц. При дальнейшем прибавлении ВМС увеличение защитного эффекта не наблюдается. Однако добавление к золю ВМС в количестве, недостаточном для оказания защитного действия, может, наоборот, привести к понижению устойчивости золя. В таком случае ВМС играет роль флокулянта, то есть одна его молекула объединяет несколько частиц золя в агрегат. Флокуляция (лат. flocculi – хлопья) – это объединение коллоидных частиц в рыхлые хлопьевидные агрегаты. Часто в качестве флокулянтов используют полиэлектролитов. Защитное действие зависит от природы частиц золя и ВМС, степени дисперсности коллоидов, рН среды и присутствия примесей. Наибольшие защитные свойства проявляются тогда, когда знаки зарядов частиц золя и молекулы ВМС одинаковы. В результате адсорбции ВМС происходит увеличение заряда частицы, что приводит к дополнительному повышению устойчивости золя.
Защитное свойство ВМС по отношению к лиофобному золю количественно определяется так называемым золотым числом. Золотое число – это минимальное количество миллиграммов сухого защитного вещества, достаточное для защиты 10 мл красного золя золота от перемены окраски при добавлении к нему 1 мл 10%-ного раствора хлорида натрия. Иногда вместо золя золота используют золи серебра, красителя конго-рубинового, гидроксида железа и другие. Соответсвенно, находят различные защитные числа - серебряное, рубиновое, железное и т.п. числа. Указанные числа удобно представить, если они пересчитаны в миллиграммах на 1мг защищаемого вещества. Например, определение золотых чисел показывает, что для защиты на 1 мг коллоидного золота требуется всего 0,013 мг желатина, но намного больше крахмала – 41,5 мг. Коллоидная защита играет важную роль в выводе из организма различных нерастворимых солей, которые могут отложиться на суставах, в печени и в почках. Коллоидной защитой пользуются тогда, когда необходимо стабилизировать различные эмульсии и суспензии.
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 508; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.123 (0.026 с.) |
 - потенциала будет уменьшаться. Та наибольшая величина
- потенциала будет уменьшаться. Та наибольшая величина  <25 мВ эти золи коагулируют, а при
<25 мВ эти золи коагулируют, а при  ) в системе постепенно убывает. Аналогичный характер изменения имеет кривая для первичных частиц системы (
) в системе постепенно убывает. Аналогичный характер изменения имеет кривая для первичных частиц системы ( ). Кривая для вторичных частиц
). Кривая для вторичных частиц  ), образованных путем слияния двух первичных частиц, проходит через максимум. Такая же кривая получается для третичных частиц
), образованных путем слияния двух первичных частиц, проходит через максимум. Такая же кривая получается для третичных частиц  , образованных при столкновении вторичных и первичных частиц. Величина максимума убывает с уменьшением кратности частиц.
, образованных при столкновении вторичных и первичных частиц. Величина максимума убывает с уменьшением кратности частиц.
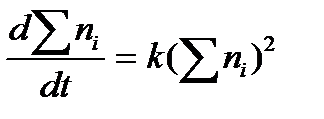 ,
, ,
, – коэффициент, учитывающий эффективность столкновений частиц (
– коэффициент, учитывающий эффективность столкновений частиц ( ).
). Нейтрализационная коагуляция сопровождается адсорбцией определенных ионов гранулой из дисперсионной среды. Коагуляцию золя вызывает только один вид ионов (катион или анион) добавленного электролита. Эти коагулирующие ионы имеют заряд, противоположный заряду гранулы и обладают большей адсорбируемостью, чем противоионы диффузного слоя мицеллы. После адсорбции коагулирующих ионов заряд гранулы уменьшается (
Нейтрализационная коагуляция сопровождается адсорбцией определенных ионов гранулой из дисперсионной среды. Коагуляцию золя вызывает только один вид ионов (катион или анион) добавленного электролита. Эти коагулирующие ионы имеют заряд, противоположный заряду гранулы и обладают большей адсорбируемостью, чем противоионы диффузного слоя мицеллы. После адсорбции коагулирующих ионов заряд гранулы уменьшается (
 . Это приводит к снижению порога коагуляции в 600…700 раз.
. Это приводит к снижению порога коагуляции в 600…700 раз.


