
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатные состояния вещества
В зависимости от внешних условий почти каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидком и газообразном. Важнейшими параметрами, определяющими агрегатные состояния веществ, являются величины сил межмолекулярных взаимодействий и размеры молекул. Чем больше эти величины, тем больше вероятность того, что вещество будет находиться в твердом состоянии.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
Межмолекулярные взаимодействия – это взаимодействия молекул между собой, которые не приводят к разрыву или образованию химических связей. От величины сил межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Уравнение состояния, учитывающее межмолекулярные взаимодействия и позволяющее объяснять свойства реальных газов и жидкостей, было предложено в 1873 году нидерландским физиком Й.Д.Ван-дер-Ваальсом. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми. Виды межмолекулярных взаимодействий. Основу этих взаимодействий составляют кулоновские силы, которые возникают между электронами и ядрами одной молекулы и ядрами и электронами другой молекулы. Ориентационные силы характеризуются наибольшей величиной. Они проявляются при взаимодействии полярных молекул или ионов и обусловлены наличием у них дипольных моментов. Индукционные силы возникают при контакте полярных молекул или ионов с неполярными молекулами. В этом случае у последних может индуцироваться дипольный момент, и взаимодействие также сводится к электростатическому взаимодействию. Однако проявляющиеся при этом силы будут значительно слабее. Дисперсионные силы возникают между неполярными молекула-ми за счет образования «мгновенных диполей». Эти силы значительно слабее рассмотренных ранее индукционных и ориентационных сил.
ТВЕРДОЕ СОСТОЯНИЕ Твердое вещество имеет определенную форму и оказывает сопротивление всякому действию, направленную на изменение его формы. Они могут быть кристаллическими и аморфными. Аморфные вещества характеризуются: - изотропностью – постоянством свойств (теплопроводности, электропроводности, механических свойств и другие) по всем направлениям внутри вещества;
- отсутствием определенного значения температуры плавления и наличием интервала размягчения (Ттв – Тж), который может иметь значение порядка десятков и даже сотен градусов. Кристаллические тела имеют: - анизотропию свойств, то есть свойства вещества в объеме в различных направлениях неодинаковы; - строго определенную температуру плавления; - определенную внешнюю геометрическую форму, зависящую от типа кристаллической решетки. Известно, что многие аморфные вещества можно получить в кристаллической форме и наоборот. Поэтому говорят не о кристаллических и аморфных веществах, а об аморфном и кристаллическом состоянии вещества. ЖИДКОЕ СОСТОЯНИЕ По своим свойствам жидкости занимают промежуточное положение между твердыми телами и газами. Как и твердые тела, они имеют высокую плотность и малую сжимаемость. Например, чтобы уменьшить объем воды на 1% требуется давление около 200 атм. Но, подобно газам, жидкости текучи и однородны по своим свойствам по всем направлениям, то есть изотропны. Силы межмолекулярного взаимодействия хотя и велики, но все же недостаточны, чтобы удерживать молекулы в определенных точках пространства. Поэтому молекулы ее совершают частые столкновения с ближайшими соседями и относительно более редкие перемещения, приводящие к смене окружения, чем в газах. Если силы межмолекулярного взаимодействия соизмеримы с силами, обуславливающими тепловые колебания, то в жидкости могут образоваться ассоциаты – комплексы, содержащие несколько молекул. К ассоциированным жидкостям относятся вода, спирты, жидкий аммиак, ацетон и другие. Возникновению ассоциатов способствует образование водородных связей между молекулами. Энергия водородной связи составляет от 20 до 42 кДж/моль, что значительно ниже энергии химических связей (140-560 кДж/моль для одинарных связей), но выше энергии ван-дер-ваальсовых сил. Наличием водородной связи объясняется ряд особенностей веществ: повышение температур кипения и плавления, отклонения в растворимости, особенности в спектрах и другие.
Из физических свойств жидкостей для химии наибольшее значение имеют поверхностное натяжение, вязкость и давление насыщен-ного пара. Поверхностное натяжение. Поверхностный слой жидкости по своим физико-химическим свойствам отличается от внутренних сло-ев. Силовое поле каждой молекулы внутри жидкости симметрично насыщено. В ином положении оказываются молекулы поверхностного слоя. На них действуют силы притяжения только молекул нижней полусферы. Равнодействующая межмолекулярных сил в этом случае не равна нулю и направлена вниз – в сторону объема жидкости. Поэтому молекулы поверхности находятся всегда под действием сил, стремящихся втянуть их внутрь жидкости. По этой причине поверхность жидкости всегда стремится сократиться. Некомпенсированные межмолекулярные силы, возникающие на поверхности, обуславливают появление свободной поверхностной энергии. Величина этой энергии количественно характеризуется поверхностным натяжением (
Поверхностное натяжение растворов зависит от природы растворенного вещества и от концентрации раствора. Вещества, снижающие поверхностное натяжение данной жидкости, называются поверхностно-активными (спирты, мыла, белки и другие). Добавление в воду таких веществ облегчает вспенивание. Вещества, повышающие поверхностное натяжение жидкости, называются поверхностно-неактивными (минеральные кислоты, щелочи, некоторые соли и другие). Вязкость жидкостей. Вязкость – это свойство жидкостей оказывать сопротивление перемещению одних слоев относительно других. Сила сопротивления направлена перпендикулярно направлению движения жидкости. Количественная характеристика этой силы выражается законом Ньютона: F = где F – сила трения, Н; Вязкость жидкостей зависит от температуры: с повышением температуры вязкость жидкостей понижается. На вязкость также сильно влияет давление. Примерно до 2000 атм вязкость жидкостей растет линейно, а выше – возрастает в геометрической прогрессии. Вязкостные характеристики растворов имеют значение при изучении свойств белков, углеводов и жиров. Вязкость растворов необходимо учитывать во многих технологических расчетах.
ГАЗООБРАЗНОЕ СОСТОЯНИЕ
Идеальным называется газ, находящийся в таких условиях, при которых можно пренебречь силами межмолекулярного взаимодейс-твия и объемом молекул. В реальных газах в какой-то степени проявляются силы межмолекулярного взаимодействия и необходимо принимать во внимание собственные объемы молекул. Законы идеальных газов. Состояние идеального газа определя-ется тремя параметрами: давлением р, объемом V и температурой Т. Эти величины связаны между собой уравнением состояния, которое вытекает из законов Бойля-Мариотта, Гей-Люссака и Шарля:
где V – объем газа при давлении p и температуре T; Vо – объем газа при давлении pо и температуре Tо .
Соотношение R = Для одного моля идеального газа уравнение состояния может быть записано в виде: рV = RT Для n молей идеального газа оно записывается в виде: рV = nRT (у равнение Клапейрона-Менделеева) Данное уравнение применяют для определения молярной массы газа и приведения объема газа к нормальным условиям. В этом случае n заменяют его значением: n = где m – масса газа; M – молярная масса газа. Тогда pV = M = Кинетическая теория газов дает возможность связать объем V и давление р со средней квадратичной скоростью движения молекул:
где u1, u2, u3, un – скорости движения отдельных молекул; рV = Выражая молярную массу М через массу отдельной молекулы газа m и число Авогадро N А ,можно написать: рV = В этом уравнении
где Ек – кинетическая энергия 1 молекулы идеального газа. Учитывая это: Ек = где k – газовая постоянная, отнесенная к одной молекуле, и называет-ся постоянной Больцмана. Для 1 моля газа уравнение имеет следующий вид: Ек = В реальных газах параметры, вычисленные по приведенным выше уравнениям, дают значительные отклонения от экспериментальных данных. Это проявляется в том, что произведение рV Силы межмолекулярного притяжения вызывают уменьшение объема газа и действуют на него, как некоторое добавочное давление к внешнему давлению, которое называют внутренним давлением. Оно пропорционально квадрату плотности р’=ad2, где а – величина, постоянная для данного газа. Поскольку плотность газа обратно пропорциональна его удельному объему d = 1/ V, то p’=a/V2. Кроме того, с возрастанием давления объем межмолекулярного пространства сильно уменьшается и необходимо учитывать объемы самих молекул. С учетом этих факторов для реальных газов в уравнении Менделеева-Клапейрона давление должно быть увеличено на некоторую величину a/V2 и объем уменьшен на некоторую величину b. Величина b примерно в четыре раза больше собственного объема молекул и называется несжимаемым объемом. Полученное таким образом уравнение состояния реальных газов называется уравнением Ван-дер-Ваальса:
(р + где а – коэффициент, учитывающий силы межмолекулярного притя-жения; b – коэффициент, учитывающий объемы молекул. Параметры а и b зависят от природы газа и приводятся в справочной литературе.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Термодинамика изучает взаимные превращения различных форм энергии. Химическая термодинамика изучает превращение энергии в химических процессах, а также энергетические характеристики веществ. Для успешного изучения вопросов, относящихся к химической термодинамике, необходимо уточнить некоторые понятия и термины. Энергия – это мера способности тела совершать работу. Из всех форм энергии для характеристики химических процессов наиболееважна внутренняя энергия (U) системы. Она складывается из энергий движения молекул, атомов, электронов и ядер, энергии межмолекулярных взаимодействий, внутриядерной энергии и других. Поскольку в системе возможно присутствие и неизвестных науке видов энергии, то измерить абсолютное значение внутренней энегии невозможно. Несмотря на это значимость ее в химической термодинамике высокая, так как можно непосредственно измерить величину изменения внутренней энергии (
где U 1 – внутренняя энергия начального состояния системы; U 2 – внутренняя энергия конечного состояния системы после завершения химического процесса. Величина 1 кал = 4,184 Дж. Система – это тело или совокупность тел, находящиеся во взаимодействии, которые выделены фактически или мысленно из окружающей среды. Особенность систем, которые рассматривает химическая термодинамика, заключается в том, что они состоят из большого числа атомов или молекул. Законы химической термодинамики неприменимы к отдельным атомам или молекулам. Системы бывают: – изолированные, которые не обмениваются с окружающей средой ни энергией, ни веществом (например, закрытый термос); – закрытые, которые обмениваются с окружающей средой энер-гией, но не обмениваются веществом (газ, находящийся в баллоне); – открытые, обменивающиеся с окружающей средой и энерги-ей, и веществом (любое биологическое тело). Фазой называется однородная часть системы, отличающаяся от других частей по своим физико-химическим свойствам. Гомогенная система не имеет внутри себя поверхностей раздела, которые отделяют отдельные ее части (фазы) друг от друга (например, вода, раствор NaCl). Системы, имеющие внутри поверхности раздела фаз, называются гетерогенными (например, суспензия почвы в воде). Параметры системы – физические величины, которые характеризуют состояние системы (объем, давление, концентрация, теплоемкость и т.д.). Параметры, которые можно непосредственно измерить с помощью приборов, называются основными (температура, давление и другие). Другие параметры, которые выражаются через основные, называются функциями состояния (внутренняя энергия, энтропия и т.д).
Процесс – изменение одного или нескольких параметров системы. Процессы бывают: – изотермические, протекающие при постоянной температуре (Т = const); – изобарические, которые происходят при постоянном давлении (р = const); – изохорические, идущие при постоянном объеме (V = const); – адиабатические, протекающие при постоянстве внутренней энергии (U = const); – политропические, характеризующиеся постоянной теплоемкостью (pV n = const). В биологических объектах поддерживается относительно постоянная температура, и процессы протекают при небольших колебаниях давления. Поэтому идущие в них процессы могут быть охарактеризованы как изобарно-изотермические процессы. Следовательно, для описания процессов, протекающих в биологических объектах, можно использовать закономерности, полученные для изобарно-изотермических процессов. В технологических процессах перерабатывающей промышленности сельскохозяйственной продукции возможны любые сочетания приведенных выше процессов. Например, процессы, проводимые в автоклавах при определенном температурном режиме, будут описываться закономерностями и параметрами изохорно-изотермических процессов. Термодинамика строится на основе трех фундаментальных принципов – начал термодинамики, которые являются обобщением многочисленных наблюдений и результатов экспериментов. Химическая термодинамика использует начала и законы термодинамики для изучения химических и физико-химических процессов.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Первое начало термодинамики представляет собой количественную формулировку закона сохранения энергии: во всех явлениях природы энергия не исчезает бесследно и не возникает из ничего; она может только превращаться из одной формы в другую в строго эквивалентных соотношениях. Чтобы выразить первый закон термодинамики в математической форме, ему придают следующую формулировку: при всяком процессе изменение внутренней энергии системы равно разности между количеством сообщенной системе теплоты и количеством работы, совершенной системой.
где Из приведенного уравнения следует, что если в условиях изобарного процесса работа совершается только против внешнего давления, то A = p где р – давление системы;
Тогда Q=∆U+p∆V или Q = (U2-U1) + p(V2-V1) Q = (U2+pV2) – (U1+pV1) Поскольку количество теплоты Q, полученное системой равно разности теплосодержаний конечного и исходного состояний, то соотношение (U+pV) имеет смысл теплосодержания системы H=U+pV Параметр Н назвали энтальпией. Энтальпия (от греч. еnthalpo – нагреваю) – функция состояния системы, которая отражает меру накопленной энергии в ней при данных условиях. Из последнего выражения следует, что энтальпия системы складывается из его внутренней энергии и объемной энергии (pV). Для твердых и жидких систем Н Как нельзя определить абсолютную величину U, так нельзя из-мерить и абсолютную величину Н. Однако этот факт ничуть не ума-ляет значимость понятия энтальпии, так как для процессов, проте-кающих в различных системах, можно определить величину
где
ТЕРМОХИМИЯ
Любые химические реакции, а также некоторые физические превращения веществ (плавление, испарение, конденсация, полиморфные превращения и другие) сопровождаются выделением или поглощением тепла, что является результатом изменения энтальпии (теплосодержания) системы. Количество выделяющейся или поглощающейся при этом теплоты называется тепловым эффектом процесса. Раздел физической химии и химической термодинамики, который изучает тепловые эффекты химических реакций, а также энергетические эффекты процессов перехода веществ из одного агрегатного состояния в другое или из одной кристаллической формы в другую называется термохимией. Термохимия также изучает теплоемкости веществ и зависимость их от температуры. Экзотермическими называются процессы, которые протекают с выделением тепла. В экзотермических процессах величина энтальпия системы уменьшается, т.е. Эндотермическими называются процессы, которые протекают с поглощением тепла. Для них Термохимические уравнения химических реакций записываются с указанием тепловых эффектов химических реакций, агрегатных состояний веществ и их кристаллических форм. Например, Н2(г) + 1/2О2(г) = Н2О(ж) С(алмаз)+ 2S(ромб.) = СS2(г) С целью облегчения математических расчетов в термохимических уравнениях допускается использование дробных стехиометрических коэффициентов. Тепловые эффекты многих химических и физических процессов определяют опытным путем с помощью калориметров или рассчитывают теоретически, используя теплоты образования и теплоты сгорания веществ. Теплота образования ( по отношению к нагреванию более устойчиво то соединение, энтальпия образования которого имеет более отрицательное значение. Теплота сгорания ( Параметры На основе многочисленных экспериментальных исследований русским ученым Г.И.Гессом был открыт основной закон термохимии (закон Гесса): тепловой эффект химической реакции не зависит от пути перехода (промежуточных реакций), а зависит только от вида и состояния исходных веществ и конечных продуктов. Например, теплота сгорания глюкозы в токе кислорода С6Н12О6
А где А,В,С...N – промежуточные продукты превращения глюкозы в организме;,
Из закона Гесса вытекают следующие важные следствия: 1.Тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ с учетом количества молей всех компонентов
где 2. Тепловой эффект реакции равен сумме теплот сгорания исходных реагентов минус сумма теплот сгорания продуктов реакции с учетом количества молей всех компонентов
Используя закон Гесса и его следствия можно теоретически рассчитывать тепловые эффекты химических реакций.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ Первое начало термодинамики не позволяет судить о направлении протекания химических реакций. Оно лишь констатирует не-уничтожимость и эквивалентность различных форм энергии при переходе системы из одного состояния в другое. Второе начало термодинамики определяет направление пр-вращения энергии, то есть указывает, какой процесс может протекать самопроизвольно (без сообщения энергии извне) при данных условиях (температуре, давлении, концентрации и др.). Например, опыт показывает, что теплота самопроизвольно переходит от более нагретого тела к менее нагретому, диффузия идет из области более высокой концентрации к более низкой, электричество передается от тела с более высоким потенциалом к телу с более низким потенциалом и другие. На основе многочисленных наблюдений за подобными процессами сформулировано второе начало термодинамики: в изолированных системах самопроизвольно протекают только те процессы, при которых энергия переходит от более высокого уровня на более низкий уровень. Таким образом, пределом, до которого протекает процесс, является состояние равновесия, которое характеризуется выравниванием уровней энергии и параметров системы - температуры, давления, концентрации и другие. Отсюда следует, что энтальпия системы полностью не может быть превращена в работу. Например, цинково-марганцевый химический источник тока (элемент Лекланше) может отдать часть энтальпии в виде электрической энергии. Но после этого в нем еще остается другая часть энтальпии, которую при данных условиях невозможно превратить в электрическую энергию. Поэтому энтальпию системы можно представить в виде двух слагаемых: Н = G + TS, где H – энтальпия системы; G – полезная часть энтальпии, способная производить работу, называемая свободной энергией системы; TS – непроизводительная часть энтальпии, которая не превращается в работу при данной температуре и называется связанной энергией, Т – температура системы; S – мера связанной энергии, называемая энтропией. В приведенной выше форме записи энтропию можно рассматривать как связанную энергию системы, приходящуюся на изменение ее температуры на 1о. Но так как количество связанной энергии системы определяется хаотическим движением ее частиц, то энтропию можно еще характеризовать как меру беспорядка в данной системе. Энтальпия (Н), свободная энергия (G) и энтропия (S) являются функциями состояния системы. Подобно энтальпии абсолютную величину свободной энергии системы определить невозможно. Но можно определить величину изменения свободной энергии (
В отличие от термодинамических функций Н и G, абсолютную величину энтропии веществ можно определить по уравнению Больцмана. Для 1 моля вещества уравнение имеет следующий вид: S = R lnW, где W – вероятность состояния системы, R – универсальная газовая постоянная. В стандартных условиях для различных веществ величина S 0 лежит в интервале 2... 700 Дж/(моль∙К) и приводится в справочной литературе для 1 моля вещества. В ряду однотипных соединений в зависимости от агрегатного состояния наблюдается следующая закономерность изменения энтропии S Зная параметры S 0 компонентов реакционной системы можно вычислить изменение ее энтропии
где
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 616; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.125.2 (0.096 с.) |
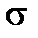 ). Оно выражается величиной работы А в джоулях, которую необходимо затратить для образования 1 м2 новой поверхности, или в единицах силы, действующей на единицу длины поверхности (Н/м2):
). Оно выражается величиной работы А в джоулях, которую необходимо затратить для образования 1 м2 новой поверхности, или в единицах силы, действующей на единицу длины поверхности (Н/м2): = А/S = Дж/м2 =(Н∙ м)/м2 = Н/м
= А/S = Дж/м2 =(Н∙ м)/м2 = Н/м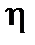 S
S 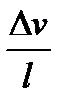 ,
, v – разность скоростей v 2 и v 1 этих слоев, м/с; l – расстояние между слоями,м.
v – разность скоростей v 2 и v 1 этих слоев, м/с; l – расстояние между слоями,м.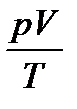 =
= 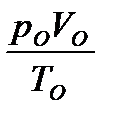 ,
, не зависит от природы и количества газа. Эта постоянная величина имеет размерность энергии (работы) и называ-ется универсальной газовой постоянной (R). Ее числовое значение в системе СИ равно:
не зависит от природы и количества газа. Эта постоянная величина имеет размерность энергии (работы) и называ-ется универсальной газовой постоянной (R). Ее числовое значение в системе СИ равно:
 = 8,314 103Дж/(кмоль∙К) или R = 8,314 Дж/(моль∙К).
= 8,314 103Дж/(кмоль∙К) или R = 8,314 Дж/(моль∙К). ,
,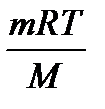 . Отсюда
. Отсюда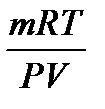 .
.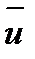 =
= 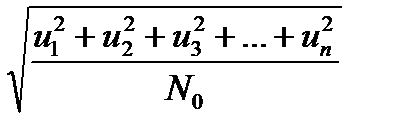 ,
,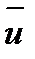 – средняя квадратичная скорость движения молекул; N0 – число всех молекул. Если взять 1 моль газа, то
– средняя квадратичная скорость движения молекул; N0 – число всех молекул. Если взять 1 моль газа, то M
M  NA
NA 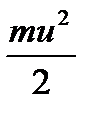 = RT
= RT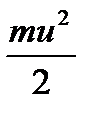 = Ек ,
= Ек ,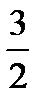
 =
= 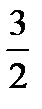 kT,
kT,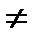 const при постоянной температуре и объем 1 моля реального газа при нормальных условиях не равен 22,4 л.
const при постоянной температуре и объем 1 моля реального газа при нормальных условиях не равен 22,4 л.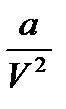 )(V – b) = nRT,
)(V – b) = nRT, U. Но для газообразных систем необходимо учитывать объемную энергию и поэтому Н>U.
U. Но для газообразных систем необходимо учитывать объемную энергию и поэтому Н>U. ) - это количество выделяющейся или поглощающейся теплоты при образовании 1 моля сложного ве-щества из простых веществ при стандартных условиях (Т = 298К, или 25ОС, и р = 101,325 кПа, или 1 атм).
) - это количество выделяющейся или поглощающейся теплоты при образовании 1 моля сложного ве-щества из простых веществ при стандартных условиях (Т = 298К, или 25ОС, и р = 101,325 кПа, или 1 атм). 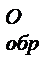 = 0 для всех простых веществ. Среди соединений одного и того же класса соблюдается следующая зависимость:
= 0 для всех простых веществ. Среди соединений одного и того же класса соблюдается следующая зависимость: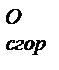 ) – это количество выделяющейся теплоты при полном окислении 1 моля простого или сложного вещества при стандартных условиях.
) – это количество выделяющейся теплоты при полном окислении 1 моля простого или сложного вещества при стандартных условиях.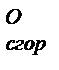 веществ можно найти в справочниках.
веществ можно найти в справочниках.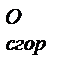 = -2818 кДж/моль. Согласно закону Гесса такое же значение будет иметь тепловой эффект превращения глюкозы до СО2 и Н2О в организме животного и человека, то есть:
= -2818 кДж/моль. Согласно закону Гесса такое же значение будет иметь тепловой эффект превращения глюкозы до СО2 и Н2О в организме животного и человека, то есть: 6СО2 + 6 Н2О
6СО2 + 6 Н2О


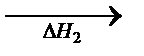 В
В 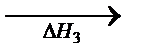 С
С  ...
... 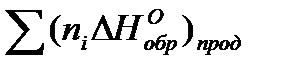 -
- 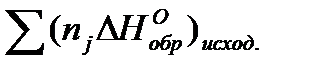 ,
, - тепловой эффект реакции; ni и nj – стехиометрические коэффициенты соответственно продуктов реакции и исходных реагентов.
- тепловой эффект реакции; ni и nj – стехиометрические коэффициенты соответственно продуктов реакции и исходных реагентов.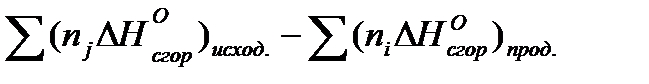
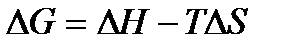
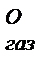 > S
> S  > S
> S 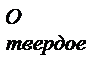 . Значение S 0 также зависит от сложности состава молекулы. Например, для газообразного кислорода это значение составляет 205,04 Дж/(моль∙К), а для твердого кристаллогидрата Al(NH4)(SO4)2∙12H2O – 681 Дж/(моль∙К).
. Значение S 0 также зависит от сложности состава молекулы. Например, для газообразного кислорода это значение составляет 205,04 Дж/(моль∙К), а для твердого кристаллогидрата Al(NH4)(SO4)2∙12H2O – 681 Дж/(моль∙К).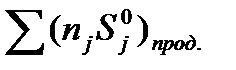 -
- 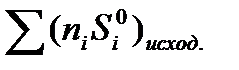 ,
,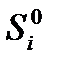 и
и  - соответственно, абсолютные энтропии исходных реагентов и продуктов реакции; ni и nj – стехиометрические коэффициенты реагентов и продуктов в уравнении реакции.
- соответственно, абсолютные энтропии исходных реагентов и продуктов реакции; ni и nj – стехиометрические коэффициенты реагентов и продуктов в уравнении реакции.


