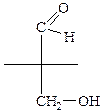Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сопряжение и электронные эффекты заместителей
Сопряжение – это слияние двух или нескольких p-электронных облаков в молекуле с чередующимися p-связями и образование общего делокализованного более устойчивого p-электронного облака. Это p,p-сопряжение.
единое p-электронное облако
 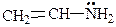
Системы с замкнутой цепью сопряжения называют ароматическими. Правило ароматичности Хюккеля: соединение ароматично, если оно:
(6ē) (10ē) (6ē)
Взаимное влияние атомов в молекуле Электронное облако в молекуле может быть распределено равномерно, при этом ковалентные связи неполярны, например, в этане и этилене: CH3 – CH3 CH2=CH2 Заместители обычно поляризуют молекулу. Они смещают электронное облако (электронную плотность) к себе или от себя.
Виды электронных эффектов
Донорный или акцепторный характер заместителей определяется совместным действием двух электронных эффектов: индуктивного и мезомерного. При разных знаках эффектов, мезомерный эффект оказывается значительно сильнее индуктивного (за исключением галогенов).
Порядок определения характера заместителя
1. 2. Рядом с каждым заместителем записать две буквы I и M, обозначающие индуктивный и мезомерный эффекты. 3. Обозначить стрелкой полярность σ-связи между заместителем и углеродом, с которым он связан. Это графическое изображение I-эффекта. 4. 5. Определить участие заместителя в общей цепи сопряжения. 6. 7. При наличии сопряжения определить характер этого сопряжения: π,π или p,π 8. Изогнутыми стрелками, начиная с заместителя, показать смещение электронного облака по всей цепи сопряжения. Это графическое изображение М-эффекта. 9. 10. Характер заместителя определяется а) одинаковым знаком I и М эффектов б) при разных знаках, обычно М>>I (кроме га- логенов)
Задание для самопроверки: Определите характер заместителей (ЭД или ЭА), указав: - стрелками смещение электронной плотности - вид сопряжения, вид электронных эффектов 1. этиламин и анилин (аминогруппы), 2. этанол и фенол (гидроксигруппы), 3. пропеналь и бензальдегид (оксогруппы), 4. циклогексанкарбоновая и бензойная кислоты (карбоксильная группа), 5. нитробензол и 1-нитропропан (нитрогруппы), 6. 1-хлорбутан и 1-хлорбутен-1 (хлора), 7. 3,3,3-трифторпропен (трифторметильной группы), 8. бензолсульфокислота (сульфогруппы), 9. 3-нитротолуол (обоих заместителей), 10. пара-аминобензальдегид (обоих заместителей). Кислотность и основность органических соединений Протонная теория кислот и оснований Бренстеда и Лоури рассматривает взаимодействие между кислотой и основанием как передачу протона одним веществом (кислотой) другому веществу (основанию).
Кислоты Бренстеда – это вещества, способные отдавать протон (доноры протона). Вещество проявляет кислотные свойства только, если есть акцептор протона. Поэтому следующая запись является условной:
НА ® Н+ + А― кислота сопряженное основание Органические вещества способны отдавать протон, если в них имеется сильнополярная ковалентная связь, способная разорваться гетеролитически:
Элемент и связанный с ним «протонированный» атом водорода называют кислотным центром. В зависимости от этого различают 4 типа кислот Бренстеда: СН, NH, OH, SH. Количественной характеристикой силы кислоты (т.е. легкости отдачи протона) является величина константы кислотности Ка и рКа. При качественной оценке силы кислот критерием является стабильность сопряженного основания (аниона).
Стабильность аниона определяется степенью делокализации заряда, т.е. рассредоточение его по всей молекуле.
Стабильность увеличивается: 1. С наличием электроноакцепторных заместителей в радикале, связанном с кислотным центром: СН3→СО ОН < Cl←CH2←CO OH
2.
CH3 – CH2 – OH < (p,p - сопряжение внутри карбоксильной группы) 3. С повышением радиуса атома в кислотном центре CH3 – OH < CH3 – SH (атом серы больше по радиусу, чем атом кислорода, поэтому (-) заряд в анионе RS- делокализован в большей сте- пени, чем в RO-)
4. С увеличением электроотрицательности атома в кислотном центре, т.к. при этом повышается степень «протонированности» атома водорода. CH3 – NH2 < CH3 – OH (связь ОН более поляризована, чем NH, легче разрывается гетеролитически) Основания Бренстеда – это вещества, способные присоединять протон (акцепторы протона). Это либо анионы, либо молекулы, которые должны иметь атом, содержащий неподеленную пару электронов, для образования связи с протоном – основный центр (O, N, S, галогены).
основание сопряженная кислота На основность оказывают влияние те же факторы, которые влияют на кислотность, но их влияние противоположно:
Метиламин – более сильное основание, поскольку его катион более устойчив, чем NH4+, т.к. рядом с основным центром имеется донорный заместитель, восполняющий электронную плотность в катионе.
Самыми сильными органическими основаниями являются амины: RSH < ROH < RNH2
Чтобы сравнить силу кислот (или оснований) необходимо: 1. Подчеркнуть кислотные (основные) центры в молекулах 2. Если они одинаковы, то сравнить влияния радикалов на кислотный (основный) центр. Электронодонорные заместители уменьшают силу кислоты, но увеличивают силу основания. 3. Если одинаковы радикалы, то сравнить влияния атома в кислотном (основном) центре, т.е. его размер или электроотрицательность.
Пример: какое вещество является более сильной кислотой: метанол или фенол?
одинаковые кислотные центры
ЭД ЭА За счет сопряжения в феноле связь О–Н становится более полярной, чем в спирте, следовательно, легче разрывается. Образующийся в результате разрыва фенолят-анион более устойчив, чем алкоголят-анион, т.к. его отрицательный заряд делокализован на бензольном кольце за счет сопряжения. Вывод: фенол является более сильной кислотой, чем спирт и способен реагировать со щелочами, в отличие от спиртов.
Задание для самопроверки: 1. Cравните кислотность следующих соединений: а) уксусная и масляная (бутановая) кислоты б) этанол и вода в) фенол и уксусная кислота (напишите реакцию с NaOH и Ca(OH)2 для более сильной кислоты) 2. Cравните основность следующих соединений: а) этиламин и диэтиламин б) этиламин и анилин в) этанол и 2-хлорэтанол г) аммиак и анилин (для более слабого основания напишите реакцию с HCl)
СТЕРЕОИЗОМЕРИЯ
Стереоизомеры – это изомеры, имеющие одинаковый состав и химическое строение, отличаются расположением атомов относительно друг друга в пространстве. Энантиомеры – один из видов стереоизомеров, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение (их называют также зеркальными или оптическими изомерами). В виде энантиомеров могут существовать только хиральные молекулы, т.е. молекулы, имеющие асимметрический атом углерода. Это атом углерода в Sp3 гибридизации, связанный с четырьмя разными заместителями. Для изображения объемных молекул энантиомеров на плоскости используют проекционные формулы Фишера.
1.
2. Отметить звездочкой асимметрический атом углерода
3. Изобразить асимметрический атом углерода в виде прямого креста (4 конца = 4 заместителя)
4. Расположить углеродную цепь вертикально со старшей группой наверху
5. На концах горизонтальной черты записать два оставшихся заместителя
6. Та формула, в которой OH или NH2 группа на горизонтальной оси стоит справа, изображает стереоизомер D-ряда, а если слева, то L-ряда.
|






 При р,p-сопряжении в образовании общего электронного облака принимают участие p-электроны двойной связи и р-электроны неподеленной электронной пары гетероатома (N, O, Cl и др.).
При р,p-сопряжении в образовании общего электронного облака принимают участие p-электроны двойной связи и р-электроны неподеленной электронной пары гетероатома (N, O, Cl и др.).




 ЭА
ЭА
 СН2=СН―ОН
СН2=СН―ОН
 ЭД
ЭД



 Записать структурную формулу соединения, выделить заместитель.
Записать структурную формулу соединения, выделить заместитель. Указать знак частичного δ заряда на заместителе. Он будет являться знаком индуктивного эффекта.
Указать знак частичного δ заряда на заместителе. Он будет являться знаком индуктивного эффекта. Если сопряжение заместителя отсутствует, то мезомерный эффект тоже отсутствует, М=0. Тогда характер заместителя определяется только по знаку индуктивного эффекта, т.е. при +I эффекте – электронодонорный, при -I – электроноакцепторный.
Если сопряжение заместителя отсутствует, то мезомерный эффект тоже отсутствует, М=0. Тогда характер заместителя определяется только по знаку индуктивного эффекта, т.е. при +I эффекте – электронодонорный, при -I – электроноакцепторный. Указать знак образовавшегося на заместителе δ заряда за счет смещения электронного облака. Он совпадает со знаком мезомерного эффекта.
Указать знак образовавшегося на заместителе δ заряда за счет смещения электронного облака. Он совпадает со знаком мезомерного эффекта.
 А • • Н
А • • Н
 Благодаря стабилизации аниона за счет сопряжения:
Благодаря стабилизации аниона за счет сопряжения:

 Вывод:
Вывод:

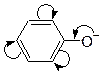

 Порядок написания формул Фишера:
Порядок написания формул Фишера: Написать структурную формулу, подчеркнуть старшую функциональную группу
Написать структурную формулу, подчеркнуть старшую функциональную группу