
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биополимеры и их структурные компонентыСтр 1 из 9Следующая ⇒
СОПРЯЖЕНИЕ и ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
Сопряжение – это слияние двух или нескольких p-электронных облаков в молекуле с чередующимися p-связями и образование общего делокализованного более устойчивого p-электронного облака. Это p,p-сопряжение.
единое p-электронное облако
 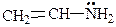
Системы с замкнутой цепью сопряжения называют ароматическими. Правило ароматичности Хюккеля: соединение ароматично, если оно:
(6ē) (10ē) (6ē)
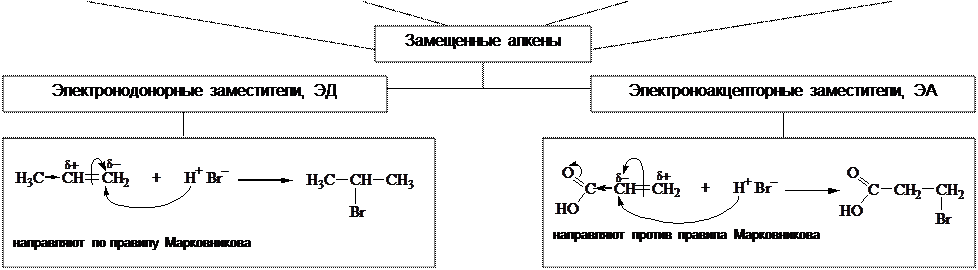
Взаимное влияние атомов в молекуле Электронное облако в молекуле может быть распределено равномерно, при этом ковалентные связи неполярны, например, в этане и этилене: CH3 – CH3 CH2=CH2 Заместители обычно поляризуют молекулу. Они смещают электронное облако (электронную плотность) к себе или от себя.
Виды электронных эффектов
Донорный или акцепторный характер заместителей определяется совместным действием двух электронных эффектов: индуктивного и мезомерного. При разных знаках эффектов, мезомерный эффект оказывается значительно сильнее индуктивного (за исключением галогенов).
Порядок определения характера заместителя
1. 2. Рядом с каждым заместителем записать две буквы I и M, обозначающие индуктивный и мезомерный эффекты. 3. Обозначить стрелкой полярность σ-связи между заместителем и углеродом, с которым он связан. Это графическое изображение I-эффекта. 4. 5. Определить участие заместителя в общей цепи сопряжения. 6. 7. При наличии сопряжения определить характер этого сопряжения: π,π или p,π 8. Изогнутыми стрелками, начиная с заместителя, показать смещение электронного облака по всей цепи сопряжения. Это графическое изображение М-эффекта. 9. 10. Характер заместителя определяется а) одинаковым знаком I и М эффектов б) при разных знаках, обычно М>>I (кроме га- логенов)
Задание для самопроверки: Определите характер заместителей (ЭД или ЭА), указав: - стрелками смещение электронной плотности - вид сопряжения, вид электронных эффектов 1. этиламин и анилин (аминогруппы), 2. этанол и фенол (гидроксигруппы), 3. пропеналь и бензальдегид (оксогруппы), 4. циклогексанкарбоновая и бензойная кислоты (карбоксильная группа), 5. нитробензол и 1-нитропропан (нитрогруппы), 6. 1-хлорбутан и 1-хлорбутен-1 (хлора), 7. 3,3,3-трифторпропен (трифторметильной группы), 8. бензолсульфокислота (сульфогруппы), 9. 3-нитротолуол (обоих заместителей), 10. пара-аминобензальдегид (обоих заместителей). Кислотность и основность органических соединений Протонная теория кислот и оснований Бренстеда и Лоури рассматривает взаимодействие между кислотой и основанием как передачу протона одним веществом (кислотой) другому веществу (основанию).
Кислоты Бренстеда – это вещества, способные отдавать протон (доноры протона). Вещество проявляет кислотные свойства только, если есть акцептор протона. Поэтому следующая запись является условной:
НА ® Н+ + А― кислота сопряженное основание Органические вещества способны отдавать протон, если в них имеется сильнополярная ковалентная связь, способная разорваться гетеролитически:
Элемент и связанный с ним «протонированный» атом водорода называют кислотным центром. В зависимости от этого различают 4 типа кислот Бренстеда: СН, NH, OH, SH. Количественной характеристикой силы кислоты (т.е. легкости отдачи протона) является величина константы кислотности Ка и рКа. При качественной оценке силы кислот критерием является стабильность сопряженного основания (аниона).
Стабильность аниона определяется степенью делокализации заряда, т.е. рассредоточение его по всей молекуле.
Стабильность увеличивается: 1. С наличием электроноакцепторных заместителей в радикале, связанном с кислотным центром: СН3→СО ОН < Cl←CH2←CO OH
2.
CH3 – CH2 – OH < (p,p - сопряжение внутри карбоксильной группы) 3. С повышением радиуса атома в кислотном центре CH3 – OH < CH3 – SH (атом серы больше по радиусу, чем атом кислорода, поэтому (-) заряд в анионе RS- делокализован в большей сте- пени, чем в RO-)
4. С увеличением электроотрицательности атома в кислотном центре, т.к. при этом повышается степень «протонированности» атома водорода. CH3 – NH2 < CH3 – OH (связь ОН более поляризована, чем NH, легче разрывается гетеролитически) Основания Бренстеда – это вещества, способные присоединять протон (акцепторы протона). Это либо анионы, либо молекулы, которые должны иметь атом, содержащий неподеленную пару электронов, для образования связи с протоном – основный центр (O, N, S, галогены).
основание сопряженная кислота На основность оказывают влияние те же факторы, которые влияют на кислотность, но их влияние противоположно:
Метиламин – более сильное основание, поскольку его катион более устойчив, чем NH4+, т.к. рядом с основным центром имеется донорный заместитель, восполняющий электронную плотность в катионе.
Самыми сильными органическими основаниями являются амины: RSH < ROH < RNH2
Чтобы сравнить силу кислот (или оснований) необходимо: 1. Подчеркнуть кислотные (основные) центры в молекулах 2. Если они одинаковы, то сравнить влияния радикалов на кислотный (основный) центр. Электронодонорные заместители уменьшают силу кислоты, но увеличивают силу основания. 3. Если одинаковы радикалы, то сравнить влияния атома в кислотном (основном) центре, т.е. его размер или электроотрицательность.
Пример: какое вещество является более сильной кислотой: метанол или фенол?
одинаковые кислотные центры
ЭД ЭА За счет сопряжения в феноле связь О–Н становится более полярной, чем в спирте, следовательно, легче разрывается. Образующийся в результате разрыва фенолят-анион более устойчив, чем алкоголят-анион, т.к. его отрицательный заряд делокализован на бензольном кольце за счет сопряжения.
Вывод: фенол является более сильной кислотой, чем спирт и способен реагировать со щелочами, в отличие от спиртов. Задание для самопроверки: 1. Cравните кислотность следующих соединений: а) уксусная и масляная (бутановая) кислоты б) этанол и вода в) фенол и уксусная кислота (напишите реакцию с NaOH и Ca(OH)2 для более сильной кислоты) 2. Cравните основность следующих соединений: а) этиламин и диэтиламин б) этиламин и анилин в) этанол и 2-хлорэтанол г) аммиак и анилин (для более слабого основания напишите реакцию с HCl)
СТЕРЕОИЗОМЕРИЯ
Стереоизомеры – это изомеры, имеющие одинаковый состав и химическое строение, отличаются расположением атомов относительно друг друга в пространстве. Энантиомеры – один из видов стереоизомеров, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение (их называют также зеркальными или оптическими изомерами). В виде энантиомеров могут существовать только хиральные молекулы, т.е. молекулы, имеющие асимметрический атом углерода. Это атом углерода в Sp3 гибридизации, связанный с четырьмя разными заместителями. Для изображения объемных молекул энантиомеров на плоскости используют проекционные формулы Фишера.
1.
2. Отметить звездочкой асимметрический атом углерода
3. Изобразить асимметрический атом углерода в виде прямого креста (4 конца = 4 заместителя)
4. Расположить углеродную цепь вертикально со старшей группой наверху
5. На концах горизонтальной черты записать два оставшихся заместителя
6. Та формула, в которой OH или NH2 группа на горизонтальной оси стоит справа, изображает стереоизомер D-ряда, а если слева, то L-ряда.
ЭЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ
+
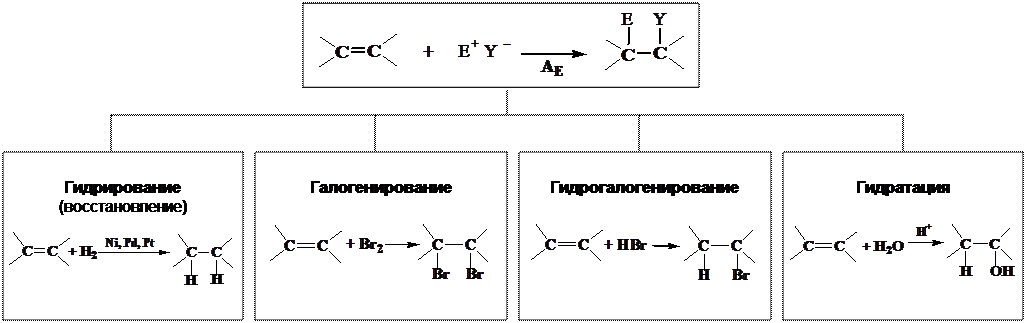
Реакции электрофильного присоединения к алкенам, AE
Алкены: · Ненасыщенные соединения. Вступают в реакции присоединения по двойной связи. · В углеродной цепи алкенов имеется отрицательно заряженное объёмное π-электронное облако, которое притягивает электрофил, Е+:
Следовательно, для алкенов наиболее характерны реакции присоединения электрофила, АЕ.
ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ К АЛКЕНАМ, АЕ
Реакции электрофильного замещения в ароматических соединениях, SE.
Арены: · Имеют единое циклическое π-электронное облако, заряженное отрицательно. Оно притягивает электрофилы, Е+. · В реакциях стремятся сохранить ароматичность, т.е. свое единое электронное облако. Поэтому вступают преимущественно в реакции замещения водорода в бензольном кольце на электрофил, т.е. в реакции SE.
ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРОМАТИЧЕСКОМ РЯДУ, SE
Вопросы для самопроверки «Реакции углеводородов»
Напишите уравнения реакций, указав условия, тип реакции (SR, AE, SE), электронные эффекты заместителей (где необходимо).
НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА, СВЯЗАННОГО С ГЕТЕРОАТОМОМ, SN
Реакции алкилирования нуклеофила
Вопросы для самопроверки «Нуклеофильное замещение, окисление органических соединений» (Напишите уравнения реакции. Укажите реакционные центры, уходящую группу, направление атаки нуклеофила.)
Как лекарственные средства
Строение биологически значимых гетероциклов биополимеры и их структурные компоненты
углеводы
моносахаридЫ. Классификация
Циклооксотаутомерия моносахаридов в водных растворах
D-глюкоза Гликаровые кислоты 2.
[ H+ ]
D-фруктоза D-глюцит (сорбит) Маннит Образование гликозидов.
H+
a-D-глюкопираноза этил-a-D-глюкопиран озид
a-D-глюкопираноза пентаацетилглюкоза 5.
СН3J
6. Эпимеризация (взаимопревращение моносахаридов)
a-СН-кислотный
т аутомерия т аутомерия альдоза ен-диол кетоза
Дисахариды
Это гликозиды:
1. Восстанавливающие – способны окисляться до кислот (т.е. быть восстано-вителями), т.к. благодаря оставшемуся гликозидному гидроксилу второй цикл может раскрываться (мальтоза, лактоза, целлобиоза):
+
гликозидная спиртовая a-форма a-1,4-гликозидная связь группа группа a-D-глюкопиранозил-1®4- a -D-глюкопираноза
окисление
B-форма a-D-глюкопиранозил-1®4- b -D-глюкопираноза
2.
гликозидные 1,2-гликозидная связь
a-D-глюкопиранозил-(1®2)- b -D-фруктофуранозид ПОЛИСАХАРИДЫ
Гомополисахариды Гетерополисахариды Амилоза
a(1→4)-гликозидная связь Амилопектин (n =20-25) Гликоген (животный крахмал) (n=10)
a(1→4
n Гиалуроновая кислота
─ D-глюкуроновая кислота – b(1®3)–N-ацетилглюкозамин ─
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.165.246 (0.22 с.) |






 При р,p-сопряжении в образовании общего электронного облака принимают участие p-электроны двойной связи и р-электроны неподеленной электронной пары гетероатома (N, O, Cl и др.).
При р,p-сопряжении в образовании общего электронного облака принимают участие p-электроны двойной связи и р-электроны неподеленной электронной пары гетероатома (N, O, Cl и др.).




 ЭА
ЭА
 СН2=СН―ОН
СН2=СН―ОН
 ЭД
ЭД



 Записать структурную формулу соединения, выделить заместитель.
Записать структурную формулу соединения, выделить заместитель. Указать знак частичного δ заряда на заместителе. Он будет являться знаком индуктивного эффекта.
Указать знак частичного δ заряда на заместителе. Он будет являться знаком индуктивного эффекта. Если сопряжение заместителя отсутствует, то мезомерный эффект тоже отсутствует, М=0. Тогда характер заместителя определяется только по знаку индуктивного эффекта, т.е. при +I эффекте – электронодонорный, при -I – электроноакцепторный.
Если сопряжение заместителя отсутствует, то мезомерный эффект тоже отсутствует, М=0. Тогда характер заместителя определяется только по знаку индуктивного эффекта, т.е. при +I эффекте – электронодонорный, при -I – электроноакцепторный. Указать знак образовавшегося на заместителе δ заряда за счет смещения электронного облака. Он совпадает со знаком мезомерного эффекта.
Указать знак образовавшегося на заместителе δ заряда за счет смещения электронного облака. Он совпадает со знаком мезомерного эффекта.
 А • • Н
А • • Н
 Благодаря стабилизации аниона за счет сопряжения:
Благодаря стабилизации аниона за счет сопряжения:

 Вывод:
Вывод:

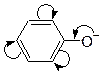

 Порядок написания формул Фишера:
Порядок написания формул Фишера: Написать структурную формулу, подчеркнуть старшую функциональную группу
Написать структурную формулу, подчеркнуть старшую функциональную группу
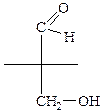





















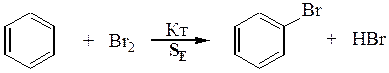
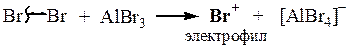






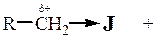





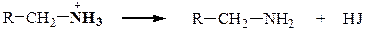









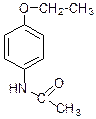
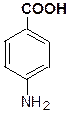
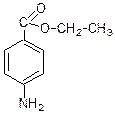

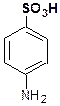
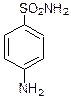



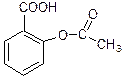
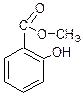
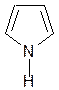
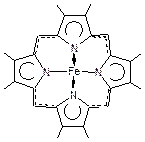 Гем
Гем
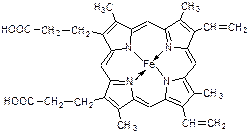
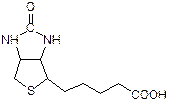 Биотин(витамин Н)
Биотин(витамин Н)
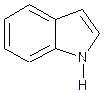
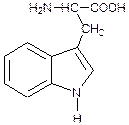 Триптофан
Триптофан
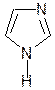
 Гистидин
Гистидин 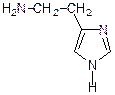 Гистамин
Гистамин

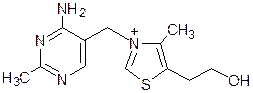 Тиамин (витамин В1)
Тиамин (витамин В1)
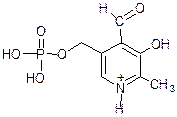
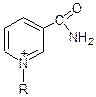 Никотинамид Пиридоксальфосфат НАД+ (активный центр)
Никотинамид Пиридоксальфосфат НАД+ (активный центр)
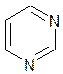
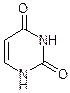
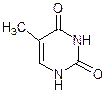
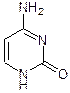
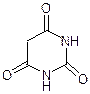
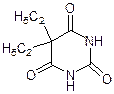 Урацил Тимин Цитозин Барбитурат Барбитал
Урацил Тимин Цитозин Барбитурат Барбитал

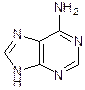
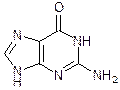
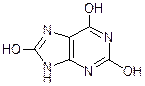
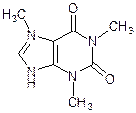 Аденин Гуанин Мочевая кислота Кофеин
Аденин Гуанин Мочевая кислота Кофеин







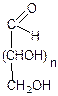
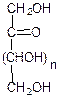





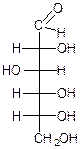
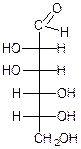



 L-глюкоза D-глюкоза D-манноза D-галактоза
Энантиомеры Эпимеры по С2 Диастереомеры
L-глюкоза D-глюкоза D-манноза D-галактоза
Энантиомеры Эпимеры по С2 Диастереомеры


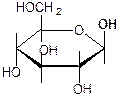

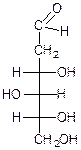
 D-2-дезоксиглюкоза D-2-дезокси-2-аминоглюкоза
D-2-дезоксиглюкоза D-2-дезокси-2-аминоглюкоза
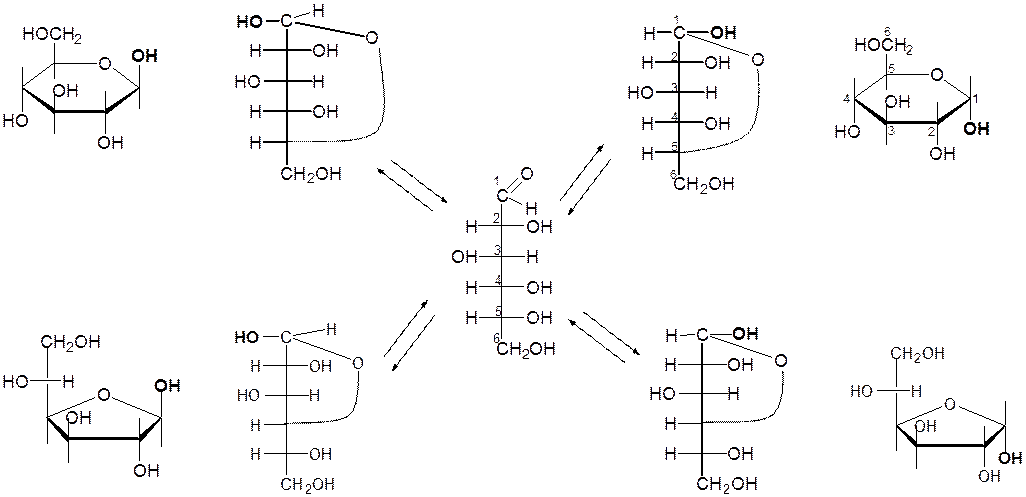

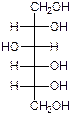 Восстановление (до спиртов).
Восстановление (до спиртов).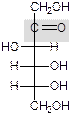
 +
+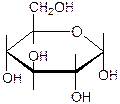


 +
+ ─ H2O
─ H2O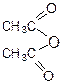
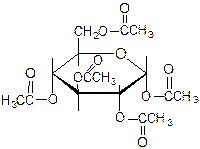 4. Ацилирование.
4. Ацилирование.
 Алкилирование.
Алкилирование. пентаметилглюкоза
пентаметилглюкоза


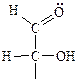
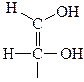


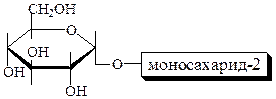

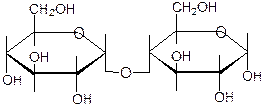






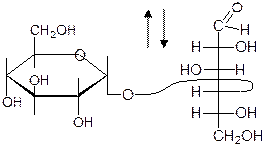



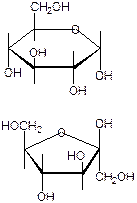 Невосстанавливающие – не могут окисляться.
Невосстанавливающие – не могут окисляться.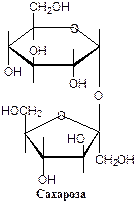




 гидроксилы
гидроксилы ─ Н2О
─ Н2О

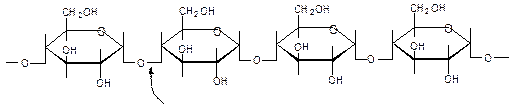


 a(1→6)
a(1→6)
 )
)




