
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концентрационные пределы распространения пламени
Смеси горючих газов и паров с воздухом способны воспламеняться и распространять пламя только тогда, когда концентрация горючего в них находится в определенных ограниченных пределах, которые называются нижним (НКПР) и верхним (ВКПР) пределами распространения пламени. В пределах одного гомологического ряда с увеличением относительной молекулярной массы пределы распространения пламени, выраженные в объемных процентах, уменьшаются. На нижнем пределе теплота сгорания большинства углеводородов соответствует примерно величине 1830-2050 кДж/м3, а адиабатическая температура горения равна 1500 К±110 К. Эти данные свидетельствуют о том, что для воспламенения горючих веществ и распространения пламени необходимы определенные условия. Концепции предельных температур и теплоты сгорания использованы при создании методик расчета нижнего концентрационного предела распространения пламени. С увеличением температуры, как и следует из сущности предельных явлений, область распространения пламени расширяется, а с уменьшением давления сужается. Концентрационные пределы распространения пламени изменяются и от ряда других причин: присутствия в смеси флегматизатора или ингибитора, мощности источника зажигания. Концентрационные пределы распространения пламени (КПР) являются едва ли не основной характеристикой пожароопасных свойств веществ и материалов. Мощность зажигающей искры, температура самовоспламенения, температура горения имеют смысл только внутри концентрационной области распространения пламени. Пределы распространения пламени веществ и материалов определяют расчетными и экспериментальными методами. Наряду с принятой системой определения пределов по концентрации горючего в смеси, в последние годы для твердых горючих материалов стал довольно широко применяться предел распространения пламени по кислороду, который находится экспериментально и носит название кислородного индекса (КИ). Этот параметр также зависит от давления, температуры. Кислородный индекс характеризует то минимальное содержание кислорода в смеси с азотом, при котором возможно воспламенение горючего материала с его последующим горением. Пределы распространения пламени применяются в практике для классификации производств по степени их пожарной опасности, при расчете предельно допустимых концентраций горючих паров и газов в помещениях при производстве огневых работ, для расчета взрывоопасных режимов работ в среде, содержащей горючие газы и пары.
Исходя из важности КПР, в данных методических указаниях приведены примеры расчета концентрационных и температурных пределов распространения пламени.
4.2.1. Расчет КПР по аппроксимационной формуле
Газовая смесь горючего с окислителем способна воспламеняться и распространять пламя только при определенных концентрациях горючего. Минимальная концентрация горючего, при которой смесь способна воспламеняться и распространять пламя, называется нижним концентрационным пределом распространения пламени (НКПР), а максимальная концентрация горючего - верхним концентрационным пределом распространения пламени (ВКПР). При концентрациях горючего ниже НКПР и выше ВКПР его смеси с воздухом негорючи. Скорость распространения пламени и его температура минимальны в предельных смесях, т.е. при концентрациях горючего, равных НКПР и ВКПР. Максимальные значения скорости и температуры пламени, как правило, имеют смеси стехиометрического состава. Поэтому эти смеси наиболее пожаровзрывоопасны. Концентрацию горючего в стехиометрической смеси рассчитывают по уравнению горения. Например, из уравнения горения видно, что стехиометрическая смесь метана с воздухом содержит 1 моль метана, 2 моля кислорода и 2×3,76 молей азота. Концентрация горючего в такой смеси CH4 + 2O2 + 2×3,76N2 = CO2 + 2H2O + 2×3,76N2
стехиометрическая смесь
Значения концентрационных пределов распространения пламени, приведенные в справочной литературе, установлены экспериментально. Для большинства веществ они могут быть приближенно рассчитаны по формулам. По аппроксимационной формуле можно рассчитывать значения как нижнего, так и верхнего концентрационных пределов распространения пламени
где: n - число молей кислорода, необходимое для полного сгорания одного моля горючего вещества, находим из уравнения реакции горения (стехиометрический коэффициент при кислороде);
a и b - константы, имеющие определенные значения для нижнего и верхнего пределов в зависимости от значения n, приведены в табл. 5. Таблица 5
Пример 1. Рассчитать КПР бутана в воздухе. Расчет провести по аппроксимационной формуле. Решение. Для расчета необходимо знать число молей кислорода, необходимое для полного сгорания 1 моля бутана. Запишем уравнение горения бутана С4H10 + 6,5O2 = 4CO2 + 5H2O. Из уравнения видно, что n = 6,5. Рассчитываем нижний концентрационный предел распространения пламени по аппроксимационной формуле, воспользовавшись значениями a и b из табл. 5,
Аналогично находим верхний концентрационный предел, учитывая, что n < 7,5 (см. табл. 5).
Экспериментальные значения КПРП, приводимые в справочной литературе, составляют 1,86 % и 8,41 %. Сравнивая их с расчетными, убеждаемся, что для бутана расхождение расчетных и экспериментальных данных небольшое.
4.2.2. Расчет НКПР индивидуальных соединений по предельной теплоте сгорания
В соответствии с тепловой теорией, наличие пределов распространения пламени можно объяснить тем, что для распространения пламени по горючей паро- или газовоздушной среде необходимо выделение определенного количества тепла. Экспериментально установлено, что количество тепла, выделяющееся при горении смесей с содержанием горючего, отвечающим нижнему концентрационному пределу распространения пламени (НКПР), для большинства веществ, является приблизительно величиной постоянной, равной 1830 кДж/м3. Эту величину называют предельной теплотой сгорания Q пр. Если известно значение низшей теплоты сгорания вещества Q н, то можно рассчитать концентрацию горючего, %, в предельной по горючести смеси, т.е. величину НКПР:
Еще раз подчеркнем, что Q пр - это количество теплоты, выделяющееся при сгорании 1 м3 предельной смеси горючего с воздухом, а Q н - количество теплоты, выделяющееся при сгорании 1 м3 горючего. Пример 1. Найти НКПР бутилена, если его низшая теплота сгорания равна 2545 кДж/моль. Решение. Предельная теплота сгорания выражена в кДж/м3, поэтому и Q н необходимо выразить в кДж/м3.22,4 ×10-3
Так как предельная теплота сгорания 1 м3 газовоздушной смеси в случае большинства горючих веществ приблизительно одинакова и равна 1830 кДж/м3, НКПР находим по формуле:
Экспериментально найденное значение предела составляет также 1,6%. В табл.6 приведены значения низшей теплоты сгорания некоторых горючих веществ Таблица 6
Значение теплоты сгорания других органических соединений можно найти в справочной литературе или рассчитать по закону Гесса.
4.2.3. Расчет концентрационных пределов распространения пламени для смеси горючих веществ
Если горючее представляет собой смесь индивидуальных веществ с известными концентрационными пределами распространения пламени, то для такой смеси можно установить значения нижнего и верхнего предела по формуле Ле-Шателье
где: m i - мольная доля i -го вещества в смеси; jн(в) i - значение нижнего или верхнего концентрационного предела распространения пламени i -го вещества;
Эта формула справедлива для большинства смесей веществ, хотя в некоторых случаях могут наблюдаться значительные отклонения, связанные с химическим взаимодействием веществ. Пример 1. Определить концентрационные пределы распространения пламени пропано-бутановой смеси, содержащей 60 об. % пропана и 40 об. % бутана. Решение. Экспериментальные значения концентрационных пределов распространения пламени для компонентов смеси находим в справочной литературе [5]. для пропана jн = 2,37 %, jв = 9,5 %; для бутана jн = 1,86 %, jв = 8,41 %. Тогда нижний концентрационный предел распространения пламени для смеси будет равен:
а верхний концентрационный предел
4.3. Расчет температурных пределов распространения пламени
Температурными пределами распространения пламени характеризуют пожарную опасность жидких горючих веществ. Нижний температурный предел воспламенения (НТПР) - это такая температура жидкости, при которой концентрация насыщенных паров над ее поверхностью равна нижнему концентрационному пределу распространения пламени (НКПР). Аналогично при ВТПР концентрация насыщенных паров равна ВКПР. Из этого следует, что если для горючего вещества известны концентрационные пределы распространения пламени, то по зависимости давления насыщенного пара от температуры могут быть найдены температурные пределы распространения. Допустим, известен нижний концентрационный предел распространения пламени паров горючей жидкости. Необходимо найти НТПР, т.е. температуру, при которой концентрация насыщенных паров над поверхностью этой жидкости будет равна НКПР. По концентрации паров jн (значение нижнего концентрационного предела распространения пламени) можно найти парциальное давление насыщенных паров:
где: P 0 - атмосферное давление (общее давление паровоздушной смеси).
По давлению насыщенного пара нетрудно установить соответствующую температуру жидкости, которая и будет значением НТПР. Зависимость давления насыщенного пара от температуры для большинства жидкостей известна и приведена в справочной литературе в виде таблиц (см. приложение), графиков или задана уравнением Антуана lg P = f (T) (приложение 7).
Температурные пределы воспламенения можно определить также по эмпирической формуле, связывающей их с температурой кипения индивидуальных жидкостей и константами K и l, характерными для данного гомологического ряда Т н(в) = KТ кип - l, (25) где: Т н(в)- нижний или верхний температурный предел воспламенения; Т к- температура кипения, оС. Значение K и l приведены в приложении 10. Пример 1. Рассчитать НТПР по нижнему концентрационному пределу распространения пламени этилового спирта. По справочнику или расчетом находим, что НКПР этилового спирта равен 3,6 %. Решение. 1. Определяем, какому давлению насыщенного пара соответствует значение нижнего концентрационного предела:
2. Для нахождения соответствующей температуры можно воспользоваться приложением. По зависимости давления насыщенного пара от температуры находим, что при Т 1 = 281 К P 1 = 2,67 кПа, а при Т 2 = =292 К P 2 = 5,33 кПа. Следовательно, искомая температура, отвечающая нижнему температурному пределу, находится между 281 и 292 К. Методом линейной интерполяцией находим НТПР:
3. Проще и точнее установить значение Т нтпр по известной величине Р н можно, воспользовавшись уравнением Антуана, выражающим зависимость давления насыщенного пара от температуры жидкости
где: P, [Па]; Т, [К] (см. приложение 7).
Решая уравнение относительно Т, получим:
Для этилового спирта А = 10,81, В = 1918, С = 21,1. Подставляя численные значения, получим:
Пример 2. Рассчитать температурные пределы воспламенения н -гексана, если его температура кипения равна 341,7 К или 68,5 oС. Решение. По приложению 10 находим константы K и l для нижнего и верхнего пределов, подставляем в формулы и рассчитываем: Т н = 0,6957×68,5 - 73,8 = -26,1 oС= 247,1 К; Т в = 0,7874×68,5 - 50,8 = 3,1 oС= 276,3 К. Экспериментальные значения составляют 247 К и 277 К соответственно для нижнего и верхнего пределов. 4.4. Расчет температуры вспышки Напомним, что температурой вспышки Т вс, [К], называется минимальная температура жидкости, при которой кратковременное воздействие источника зажигания у ее поверхности приводит к вспышке паров без последующего горения жидкости. При этой температуре скорость образования паров над поверхностью жидкости недостаточна для возникновения устойчивого горения. Температура вспышки является основным показателяем пожарной опасности жидкостей. Ее значение для некоторых жидкостей приведены в приложении. Метод расчета этого показателя по формуле В.И. Блинова построен на предположении, что концентрации пара и кислорода в потоке, направленном к поверхности горения, отвечают стехиометрическому составу, пар к пламени подводится благодаря молекулярной диффузии, а давление пара над жидкостью связано с температурой самой жидкости. Формула имеет вид:
где: A - постоянная прибора, зависящая от условий опыта; Д 0 - коэффициент диффузии, [м2/с]; n - число молей кислорода, необходимое для полного сгорания одного моля пара жидкости;
P нп- давление насыщенного пара жидкости при Т вс, [Па].
При определении Т вс (23) имеем два неизвестных - Т вси P нп, так как последняя величина должна быть взята именно при Т вс. В таком случае поступают следующим образом находят произведение
В дальнейшем задача сводится к тому, чтобы по известной зависимости давления насыщенных паров от температуры жидкости найти такую температуру, при которой произведение ТР будет равняться найденной величине Т вс P нп. Для этого можно воспользоваться таблицей X приложения или уравнением Антуана:
для которого коэффициенты A, B, C приведены в приложении 7. Формула В.И. Блинова является универсальной, по ней можно рассчитывать температуру вспышки в открытом и закрытом тигле, а также температуру воспламенения. Для этого в формуле (26) меняется только параметр A. При определении: температуры вспышки в закрытом тигле A = 28[ температуры вспышки в открытом тигле A = 45,3[ температуры воспламенения A = 53,3[ Пример 1. Вычислить температуру вспышки этилового спирта по формуле В.И. Блинова для закрытого тигля, если коэффициент диффузии паров спирта 10,2×10-6 м2/с. Результаты сравнить с экспериментальным значением температуры вспышки, равном 286 К. Решение. 1. Для решения задачи по формуле В.И. Блинова необходимо иметь значение коэффициента n, для чего записываем уравнение реакции горения этилового спирта: C2H5OH + 3O2 + 3×3,76N2 = 2CO2 + 3H2O + 3×3,76N2, откуда n = 3. 2. Вычислим произведение При определении Т всв закрытом тигле параметр A = 28
3. Найдем такую температуру, при которой произведение РТ будет равно 915 [кПа×К]. Тогда найденное значение температуры будет соответствовать температуре вспышки. Воспользуемся для этого зависимостью давления насыщенного пара от температуры жидкости, приведенной в приложение. Для этилового спирта при Т 1 = 281 К давление паров составляет Р 1 = 2,666 кПа, а Р 1 Т 1= =749 кПа×К. Это меньше, чем Р вс Т вс. При Т 2 = 292 К давление паров Р 2 = =5,333 кПа, а Р 2 Т 2 = 1557 кПа×К. Это уже больше, чем Р вс Т вс. Это означает, что Т вс имеет значение:
Сравнивая полученное значение с экспериментальным (286 К), видим, что погрешность расчета по формуле В. И. Блинова составляет всего 2,7 К. Необходимо определить погрешности следующих значений, сравнивая получившиеся теоретически со справочными данными EQ, Ep, ECн, ECВ, EТbс, EТb, Etn. Из получившихся данных составить сравнительную таблицу, после чего дать аналитическую оценку пожарной опасности вещества по предлагаемому алгоритму: - Название вещества - Структурная формула - Физико-химические свойства - Анализ показателей пожарной опасности - Средства тушения - Получение и применение
4.5. Основные параметры вещества Группа горючести -это классификационная характеристика способности веществ и материалов к горению. Согласно этому показателю, все материалы (вещества) можно разделить на три группы: негорючие, горючие, трудногорючие. Этот показатель характеризуется качественно и количественно. Качественная классификация основывается на способности веществ и материалов к горению при воздействии источника зажигания и после его удаления. Негорючие (несгораемые) - вещества и материалы, не способные к горению в воздухе. Негорючие вещества и материалы могут быть пожаровзрывоопасными: а) Окислители: перманганат калия (КMnО4), хлор (Сl2), перекись водорода (Н2О2), кислород (О2), азотная кислота (НNО3) и др. б) Вещества, выделяющие горючие продукты при взаимодействии друг с другом или с водой. Так, например, при взаимодействии карбида кальция (СаС2) с водой, выделяется ацетилен (С2Н2). в) Вещества, реагирующие друг с другом или с водой с выделением большого количества тепла. Пример - негашеная известь (СаО). г) Вещества, нагрев которых в герметичной емкости сопровождается значительным повышением давления и возможностью разрушения емкости. Например, сжатые или сжиженные газы, термически нестойкие соединения. д) Вещества, способные к взрывчатым превращениям без участия кислорода воздуха. Пример – взрывчатые вещества. Трудногорючие (трудносгораемые) - вещества и материалы, способные гореть в воздухе при воздействии источника зажигания, но не способные самостоятельно гореть после его удаления (продемонстрировать опыт), (привести пример с требованиями к элетроизоляции, отделочным материалам). Трудногорючие вещества могут гореть в зоне пожара, увеличивая пожарную нагрузку помещений. Горючие (сгораемые) - вещества и материалы, способные самовозгораться, а так же возгораться при воздействии источника зажигания и самостоятельно гореть после его удаления. Горючие жидкости с температурой вспышки не более 61 оС в закрытом сосуде (тигле) или 66 оС в открытом тигле, зафлегматизированных смесей, не имеющих вспышку в закрытом тигле, относят к легковоспламеняющимся (ЛВЖ). Особо опасными называют ЛВЖ с температурой вспышки не более 28 оС. Группа горючести является важнейшим параметром пожарной опасности и применяется при классификации веществ и материалов по степени пожарной опасности в соответствии с действующими противопожарными нормами. Группу горючести веществ и материалов можно определить экспериментально или расчетным путем. Но об этом мы с вами будем говорить во втором вопросе нашей лекции. А сейчас я хочу сказать о том, что если нет возможности таких экспериментальных исследований или расчетов, то группу горючести газов и жидкостей можно определить косвенно по другим экспериментально определенным показателям пожаровзрывоопасности. ГАЗЫ: 1. Горючий – наличие КПР. 2. Трудногорючий – отсутствие КПР и наличие температуры самовоспламенения. 3. Негорючий – отсутствие КПР и температуры самовоспламенения. ЖИДКОСТИ: 1. Горючая – наличие температуры воспламенения. 2. Трудногорючая - отсутствие температуры воспламенения и наличие температуры самовоспламенения. 3. Негорючая - отсутствие температуры вспышки, воспламенения, самовоспламенения, ТПР и КПР. Такую классификацию веществ и материалов по группам горючести дает нам ГОСТ 12.1.044-89. Данная классификация распространяется абсолютно на все вещества, находящиеся в природе и которые нас окружают. Почему многие на этом заостряют внимание? Потому что СНиП 21-01-97* «Пожарная безопасность зданий и сооружений» дает нам несколько иную классификацию строительных материалов по горючести. Более подробно этот вопрос изучают на дисциплине «Здания, сооружения и их поведение в условиях пожара». Пожарная опасность строительных материалов определяется следующими пожарно-техническими характеристиками: горючестью, воспламеняемостью, распространением пламени по поверхности, дымообразующей способностью и токсичностью (СНиП 21-01-97*). Строительные материалы подразделяются на негорючие (НГ) и горючие (Г). Горючие строительные материалы подразделяются на четыре группы: Г1 (слабогорючие); Г2 (умеренногорючие); Г3 (нормальногорючие); Г4 (сильногорючие). Горючесть и группы строительных материалов по горючести устанавливают по ГОСТ 30244-94 «Материалы строительные. Методы испытания на горючесть». Для негорючих строительных материалов другие показатели пожарной опасности не определяются и не нормируются. Для определения динамики развития пожара и проведения расчетов необходимо учитывать следующие характеристики: · Температура вспышки (ГОСТ 12.1.004-76); · Температура самовоспламенения. По температуре самовоспламенения необходимо рассчитать безопасно допустимую температуру нагрева стенки технологического оборудования по следующей формуле (ГОСТ 12.1.044-89): tбез ≤ 0,8 · ТСВ (29); · НКПР (ВКПР) и НТПР (ВТПР). Находим безопасные и пожароопасные области (см. ниже). Например, если jн = 1,14%об. jß = 7,22, то
где: БО = Безопасная область ВПО = Взрывоопасная область ПВПО = Потенциально взрывопожароопасная область;
· Нормальная скорость распространения пламени; · Минимальная энергия зажигания; · Скорость выгорания. Значение Vn показывает сколько выгорает горючего вещества с площади 1 м2 за 1 сек. По Vn и плотности ρ можно определить линейную скорость выгорания Vλ: Vλ = Vm/ρ (30) · Минимальное взрывоопасное содержание кислорода и минимальная флегматизирующая концентрация флегматизатора. МВСК показывает минимальную концентрацию кислорода, при которой еще возможно горение · Максимальное давление взрыва Рвзр 4.6. Огнетушащие вещества Огнетушащие вещества принято разделять по преобладающему механизму огнетушащего действия на четыре группы: разбавляющие, химически активные ингибиторы, изолирующие, охлаждающие. Следует иметь в виду, что каждое огнетушащее вещество обладает комплексом механизмов воздействия на процесс горения и горючий материал. В зависимости от вида горючего, способа применения и ряда других факторов одно и то же огнетушащее вещество может оказаться в разных группах данной классификации. А). Негорючие газы. Попадая в зону горения, они разбавляют горючую смесь, т.е. уменьшают концентрацию горючего и окислителя jг и jок. В результате уменьшения числа эффективных соударений это приводит к снижению интенсивности тепловыделения. Поэтому негорючие газы составляют группу разбавляющих огнетушащих веществ. Вместе с тем, поступая в зону горения, они имеют начальную температуру, равную температуре окружающей среды. Следовательно, при их подаче в зону горения неизбежно возрастает интенсивность теплоотвода за счет увеличения коэффициента теплопередачи. Б). Химически активные ингибиторы (ХАИ). С их помощью происходит повышение энергии активации и уменьшение константы скорости химической реакции. В результате этого снижается интенсивность тепловыделения. Вместе с тем ХАИ обладают большой теплоемкостью и при их подаче в зону горения происходит также охлаждение пламени, значительно более интенсивное, чем при тушении негорючими газами. Причем, по некоторым данным, эффект охлаждения может быть соизмерим с эффектом ингибирования. В результате такого комплексного воздействия ХАИ во всех случаях более эффективны, чем негорючие газы. В). Пены. Они применяются главным образом для тушения пожаров жидкостей. В этом случае преобладающий механизм тушения заключается в том, что пена, постепенно закрывая поверхность жидкости, уменьшает количество паров, поступающих в зону горения. В результате уменьшаются их концентрация jг, интенсивность тепловыделения q +, снижается температура пламени и соответственно лучистый тепловой поток, который определяет интенсивность испарения жидкости. Когда слой пены достигает определенной толщины (зависящей от вида пенообразователя и горящей жидкости) интенсивность тепловыделения в зоне горения уменьшается настолько, что температура пламени снижается до температуры потухания. Г). Вода. С помощью воды прекращения горения достигают, охлаждая как зону горения, так и горящий материал. При тушении пожаров горючих газов водой тепло отводят только от зоны горения, так как газы воспламеняются при любой собственной температуре и охлаждать их перед зоной горения бесполезно. Д). Порошки. При их использовании в той или иной мере реализуются все перечисленные выше механизмы (разбавление, ингибирование, изолирование, охлаждение и экранирование) одновременно. Кроме того, частицы порошка разбивают объем зоны горения на множество ячеек. В результате площадь теплоотвода становится равной суммарной площади поверхности частиц, что само по себе уже приводит к резкому увеличению q
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 4961; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.255.127 (0.137 с.) |
 %.
%. , (21)
, (21)

 (22)
(22)

 (23)
(23)

 (24)
(24)
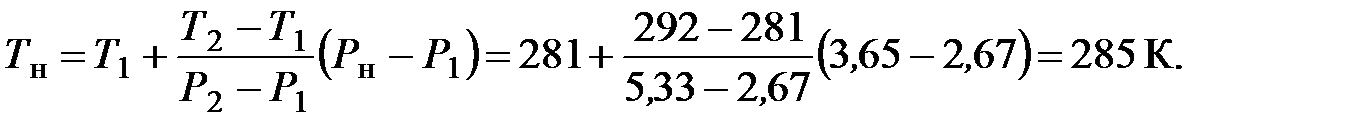



 (26)
(26) (27)
(27) (28)
(28) ];
]; ];
]; ].
].

 °С
°С . С увеличением объемной концентрации порошка расстояние между частицами уменьшается и становится равным критическому размеру, в котором пламя существовать не может, так как q
. С увеличением объемной концентрации порошка расстояние между частицами уменьшается и становится равным критическому размеру, в котором пламя существовать не может, так как q  . В этом заключается так называемый эффект объемной сетки.
. В этом заключается так называемый эффект объемной сетки.


