
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Некоторые сведения из молекулярной физикиСтр 1 из 4Следующая ⇒
Прежде чем рассмотреть типовые задачи, напомним о наиболее важных понятиях молекулярной физики, с которыми часто приходится сталкиваться при решении многих практически важных задач. 1 моль вещества - количество вещества, масса которого численно равна молекулярной массе, выраженной в граммах. Например, масса 1 моля водорода (H2) равна 2 г/моль или 2×10-3 кг/моль, а масса 1 моля метана (CH4) - 16 г/моль или 16×10-3 кг/моль. 1 киломоль вещества в тысячу раз больше 1 моля, поэтому его масса в 103 раз больше, например, для метана масса 1 киломоля составляет 16 кг/кмоль. Примечание. При определении массы моля вещества можно воспользоваться таблицей II приложения, где приведены атомные массы элементов. В связи с тем, что масса 1 моля вещества численно равна его молекулярной массе, то в 1 моле любого вещества содержится одинаковое количество молекул N = 6,02·1023 молекул/моль (число Авогадро). В газообразном состоянии 1 моль любого вещества при нормальных условиях занимает объем, равный 22,4 л.Таким образом, объем 1 моля любого газа при То =273 К и Ро = 1,013×105 Па составляет 22,4×10-3 м3/моль. Объем 1 киломоля в тысячу раз больше и равен 22,4 м3/кмоль. Объем 1 моля газа можно определить из уравнения состояния (Клапейрона - Менделеева):
где: m - масса вещества, М - масса одного моля, R - универсальная газовая постоянная, R = 8,31 [Дж/(моль×К)]. Для 1 моля (m / М = 1) объем газа при нормальных условиях
(Дж = Н × м, Па = Н/м2). Плотность вещества в газообразном состоянии при нормальных условиях
Если условия отличаются от нормальных, необходимо ввести поправки на температуру и давление. Для этого можно использовать объединенный газовый закон:
Использование таких величин, как масса и объем 1 моля вещества позволяет значительно упростить решение многих практически важных задач. Например, при определении объема паров по известной массе испарившейся жидкости или определении объема, занимаемого газом вышедшего из баллона, когда известна потеря массы в нем. АНАЛИТИЧЕСКАЯ ОЦЕНКА ПАРАМЕТРОВ ПОЖАРОВЗРЫВООПАСНОСТИ ВЕЩЕСТВ ОБРАЩАЮЩИХСЯ В ПРОИЗВОДСТВЕ Процесс горения как одна из форм физико-химического взаимодействия атомов и молекул может быть по-настоящему понятен только на основе изучения молекулярно-кинетической теории строения материи.
Необходимо представлять, что в химических процессах, прежде чем образуются новые молекулы, разрушаются старые. Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации. Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10 ° С приводит к увеличению ее скорости в два раза (закон Аррениуса). Кроме того, скорость реакции согласно закону действующих масс увеличивается с возрастанием концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси - когда отношение реагентов соответствует коэффициентам в уравнении реакции. Горению как химической реакции, идущей с большим выделением тепла, соответствует ряд физических явлений. Например, происходит перенос тепла реагирующих веществ и продуктов горения теплопроводностью за счет молекулярной и турбулентной диффузии. Тепломассообмен также осуществляется за счет конвекции. Лучистая теплопередача также способствует теплообмену. Все перечисленные процессы взаимосвязаны. Скорость химической реакции горения определяется процессами теплопередачи, взаимной диффузией горючего, окислителя, продуктов горения. В свою очередь, температура, скорость горения зависят от интенсивности химической реакции. Важная особенность явления горения - способность к пространственному распространению (лесные и степные пожары). В горении физические процессы и условия являются доминирующими и определяют вид горения, его параметры, но в основе горения лежит химическое превращение горючего и окислителя в продукты горения. На пожаре чаще всего наблюдается турбулентное, диффузионное, гомогенное горение. Показатели пожаро- и взрывоопасных свойств материалов определяют на всех стадиях процесса горения: воспламенения, горения и тушения с учетом их агрегатного состояния. Так, например, температура вспышки и температурные пределы распространения пламени изучаются при горении жидкостей, температура самовоспламенения при рассмотрении механизма этого явления и т.д.
Для оценки пожароопасных свойств веществ и материалов используют расчетные и экспериментальные методы. Большинство расчетных методов являются приближенными, носят характер эмпирических зависимостей. Таким примером являются формулы для определения температуры самовоспламенения по средней длине углеродной цепи, концентрационных пределов распространения пламени и другие. При выполнении курсовой работы необходимо четко представлять себе, что процесс горения на пожаре является главным, но не единственным. Пожар представляет собой комплекс взаимосвязанных процессов горения, теплообмена и газообмена, которые служат причиной таких вторичных явлений как задымление, объемная вспышка, взрывы, обрушения и т.д. При анализе пожара его принято разбивать на три зоны: горения, теплового воздействия и задымления. Каждая из них имеет свои особенности и характеристики, зависящие от вида пожара. По характеру тепло- и газообмена пожары делят на два вида: открытые и внутренние. Открытыми называются пожары, в которых присутствует теплогазообмен только зоны горения с окружающей средой. Это пожары, протекающие на открытом пространстве. Внутренними называются пожары, протекающие в помещениях. В этих случаях при анализе пожара приходится учитывать также процессы тепло- и газообмена зоны горения с ограждающими конструкциями и помещения с внешней средой. 4.1. Определение теоретического количества воздуха, необходимого для горения исследуемого вещества (ГЖ)
Обобщенная запись брутто-уравнения материального и теплового баланса реакции горения имеет вид: nг [г] + no [o] = nпгi [пг] + Q, (4) где: n г, n o, n пгi - стехиометрические коэффициенты при соответствующих веществах ([г]- горючее, [o] - окислитель, [пг]- продукты горения); Q - тепловой эффект химической реакции.
Для составления материального баланса процессов горения используют уравнения элементарных реакций окисления элементов, входящих в состав горючего, выражен в массовых процентах каждого химического элемента на единицу массы горючего. Для индивидуальных соединений запись уравнения материального баланса осуществляется сразу, но принцип остается тот же. Для смесей горючих газов записывают уравнение материального баланса каждого газа. Во время горения реакции между горючим, продуктами его термического разложения протекают в объеме пламени - в зоне горения. Минимальное (теоретическое) количество воздуха, необходимое для полного сжигания 1 кг твердого или жидкого горючего материала или 1 м3 горючего газа, - называется теоретическим количеством воздуха и обозначается Коэффициент избытка воздуха (a) показывает, во сколько раз объем воздуха, поступивший на горение, больше теоретического объема воздуха, необходимого для полного сгорания единицы количества вещества в стехиометрической смеси.
Полный, действительный объем продуктов горения находится с учетом избытка воздуха (a > 1):
Расчет ведется на 1 кг (1 кмоль, 1 м3) твердого, жидкого или газообразного горючего. Адиабатической температурой горения называется температура, до которой нагреваются продукты горения, когда все тепло, выделившееся при горении, идет на их нагрев. Действительная температура горения всегда ниже адиабатической, так как часть тепла теряется на излучение.
4.1.1. Расчет количества воздуха и продуктов горения
При горении на пожарах расход воздуха отличается от теоретически необходимого. Действительный расход воздуха на единицу горючего записывается как V в = a
или
Определение количества воздуха и объема продуктов горения оказывается возможным на основании закона сохранения массы по уравнениям химических реакций. При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Так как на один кмоль кислорода в воздухе приходится 3,76 кмоля азота (состав воздуха: 21 % O2 и 79 % N2), то материальный баланс процесса горения, например, бензола в воздухе можно записать так: C6H6 + 7,5O2 + 7,5×3,76N2 = 6CO2 + 3H2O + 28,2N2. Из этого уравнения видно, что для полного сгорания 1 кмоля бензола требуется (7,5+7,5·3,76) кмолей воздуха (7,5 кмолей O2 и 7,5×3,76 кмоля, не принимающего участия в горении N2). При сгорании образуется 6 кмолей СО2, 3 кмоля H2O и остается непрореагировавшим (7,5×3,76) = 28,2 кмоля N2. В общем виде можно записать:
где: n
Аналогично объем продуктов горения:
где:
Объем продуктов горения:
Если горение происходит с избытком воздуха (a > 1), то азота в продуктах горения будет больше:
и в продуктах горения появится кислород
В этом случае полный объем продуктов горения
или
Иногда на практике приходится решать обратную задачу по известному содержанию кислорода (j
Для веществ, у которых объем продуктов горения равен объему израсходованного воздуха (например, горение углерода, серы), эта формула упрощается
Для газообразных горючих веществ расчет объемов воздуха и продуктов горения чаще всего проводят в м3/м3. Так как 1 кмоль любого газа в одинаковых условиях занимает один и тот же объем (при нормальных условиях 22,4 м3), то объем, рассчитанный в м3/м3, численно будет таким же, как и в кмоль/кмоль. Если горючее вещество находится в конденсированном состоянии (жидком или твердом), то, как правило, расчеты объемов воздуха и продуктов горения проводят в м3/кг. Для этого кмоль воздуха или продукта горения переводят в м3, умножая на объем одного кмоля газа (22,4 м3/кмоль), а кмоль горючего переводят в кг, умножая на массу одного киломоля горючего (М г, кг/кмоль). Например, при сгорании 1 кг гептана С7Н16 + 11O2 + 11×3,76N2 = 7CO2 + 8H2O + 11×3,76N2 требуется воздуха:
образуется и далее по химическому уравнению. При сгорании смеси индивидуальных химических веществ расчет необходимого количества воздуха и объема продуктов горения проводят по каждому из веществ, а затем суммируют с учетом его процентного содержания в смеси. Пример 1. Определить объемы воздуха и продуктов горения при нормальных условиях, если при пожаре на складе сгорело 1000 кг ацетона, а горение протекало при a = 2. Решение. Сгорает индивидуальное химическое соединение. Запишем уравнение реакции горения ацетона в воздухе: C3H6O + 4O2 + 4×3,76N2 = 3CO2 + 3H2O + 4×3,76N2 . Объем воздуха, необходимого для сгорания 1 кг ацетона:
учитывая, что масса одного киломоля ацетона составляет 58 кг/моль, получим:
Действительный объем воздуха с учетом коэффициента избытка воздуха a = 2.
а избыток воздуха:
Объем продуктов горения
С учетом избытка воздуха полный объем продуктов горения
При сгорании 1000 кг ацетона объем воздуха при нормальных условиях составит: 14,8 м3/кг × 1000 кг = 14 800 м3, а объем продуктов горения: 15,5 м3/кг × 1000 кг = 15 500 м3. Примечание. Если в процессе горения была задана другая температура, то объем продуктов горения и воздуха рассчитывается с учетом объема, который занимает один кмоль газа при этой температуре:
где: P 0 = 101,3 кПа; T 0 = 273,15 К; T и P - заданные температура и давление. 4.1.2. Определение теоретической температуры горения и давления взрыва горючей жидкости Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. Принято различать адиабатическую температуру горения, рассчитываемую без учета потерь тепла в окружающее пространство, и действительную температуру горения, учитывающую эти теплопотери. Температуру горения можно рассчитать, если известно количество теплоты, выделяемое при сгорании горючего вещества, состав и объем продуктов горения, их теплоемкость или теплосодержание. Тепловой эффект химической реакции горения (т.е. количество теплоты, выделяемое в ходе экзотермической реакции) называется низшей теплотой сгорания вещества Q н.
Если горючее имеет в своем составе водород, то при его сгорании образуется вода в газообразном состоянии, которая, охлаждаясь, будет конденсироваться. Так как в процессе конденсации паров тепло выделяется, то общее количество теплоты, полученное при сгорании вещества, будет больше на величину теплоты испарения Q исп: Qв = Qн + Qисп, (17) где: Q в - высшая теплота сгорания вещества.
При расчетах температуры горения пользуются величиной Q н, так как при температуре горения вода находится в газообразном состоянии. Значения низшей теплоты сгорания вещества (тепловой эффект химической реакции) приводится в справочной литературе. Для некоторых горючих веществ ее значение приведено в приложении (см. показатели пожарной опасности газов, жидкостей и твердых веществ). Эта величина может быть рассчитана по закону Гесса,
который говорит о том, что тепловой эффект химической реакции равен разности сумм теплоты образования продуктов реакции и теплоты образования исходных веществ. Для расчета температуры горения составим уравнение теплового баланса, считая, что выделившееся в результате сгорания тепло нагревает продукты горения (CO2, H2O, N2) от начальной температуры T 0 до температуры T г.
где: h - коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания);
Пример 1. Определить необходимые параметры температуры и давления для взрыва керосина (КО - 20) при температуре 16 оС и давлении 754 мм.рт.ст. окружающей среды. Решение: 1. Рассчитываем стандартную теплоту сгорания 1 моля керосина КО-20 1000 гр. - 43724,16 кДж 190,1 гр. - Х кДж
2. Составляем химическое уравнение реакции горения С13,6Н26,9 + 20,33 О2 + 20,33×3,76 N2 = 13,6 СО2 + 13,45 Н2О + + 20,33×3,76 N2 3. Определяем разность молей продуктов горения и исходной смеси.
4. Определяем энергию взрыва, учитывая, что T1 = 2600 К; T2 = 2800 K, тогда:
Внутренняя энергия продуктов взрыва при Т = 2600 К меньше энергии взрыва, а при Т = 2800 К больше, значит, Твзр надо определять методом линейной интерполяции. 5. Находим температуру взрыва методом линейной интерполяции
6. Определяем давление взрыва паров керосина в смеси с воздухом на стехиометрической концентрации и при заданных условиях по формуле:
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 364; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.2.184 (0.203 с.) |
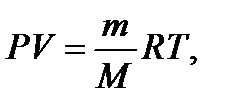 (1)
(1)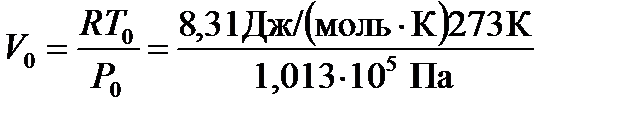 = 22,4×10-3 м3/моль,
= 22,4×10-3 м3/моль, (2)
(2) (3)
(3) . Действительное количество воздуха
. Действительное количество воздуха  является произведением коэффициента избытка воздуха aи теоретического количества воздуха
является произведением коэффициента избытка воздуха aи теоретического количества воздуха  .
. (5)
(5) .Множитель aназывается коэффициентомизбыткавоздуха. Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха.
.Множитель aназывается коэффициентомизбыткавоздуха. Разность между действительным и теоретически необходимым количеством воздуха называется избытком воздуха. (6)
(6) . (7)
. (7) , (8)
, (8)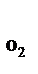 , n
, n 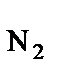 , n г- число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, [кмоль].
, n г- число кмолей кислорода, азота и горючего вещества в уравнении материального баланса, [кмоль].
 - объем азота, рассчитанный из уравнения материального баланса, [кмоль/кмоль].
- объем азота, рассчитанный из уравнения материального баланса, [кмоль/кмоль]. (9)
(9) (10)
(10) . (11)
. (11) (12)
(12) . (13)
. (13) , об. %) в продуктах горения находить коэффициент избытка воздуха, с которым протекало горение вещества
, об. %) в продуктах горения находить коэффициент избытка воздуха, с которым протекало горение вещества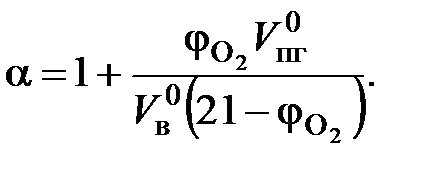 (14)
(14) . (15)
. (15) = 11,7 м3/кг.
= 11,7 м3/кг. 1,57 м3/кг
1,57 м3/кг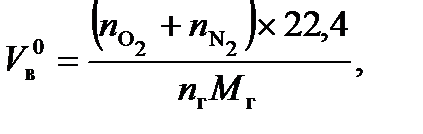
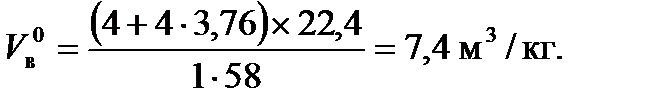

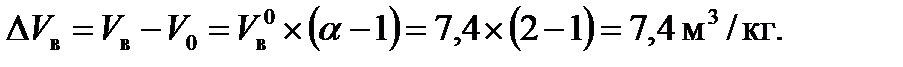
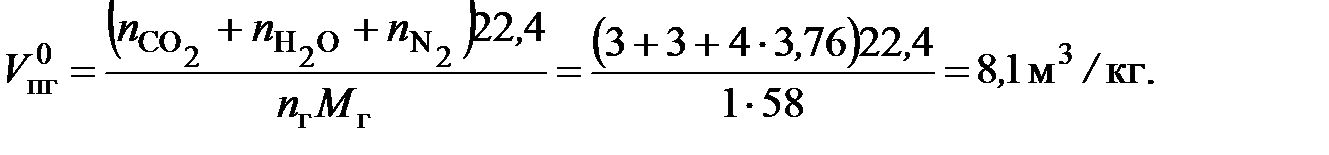
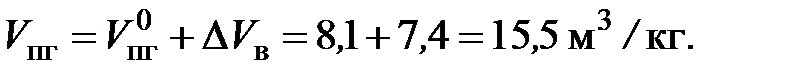
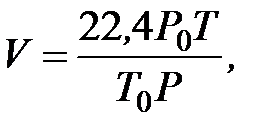 (16)
(16) (18)
(18) (19)
(19) и V пг i - теплоемкость и объем i -го продукта горения.
и V пг i - теплоемкость и объем i -го продукта горения.





 (20)
(20)



