
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При постійній температурі швидкість хімічної реакції пропорційнаСтр 1 из 3Следующая ⇒
Добутку концентрації реагуючих речовин, причому кожна Концентрація входить в формулу в ступеню, що дорівнює Коефіцієнту в рівнянні реакції.
а А + в В +..... =....
Величина константи залежить від природи реагуючих речовин, від температури, від наявності каталізаторів, але не залежить від концентрації реагуючих речовин. Закон діючих мас справедливий у випадку простих реакції (коли відсутні паралельно протікаючи різноманітні процеси). Наприклад: 2NO2 + O2 = 2NO2
У випадку гетерогенних реакцій в рівняння закону діючих мас входять концентрації тільки тих речовин, які знаходяться в газовій фазі чи в розчині. Концентрація речовини в твердій фазі - величина постійна і тому вона включена в константу рівноваги. Наприклад:
С + О2 = СО2
де
Залежність швидкості реакції від температури і природи реагуючих речовин.
Число зіткнень між молекулами настільки велике, що якби будь-яке зіткнення закінчувалося б утворенням нових речовин, реакції проходили б майже миттєво. Таким чином не всі зіткнення проходять з утворенням нових речовин, тому що на більшість реакції витрачається деякий час. Це пояснюється тим, що для здійснення реакції необхідно спочатку розірвати чи послабити хімічні зв’язки, які існують між атомами в молекулах реагуючих речовин. Та енергія (кінетична та інша), яка потрібна, аби зустріч молекул привела до утворення нової речовини називається ЕНЕРГІЄЮ АКТИВАЦІЇ. Одиницями виміру енергії активації є кДж/Моль. Молекули, що мають таку енергію, називаються активними. Зрозуміло, що їх кількість зростає з підвищенням температури. Зростання швидкості реакції з ростом температури характеризують ТЕМПЕРАТУРНИМ КОЕФІЦІЄНТОМ ШВИДКОСТІ реакції: це число говорить, в скільки разів підвищується швидкість даної реакції при кожному підвищенні температури на 100С. Найчастіше для всіх реакцій він становить від 2 до 4. Наприклад, якщо температурний коефіцієнт дорівнює 2,9, це значить: при підвищенні температури на 1000С швидкість реакції підвищується в 2,910, тобто в 50000 разів. Якщо енергія активації мала (менше за 40 кДж/Моль), значна частка зіткнень призводить до реакції. Швидкість таких реакцій дуже велика. Наприклад, іонні реакції між електролітами.
Якщо енергія активації реакції дуже велика (більш за 120 кДж/Моль), тоді лише незначна частина молекул реагує. Такі реакції можуть проходити роками. Залежність швидкості реакції від температури визначається правилом Вант-Гоффа: при підвищенні температури на кожні 100С швидкість більшості реакцій Зростає в 2 – 4 рази. Математичне ця залежність виражається співвідношенням:
де V1, V2 – швидкість реакцій відповідно при початковій t1 і кінцевій t2 температурі; g - температурний коефіцієнт швидкості реакції. Правило Вант-Гоффа наближене і застосовується лише для орієнтовної оцінки впливу температури на швидкість реакції. Температура впливає на швидкість реакції, збільшуючи константу швидкості.
природи реагуючих речовин і є
Ці уявлення пояснюються малюнком:
вигляді: мал. 2 А2 + В2 = 2АВ роздивіться вплив енергії на проходження реакції. Вісь ординат характеризує потенційну енергію реагуючої системи, Нвтх – енергія вихідного стану, вісь абсцис – хід реакції: Нпрод – енергія кінцевого стану, вихідний стан... перехідний Еа – енергія активації прямої стан... кінцевий стан. реакції, Щоб речовини А2 і В2, Еа – енергія активації зворотної ще реагують, утворили продукт реакції. реакції АВ, вони повинні подолати енергетичний бар’єр С. На це витратиться енергія активації, на значення якої зростає енергія системи. При цьому в ході реакції з частинок реагуючих речовин утворюється проміжне нестійке угруповання, що називається перехідним станом, або активованим комплексом. Наступний розпад активованого комплексу обумовлює утворення кінцевого продукту. Механізм реакції можна замалювати схемою А В А......В А - В + =.. = + А В А......В А - В Вихідні реагенти Активований Продукти реакції (початковий стан комплекс (кінцевий стан системи) системи) Якщо під час розпаду активованого комплексу виділяється більше енергії, ніж необхідно для активізації частинок, то реакція екзотермічна. Прикладом екзотермічної реакції є зворотній процес – утворення речовини А2 і В2 є речовини АВ: 2АВ = А2 + В2. В цьому випадку процес відбувається також через утворення активованого комплексу А2В2, однак енергія активації більша, ніж для прямого процесу: Еа = Еа + ΔН (ΔН – тепловий ефект реакції). Тому для перебігу ендотермічних реакцій потрібно підводити енергію ззовні.
Як видно з малюнку, різниця енергій кінцевого стану системи (Нпрд) і початкового (Нвих) стану дорівнює зміненню внутрішньої енергії системи під час реакції: ΔН = Нпрод - Нвих Ця різниця називається ентальпія хімічного процесу і приймає негативне значення у екзотермічному процесі і позитивне значення у ендотермічному процесі. Численню ентальпія хімічної реакції дорівнює тепловому ефектові, взятому з протилежним знаком: Q = - ΔН - Q = ΔН Швидкість реакцій безпосередньо залежить від значення енергії активації: якщо воно мале, то за певний час перебігу реакції енергетичний бар’єр подолає велика кількість молекул і швидкість реакції буде високою, якщо енергія активації велика, то реакція відбувається повільно. Під час взаємодії іонів енергія активації дуже мала й іонні реакції відбуваються з дуже великою швидкістю.
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 518; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.195.162 (0.011 с.) |
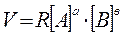 ....
.... 


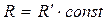
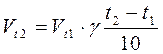
 5. Енергія активації.
5. Енергія активації.


 Енергія активації залежить від Н вих Е активації
Енергія активації залежить від Н вих Е активації
 характеристикою кожної реакції. Н прод
характеристикою кожної реакції. Н прод
 мал 1
мал 1

 Н прод
Н прод Е активації
Е активації Н вих
Н вих  На прикладі реакції у загальному
На прикладі реакції у загальному


