Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности первого этапа гбф-пути
1. 1-Й ЭТАП ПОЛНОСТЬЮ ОБРАТИМ. Из 10 стадий 1-го этапа 7 полностью обратимы. Для остальных 3-х этапов есть обходные пути. Для гексокиназы (1-я стадия) обходной обратный путь катализируется глюкозо-6-фосфатазой. Для фосфофруктокиназы (3-я стадия) обходной обратный путь катализируется фруктозодифосфатазой. Третьим необратимым звеном 1-го этапа является 10-я стадия. В прямом направлении эта реакция катализируется пируваткиназой, а обходной обратный путь протекает через 2 стадии. В 1-й реакции СО2 присоединяется к ПВК с образованием щавелево-уксусной кислоты (ЩУК). Эта реакция катализируется пируваткарбоксилазой. Эта реакция синтеза требует затраты 1 АТФ. Кофермент пируваткарбоксилазы: биотин (vit H). Вторая реакция: ЩУК поступает в цитоплазму (с участием челночных механизмов) и превращается в ФЕП. Эта реакция требует затраты ГТФ. С учетом 7-й стадии, где происходит субстратное фосфорилирование, получается, что на пути от пирувата до глюкозы расходуется 3 АТФ, то есть 6 АТФ в расчете на каждую молекулу глюкозы, синтезированную из ПВК. ВТОРАЯ ОСОБЕННОСТЬ ПЕРВОГО ЭТАПА ГБФ-ПУТИ: НА 1-М ЭТАПЕ НЕТ ПОЛНОЙ ЗАВИСИМОСТИ ОТ КИСЛОРОДА. Среди 10-ти стадий 1-го этапа только одна является окислительной. Это 6-я стадия: ФГА ----> 1,3-бисфосфоглицериновая кислота. Сама эта реакция не требует кислорода. Обычно НАДН2 поступает в митохондрии и по дыхательной цепи отдает водород на кислород. Транспорт водорода от цитоплазматического НАДН2 к митохондриальному НАДН2 обычно обеспечивается малат-аспартатным челночным механизмом, изображенном на рисунке 4
Рисунок 4 В этом случае весь 1-й этап работает как часть ГБФ-пути. СИНТЕЗ И РАСПАД ГЛИКОГЕНА. Гликоген — основной резервный полисахарид в клетках животных и человека, так как он плохо растворим в воде и не влияет на осмотическое давление в клетке, поэтому в клетке депонируется гликоген, а не свободная глюкоза. Разветвленная структура гликогена создает большое количество концевых мономеров. Это способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы гликогена. Гликоген депонируется главным образом в печени и скелетных мышцах. Гликоген хранится в цитозоле клеток в форме гранул. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает им взаимодействие с субстратом. Синтез и распад гликогена протекают разными метаболическими путями (рис 4).
Гликоген синтезируется в период пищеварения (1—2 ч после приема углеводной пищи). Синтез гликогена требует энергии. При включении одного мономера в полисахаридную цепь протекают 2 реакции, сопряженные с расходованием АТР и UTP (реакции 1 и 3). После образования глюкозо-6-фосфата (гексокиназная реакция) происходит внутримолекулярный перенос остатка фосфорной кислоты из 6-го положения в 1-е. При этом образуется глюкозо-1-фосфат:
После изомеризации глюкозо-6-фосфата в глюкозо-1-фосфат протекает дополнительная активация глюкозного фрагмента. При этом расходуется 1 молекула УТФ, что эквивалентно расходованию 1-й молекулы АТФ. В результате образуется активированная форма - УДФ-глюкоза (рис. 4). Затем с УДФ глюкозный остаток переносится на молекулу гликогена. Удлинение цепи гликогена катализирует фермент гликогенсинтетаза. Таким образом, цепь гликогена становится на 1 глюкозный фрагмент длиннее. Гликоген, в отличие от растительного крахмала, более сильно разветвлен. Для формирования ответвлений существует специальный фермент, который называется "гликогенветвящий фермент". Молекула гликогена синтезируется не с "нуля", а происходит постепенное удлинение уже имеющегося кусочка цепи: "затравки" или праймера. И при распаде гликогена никогда не происходит полного разрушения его молекул. Для включения одного остатка глюкозы в молекулу гликогена клетка расходует 2 молекулы АТФ. При распаде гликогена эта АТФ не регенерирует, а освобождается только Фн (неорганический фосфат). Ключевым ферментом синтеза гликогена является гликогенсинтаза. Это "пункт вторичного контроля" (рис. 5). Регуляция гликогенсинтазы: она активируется избытком глюкозо-6-фосфата. Поэтому если глюкозо-6-фосфат другими путями утилизируется медленно, то возрастание его концентрации приводит к увеличению скорости синтеза гликогена. Реакция, катализируемая гликогенсинтазой, необратима.
Мобилизация гликогена происходит в основном в период между приемами пищи и ускоряется во врем физической работы. Этот процесс происходит путем последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата с помощью гликогенфосфорилазы (рис. 4). Этот фермент не расщепляет a1,6-гликозидные связи в местах разветвлений, поэтому необходимы еще 2 фермента, после действия которых глюкозный остаток в точке ветвления освобождается в форме свободной глюкозы (реакции 2, 3). Гликоген распадается до глюкозо-6-фосфата без затрат АТР. Регуляция гликогенфосфорилазы: угнетается избытком АТФ, активируется избытком АДФ.
Рисунок 5 Распад гликогена в печени и мышцах имеет одну различающую их реакцию, обусловленную наличием в печени фермента фосфатазы глюкозо-6-фосфата (табл. 1).
Таблица 1. Присутствие в печени глюкозо-6-фосфатазы обусловливает главную функцию гликогена печени -освобождение глюкозы в кровь в период между приемами пищи и использование ее другими органами. Таким образом, мобилизация гликогена печени обеспечивает содержание глюкозы в крови на постоянном уровне. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Через 10—18 ч после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 ч приводит к полному его исчезновению. Глюкозо-6-фосфатаза содержится также в почках и клетках кишечника. Функция мышечного гликогена заключается в высвобождении глюкозо-6-фосфата, используемого в самой мышце для окисления и получения энергии, Переключение процессов синтеза и мобилизации гликогена в печени происходит при переходе состояния пищеварения в постабсорбтивный период или состояния покоя на режим мышечной работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах — инсулин и адреналин. Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности 2 ключевых ферментов — гликогенсинтазы и гликогенфосфорилаз ы - с помощью их фосфорилирования и дефосфорилирования. Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного состояния в постабсорбтивное изменяется их относительная концентрация — инсулин-глюкагоновый индекс. Таким образом, главным переключающим фактором в печени является инсулин-глюкагоновый индекс. В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается и решающим фактором является влияние глюкагона, который стимулирует распад гликогена в печени. Механизм действия глюкагона включает каскад реакций, приводящий к активации гликогенфосфорилазы. В период пищеварения преобладающим является влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. Под влиянием инсулина происходит: а) стимуляция транспорта глюкозы в клетки мышечной ткани; б) изменение активности ферментов путем фосфорилирования и дефосфорилирования. Так, например, инсулин активирует фосфодиэстеразу и снижает концентрацию сАМР в клетке. Кроме этого, инсулин активирует фосфатазу гликогенсинтазы, последняя дефосфорилируется и переходит в активное состояние;
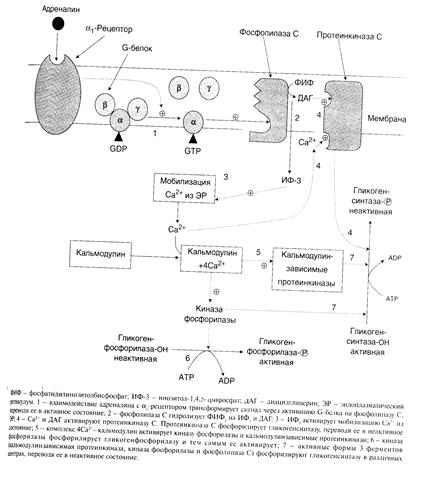
в) изменение количества некоторых ферментов путем индукции и репрессии их синтеза. Например, инсулин индуцирует синтез глюкокиназы, ускоряя тем самым фосфорилирование глюкозы в печени. Адреналин имеет сходный с глюкагоном механизм действия на клетки печени.Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Тип рецепторов, с которыми взаимодействует адреналин, определяет, какая система будет использована. Так, взаимодействие адреналина с b-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с a,-рецепторами включает инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результатом действия обеих систем являются фосфорилирование ключевых ферментов и переключение синтеза гликогена на его распад (рис.6, 7). Активация адреналином мышечной гликогенфосфорилазы происходит иначе, так как распад гликогена в скелетных мышцах стимулируется мышечными сокращениями. Киназа фосфорилазы (Са2+-зависимая) активируется при мышечной работе под влиянием нервного импульса, так как в саркоплазме в этом случае возрастает концентрация ионов кальция. Это еще один механизм ускорения распада гликогена в мышце. Результатом действия адреналина в мышцах также являются активация сАМР-зависимых протеинкиназ и активация фосфорилазы путем ее фосфорилирования (рис. 8). При передаче сигнала от гормона через внутриклеточные посредники происходит значительное его усиление, поэтому активация фосфорилазы гликогена при участии любой системы передачи сигнала в клетку позволяет быстро образовать большое количество глюкозы из гликогена. В мышцах это имеет большое значение для совершения интенсивной работы в условиях стресса, например при убегании от опасности. При умеренной нагрузке в мышцах действует другой механизм регуляции активности гликогенфосфорилазы – аллостерическая регуляция продуктами распада АТФ (АМФ). При переходе из постабсорбтивного состояния в абсорбтивное или по окончании мышечной работы прекращается секреция гормонов и вся система возвращается в исходное неактивное состояние. Аденилатциклаза и фосфолипаза С инактивируются. сАМР разрушается фосфодиэстеразой, что вызывает переход всех внутриклеточных ферментов каскада в неактивную форму.
Значение регуляции скоростей синтеза и распада гликогена в печени заключается в обеспечении постоянства концентрации глюкозы в крови. Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя.
Рисунок 6
Рисунок 7 НАРУШЕНИЯ ОБМЕНА ГЛИКОГЕНА 1. Гликогеновые болезни - это группа наследственных болезней, причиной которых является дефект фермента. Следствием этого является снижение или отсутствие активности какого-либо фермента, участвующего в синтезе или распаде гликогена или регуляции этих процессов. 2. Гликогенозы (болезни накопления гликогена) обусловлены дефектом ферментов, участвующих в распаде гликогена. Гликогеноз проявляется избыточным накоплением гликогена в печени, сердечной и скелетных мышцах, почках, легких и других органах. Накапливаемый гликоген может иметь как нормальную, так и измененную структуру. Результатом нарушения распада гликогена являются гипоглюкоземия и ее последствия. Существует несколько типов гликогенозов, различающихся характером и локализацией дефектного фермента. 3. Агликогенозы обусловлены нарушением синтеза гликогена и сопровождаются снижением его содержания в тканях, результатом чего также является гипоглюкоземия.
Рисунок 8
|
||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 503; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.180.76 (0.021 с.) |