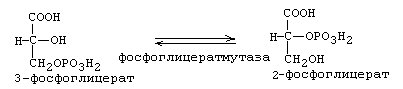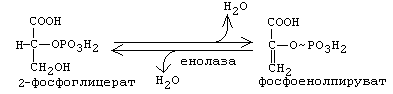Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ч. 1. Обмен и функции углеводовСтр 1 из 6Следующая ⇒
ДИНАМИЧЕСКАЯ БИОХИМИЯ Ч. 1. ОБМЕН И ФУНКЦИИ УГЛЕВОДОВ УЧЕБНОЕ ПОСОБИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ Караганда 2003 Авторы: зав. кафедрой проф. Л.Е. Муравлева, доцент Т.С. Омаров, доцент С.А. Искакова, преподаватели Д.А. Клюев, О. А. Понамарева Рецензент: доцент Н.У. Танкибаева
Утверждена на заседании кафедры пр.№ _____ от _______________2003 г.
Утверждена зав. кафедрой ________________________________________
Утверждена на МК медико-биологического и фармацевтического факультетов пр.№ _____ от _______________2004 г.
Председатель________________________________________________ ОБМЕН И ФУНКЦИИ УГЛЕВОДОВ Функции углеводов В основном углеводы выполняют энергодативную функцию. Главными источниками энергии являются глюкоза и гликоген. Кроме того, из углеводов могут синтезироваться липиды, некоторые аминокислоты, пентозы. Углеводы входят как составная часть в структурно-функциональные компоненты клетки - гликолипиды и гликопротеины, входят в состав соединительной ткани. Гепарин является антикоагулянтом. Классификация углеводов Моносахариды, которые не могут быть гидролизованы на более простые сахара. В зависимости от числа атомов углерода их подразделяют на триозы, тетрозы, пентозы, гексозы. В зависимости от присутствия альдегидной или кетоновой группы на альдозы и кетозы. Дисахариды состоят из двух остатков моносахаридов: 1) сахароза состоит из остатков глюкозы и фруктозы, соединенных a-1,4-гликозидной связью; 2) лактоза состоит из остатков глюкозы и галактозы, соединенных b-1,4-гликозидной связью; 3) мальтоза состоит из двух остатков глюкозы, соединенных a-1,4-гликозидной связью; 4) целлобиоза состоит из двух остатков глюкозы, соединенных b-1,4-гликозидной связью. Гомополисахариды - длинные разветвленные цепи, состоящие из одних и тех же моносахаридов: 1) крахмал - полимер глюкозы, соединенной a-1,4 и a-1,6-гликозидными связями. При этом неразветвленные цепи образуют амилозу (20%), а разветвленные амилопектин (80%); 2) гликоген - животный крахмал, состоящий из остатков глюкозы. Это более разветвленный полимер, чем крахмал. При частичном гидролизе крахмала или гликогена образуются декстрины (более короткие разветвленные цепи);
3) целлюлоза - главный компонент структурной основы растительных клеток. Это линейный полимер глюкозы, соединенной b-1,4-гликозидными связями. Строение гликогена представлено на рисунке 1:
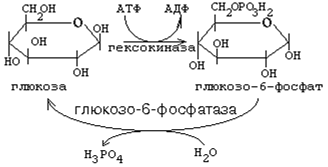
Рисунок 1 Гетерополисахариды состоят из разных мономеров: 1) гепарин содержит остатки D-глюконат-2-сульфита и N-ацетилглюкозамин-6-сульфата; 2) гиалуроновая кислота состоит из остатков D-глюкуроновой кислоты и остатков N-ацетилглюкозамина. Входит в состав соединительной ткани и участвует в регуляции проницаемости кканей. Суточная норма углеводов в пище составляет 400-500 г. Основными углеводами пищи являются: 1. крахмал - разветвленный гомополисахарид из глюкозы. Мономеры линейных участков соединены a -1,4-гликозидными связями, а в местах разветвления a -1,6 связями. 2. дисахариды - сахароза (глк-(a -1,2)-фру), лактоза (гал-(b -1,4)-глк), мальтоза (глк-(a -1,4)-глк). Метаболизм глюкозы в клетке Первая реакция, в которую вступает глюкоза в клетке, является единственной. Это реакция фосфорилирования глюкозы за счёт АТФ. Фермент, катализирующий эту реакцию, есть в любой клетке. Он называется гексокиназа (ГК).
Биологический смысл гексокиназной реакции: 1. Сделать молекулу глюкозы более способной к химическим реакциям, ослабить в ней химические связи, дестабилизировать её ("расшатать"). 2. Связать, задержать глюкозу в клетке, чтобы она не смогла выйти обратно в кровь (глюкозо-6-фосфат не способен проходить через клеточную мембрану). Чтобы связанная молекула могла выйти из клетки, глюкозо-6-фосфат должен превратиться обратно в глюкозу. Фермент, катализирующий обратную реакцию (превращение глюкозо-6-фосфата обратно в глюкозу), называется глюкозо-6-фосфатаза. Он гидролизует глюкозо-6-фосфат до глюкозы и Н3РО4 (Фн), то есть катализирует обходной обратный путь гексокиназной реакции. Глюкозо-6-фосфатаза есть в печени, почках и слизистой оболочке кишечника. 3. Гексокиназа - это ключевой фермент всего метаболизма глюкозы. Он лимитирует (ограничивает) скорость всех путей метаболизма глюкозы в клетке. Гексокиназа всегда работает с максимальной скоростью. Только в печени есть ещё один фермент, катализирующий реакцию превращения глюкозы в глюкозо-6-фосфат. Это изофермент гексокиназы - глюкокиназа. "На высоте пищеварения", когда концентрация глюкозы в воротной вене во много раз возрастает, глюкокиназа работает очень интенсивно. Следовательно, утилизация глюкозы клетками печени "на высоте пищеварения" возрастает при подключении дополнительного пути метаболизма (работа глюкокиназы).
Регуляторная роль гексокиназы: этот фермент угнетается избытком своего продукта - глюкозо-6-фосфата. Если по какой-то причине дальнейшее использование глюкозо-6-фосфата замедляется (его концентрация при этом возрастает), то автоматически тормозится гексокиназная реакция. Поэтому в такой ситуации замедляется использование в клетке глюкозы в целом. После образования глюкозо-6-фосфата начинается разветвление дальнейших путей метаболизма глюкозы. Таких главных путей три. 1. Гексозомонофосфатный путь распада углеводов (ГМФ-путь) 2. Гексозобисфосфатный путь распада углеводов (ГБФ-путь). 3. Синтез гликогена. Есть ещё минорные пути (в них используется небольшая доля глюкозы, поступающей в клетку). Эти пути не играют энергетической роли, а используются для построения олиго- и полисахаридных цепей гликопротеинов, то есть выполняют структурную роль.
Г Б Ф - П У Т Ь. (ГЕКСОЗОБИСФОСФАТНЫЙ ПУТЬ РАСПАДА УГЛЕВОДОВ)
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ГБФ-ПУТИ. 1. Это главный путь распада углеводов до конечных продуктов. Во многих клетках это - единственный путь. Так распадается 70-75% глюкозы, которая поступает в клетку. 2. Только ГБФ-путь дает клетке энергию в виде АТФ. Это основной источник получения энергии в клетке. 3. Это самый длинный путь распада углеводов. ГБФ-путь делим на 3 этапа. 1-й этап протекает в цитоплазме, дает 8 молекул АТФ при распаде 1 молекулы глюкозы или 9АТФ при распаде одного глюкозного фрагмента гликогена. Заканчивается образованием 2-х молекул пирувата (ПВК). 2-й и 3-й этапы - (исключительно аэробные!) в митохондриях с обязательным участием кислорода. 2-й этап ГБФ-пути называется "окислительное декарбоксилирование пирувата". Пируват превращается в ацетил-коэнзим А. Молекула ацетил-коэнзима А вступает в 3-й этап. Этот 3-й этап называется циклом трикарбоновых кислот (ЦТК). В этом цикле АцКоА полностью расщепляется до СО2 и Н2О. 2-й и 3-й этапы дают 30 АТФ в расчете на одну молекулу глюкозы. 1-й этап проходит 10 промежуточных стадий. В ходе первой части этого этапа молекула глюкозы расщепляется пополам до 2-х молекул фосфоглицеринового альдегида (ФГА). ОСОБЕННОСТИ ПЕРВОЙ ЧАСТИ 1-ГО ЭТАПА: Гексокиназа работает, чтобы ослабить прочную молекулу глюкозы:
2-я реакция - изомеризации:
На 3-й стадии фруктозо-6-фосфат еще более ослабляется фосфофруктокиназой (ФФК) и образуется фруктозо-1,6-бисфосфат:
Фосфофруктокиназа - это ключевой фермент ГБФ-пути. Он является "пунктом вторичного контроля". Избыток АТФ и избыток цитрата сильно ингибируют ФФК. Из-за угнетения ФФК накапливаются глюкозо-6-фосфат (Г-6-Ф) и фруктозо-6-фосфат(Ф-6-Ф). глюкозо-6-фосфат ингибирует гексокиназу, уменьшая утилизацию глюкозы клеткой и одновременно активирует гликогенсинтетазу. Если нет избытка АТФ и цитрата, а есть избыток АДФ, то АДФ активирует ФФК, и тогда скорость всего ГДФ-пути лимитируется опять гексокиназой.
В результате фосфофруктокиназной реакции молекула фруктозо-1,6-бисфосфата распадается на 2 триозы при участии фермента альдолазы (4-я реакция):
5-я реакция:
В следующую (шестую) реакцию ГБФ-пути вступает только ФГА. В результате уменьшается его концентрация и равновесие 5-й реакции сдвигается в сторону образования ФГА. Постепенно весь ФДА переходит в ФГА, и поэтому количество АТФ, синтезировавшееся в последующих реакциях ГБФ-пути, мы учитываем в расчете на 2 молекулы ФГА и других промежуточных метаболитов, которые из него образуются. В 1-й части 1-ого этапа (от глюкозы до ФГА) расходуется 2 молекулы АТФ: одна - в гексокиназной реакции, другая - в фосфофруктокиназной (3-я реакция первого этапа ГБФ-пути). 2-я часть первого 1-го этапа начинается с окисления ФГА до ФГК (фосфоглицериновой кислоты) в 6-й реакции.
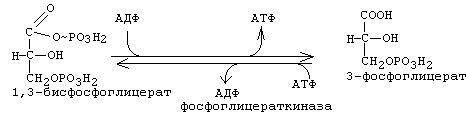
Эта реакция катализируется ферментом "глицеральдегидфосфатдегидрогеназа". Отщепляемый водород передается на НАД с образованием НАДН2. Энергии, которая выделяется при этом окислении, хватает и на то, чтобы одновременно обеспечить присоединение фосфата к альдегидной группе. Присоединяется фосфат макроэргической связью. В результате образуется 1,3-дифосфоглицериновая кислота (1,3-бисфосфоглицерат). 7-я реакция: субстратное фосфорилирование.
Фосфат с макроэргической связью передается на АДФ с образованием АТФ. В результате 7-й стадии в молекуле фосфоглицериновой кислоты остается 1 остаток фосфорной кислоты. 8-я реакция: Фосфат переносится из 3-го во второе положение и образуется 2-фосфоглицериновая кислота.
9-я реакция:
От 2-фосфоглицериновой кислоты отнимается Н2О. Это приводит к перераспределению молекулярной энергии. В результате на фосфате во втором положении накапливается энергия и связь становится макроэргической. Получается фосфоенолпируват(ФЕП). 10-я реакция: Субстратное фосфорилирование. Фосфат переносится на АДФ с образованием АТФ. ФЕП переходит в ПВК (пировиноградную кислоту).
На этом 1-й этап ГДФ-пути заканчивается, ПВК уходит в митохондрию и вступает во второй этап ГДФ-пути. Итоги 1-го этапа: 10 реакций, из которых первая, третья и десятая реакции необратимы. Сначала расходуется 2 АТФ на 1 молекулу глюкозы. Потом окисляется фосфоглицероальдегид. Энергия реализуется в ходе 2-х реакций субстратного фосфорилирования: в каждой из них образуется по 2 АТФ. Следовательно, на каждую молекулу глюкозы (на 2 молекулы ФГА) получается 4 АТФ путем субстратного фосфорилирования.
Суммарно все 10 стадий можно описать следующем уравнением: С6Н12О6 + 2Н3РО4 + 2АДФ + 2НАД -----> 2С3Н4О3 + 2АТФ + 2Н2О + 2НАДН2 НАДН2 по системе митохондриального окисления передает водород на кислород воздуха с образованием Н2О и 3 АТФ, но 1-й этап протекает в цитоплазме и НАДН2 не может проходить через мембрану митохондрий. Существуют челночные механизмы, обеспечивающие этот переход НАДН2 через митохондриальную мембрану - малат-аспартатный челнок и глицерофосфатный челнок В расчете на одну молекулу глюкозы образуется 2НАДН2.
В дополнение к 2 АТФ, получаемым на 1-м этапе путем субстратного фосфорилирования, образуется еще 6 АТФ с участием кислорода, итого - 8 молекул АТФ. Столько АТФ образуется в расчете на каждую расщепленную до ПВК молекулу глюкозы в ходе первого этапа ГБФ-пути. Если эти 8 АТФ добавить к 30 молекулам АТФ, которые образуются на 2-м и 3-м этапах, то суммарный энергетический итог всего ГБФ-пути составит 38 АТФ на каждую молекулу глюкозы, расщепленную до СО2 и Н2О. В этих 38 АТФ заключено 65 процентов энергии, которая выделилась бы при сжигании глюкозы на воздухе. Это доказывает очень высокую эффективность работы ГБФ-пути. Из 38 АТФ основная их часть образуется на 2-м и 3-м этапах. Каждый из этих этапов абсолютно необратим и требует обязательного участия кислорода, так как окислительные стадии этих этапов сопряжены с митохондриальным окислением (без него невозможны). Весь ГБФ-путь от глюкозы или гликогена до СО2 и Н2О называют: АЭРОБНЫЙ РАСПАД УГЛЕВОДОВ. Ключевые ферменты первого этапа ГБФ-пути: ГЕКСОКИНАЗА и ФОСФОФРУКТОКИНАЗА. СИНТЕЗ И РАСПАД ГЛИКОГЕНА. Гликоген — основной резервный полисахарид в клетках животных и человека, так как он плохо растворим в воде и не влияет на осмотическое давление в клетке, поэтому в клетке депонируется гликоген, а не свободная глюкоза. Разветвленная структура гликогена создает большое количество концевых мономеров. Это способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы гликогена. Гликоген депонируется главным образом в печени и скелетных мышцах. Гликоген хранится в цитозоле клеток в форме гранул. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает им взаимодействие с субстратом. Синтез и распад гликогена протекают разными метаболическими путями (рис 4). Гликоген синтезируется в период пищеварения (1—2 ч после приема углеводной пищи). Синтез гликогена требует энергии. При включении одного мономера в полисахаридную цепь протекают 2 реакции, сопряженные с расходованием АТР и UTP (реакции 1 и 3). После образования глюкозо-6-фосфата (гексокиназная реакция) происходит внутримолекулярный перенос остатка фосфорной кислоты из 6-го положения в 1-е. При этом образуется глюкозо-1-фосфат:
После изомеризации глюкозо-6-фосфата в глюкозо-1-фосфат протекает дополнительная активация глюкозного фрагмента. При этом расходуется 1 молекула УТФ, что эквивалентно расходованию 1-й молекулы АТФ. В результате образуется активированная форма - УДФ-глюкоза (рис. 4). Затем с УДФ глюкозный остаток переносится на молекулу гликогена. Удлинение цепи гликогена катализирует фермент гликогенсинтетаза. Таким образом, цепь гликогена становится на 1 глюкозный фрагмент длиннее. Гликоген, в отличие от растительного крахмала, более сильно разветвлен. Для формирования ответвлений существует специальный фермент, который называется "гликогенветвящий фермент". Молекула гликогена синтезируется не с "нуля", а происходит постепенное удлинение уже имеющегося кусочка цепи: "затравки" или праймера. И при распаде гликогена никогда не происходит полного разрушения его молекул. Для включения одного остатка глюкозы в молекулу гликогена клетка расходует 2 молекулы АТФ. При распаде гликогена эта АТФ не регенерирует, а освобождается только Фн (неорганический фосфат). Ключевым ферментом синтеза гликогена является гликогенсинтаза. Это "пункт вторичного контроля" (рис. 5). Регуляция гликогенсинтазы: она активируется избытком глюкозо-6-фосфата. Поэтому если глюкозо-6-фосфат другими путями утилизируется медленно, то возрастание его концентрации приводит к увеличению скорости синтеза гликогена. Реакция, катализируемая гликогенсинтазой, необратима. Мобилизация гликогена происходит в основном в период между приемами пищи и ускоряется во врем физической работы. Этот процесс происходит путем последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата с помощью гликогенфосфорилазы (рис. 4). Этот фермент не расщепляет a1,6-гликозидные связи в местах разветвлений, поэтому необходимы еще 2 фермента, после действия которых глюкозный остаток в точке ветвления освобождается в форме свободной глюкозы (реакции 2, 3). Гликоген распадается до глюкозо-6-фосфата без затрат АТР. Регуляция гликогенфосфорилазы: угнетается избытком АТФ, активируется избытком АДФ.
Рисунок 5 Распад гликогена в печени и мышцах имеет одну различающую их реакцию, обусловленную наличием в печени фермента фосфатазы глюкозо-6-фосфата (табл. 1).
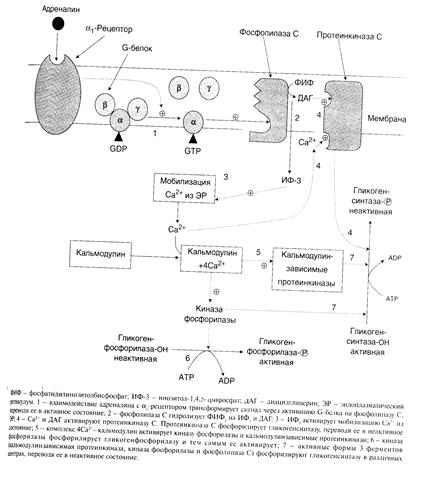
Таблица 1. Присутствие в печени глюкозо-6-фосфатазы обусловливает главную функцию гликогена печени -освобождение глюкозы в кровь в период между приемами пищи и использование ее другими органами. Таким образом, мобилизация гликогена печени обеспечивает содержание глюкозы в крови на постоянном уровне. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Через 10—18 ч после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 ч приводит к полному его исчезновению. Глюкозо-6-фосфатаза содержится также в почках и клетках кишечника. Функция мышечного гликогена заключается в высвобождении глюкозо-6-фосфата, используемого в самой мышце для окисления и получения энергии, Переключение процессов синтеза и мобилизации гликогена в печени происходит при переходе состояния пищеварения в постабсорбтивный период или состояния покоя на режим мышечной работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах — инсулин и адреналин. Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности 2 ключевых ферментов — гликогенсинтазы и гликогенфосфорилаз ы - с помощью их фосфорилирования и дефосфорилирования. Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного состояния в постабсорбтивное изменяется их относительная концентрация — инсулин-глюкагоновый индекс. Таким образом, главным переключающим фактором в печени является инсулин-глюкагоновый индекс. В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается и решающим фактором является влияние глюкагона, который стимулирует распад гликогена в печени. Механизм действия глюкагона включает каскад реакций, приводящий к активации гликогенфосфорилазы. В период пищеварения преобладающим является влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. Под влиянием инсулина происходит: а) стимуляция транспорта глюкозы в клетки мышечной ткани; б) изменение активности ферментов путем фосфорилирования и дефосфорилирования. Так, например, инсулин активирует фосфодиэстеразу и снижает концентрацию сАМР в клетке. Кроме этого, инсулин активирует фосфатазу гликогенсинтазы, последняя дефосфорилируется и переходит в активное состояние; в) изменение количества некоторых ферментов путем индукции и репрессии их синтеза. Например, инсулин индуцирует синтез глюкокиназы, ускоряя тем самым фосфорилирование глюкозы в печени. Адреналин имеет сходный с глюкагоном механизм действия на клетки печени.Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени. Тип рецепторов, с которыми взаимодействует адреналин, определяет, какая система будет использована. Так, взаимодействие адреналина с b-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с a,-рецепторами включает инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результатом действия обеих систем являются фосфорилирование ключевых ферментов и переключение синтеза гликогена на его распад (рис.6, 7). Активация адреналином мышечной гликогенфосфорилазы происходит иначе, так как распад гликогена в скелетных мышцах стимулируется мышечными сокращениями. Киназа фосфорилазы (Са2+-зависимая) активируется при мышечной работе под влиянием нервного импульса, так как в саркоплазме в этом случае возрастает концентрация ионов кальция. Это еще один механизм ускорения распада гликогена в мышце. Результатом действия адреналина в мышцах также являются активация сАМР-зависимых протеинкиназ и активация фосфорилазы путем ее фосфорилирования (рис. 8). При передаче сигнала от гормона через внутриклеточные посредники происходит значительное его усиление, поэтому активация фосфорилазы гликогена при участии любой системы передачи сигнала в клетку позволяет быстро образовать большое количество глюкозы из гликогена. В мышцах это имеет большое значение для совершения интенсивной работы в условиях стресса, например при убегании от опасности. При умеренной нагрузке в мышцах действует другой механизм регуляции активности гликогенфосфорилазы – аллостерическая регуляция продуктами распада АТФ (АМФ). При переходе из постабсорбтивного состояния в абсорбтивное или по окончании мышечной работы прекращается секреция гормонов и вся система возвращается в исходное неактивное состояние. Аденилатциклаза и фосфолипаза С инактивируются. сАМР разрушается фосфодиэстеразой, что вызывает переход всех внутриклеточных ферментов каскада в неактивную форму. Значение регуляции скоростей синтеза и распада гликогена в печени заключается в обеспечении постоянства концентрации глюкозы в крови. Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя.
Рисунок 6
Рисунок 7 НАРУШЕНИЯ ОБМЕНА ГЛИКОГЕНА 1. Гликогеновые болезни - это группа наследственных болезней, причиной которых является дефект фермента. Следствием этого является снижение или отсутствие активности какого-либо фермента, участвующего в синтезе или распаде гликогена или регуляции этих процессов. 2. Гликогенозы (болезни накопления гликогена) обусловлены дефектом ферментов, участвующих в распаде гликогена. Гликогеноз проявляется избыточным накоплением гликогена в печени, сердечной и скелетных мышцах, почках, легких и других органах. Накапливаемый гликоген может иметь как нормальную, так и измененную структуру. Результатом нарушения распада гликогена являются гипоглюкоземия и ее последствия. Существует несколько типов гликогенозов, различающихся характером и локализацией дефектного фермента. 3. Агликогенозы обусловлены нарушением синтеза гликогена и сопровождаются снижением его содержания в тканях, результатом чего также является гипоглюкоземия.
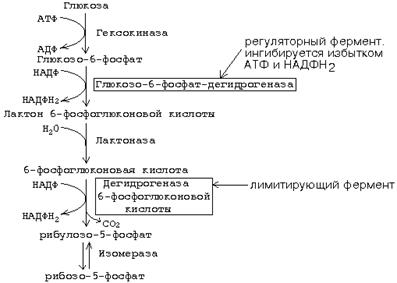
Рисунок 8 I. ОКИСЛИТЕЛЬНЫЙ ЭТАП.
Рисунок 13 II - НЕОКИСЛИТЕЛЬНЫЙ ЭТАП.
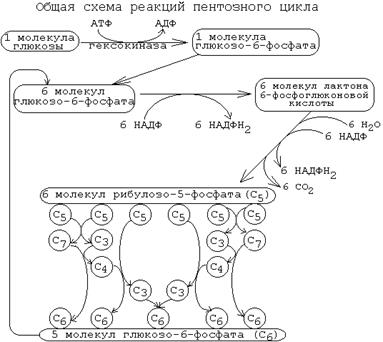
Рисунок 14 Скорость пентозофосфатного пути определяется либо 6-фосфоглюконат-дегидрогеназой, либо (когда много НАДФН2 и АТФ) - глюкозо-6-фосфат-дегидрогеназой. Реакции пентозофосфатного пути регулируются генетически на уровне биосинтеза этих ферментов. Пентозофосфатный путь существует не во всех типах клеток. Наиболее интенсивно пентозофосфатный путь протекает в печени, эритроцитах, надпочечниках, половых железах, жировой ткани и молочной железе. Но даже в этих тканях пентозофосфатный путь расщепляется не более 25-30% глюкозы. Почему в этих тканях пентозофосфатный путь имеет такое значение? Потому что клеткам этих тканей нужно много НАДФН2. Например: В жировой ткани с большой скоростью идет синтез жиров. В печени - синтез жиров, холестерина. В коре надпочечников и в половых клетках синтезируются стероидные гормоны. Для этого нужно много НАДФН2. В эритроцитах требуется НАДФН2, но не для синтезов, а для защиты от токсических эффектов кислорода. В эритроцитах многие ферменты имеют в активных центрах SH-группы, которые могут окисляться под действием кислорода. Накопленный при распаде глюкозы в пентозофосфатном пути НАДФН2 позволяет регенерировать эти SH-группы. В противном случае это может привести к гемолизу. Гормоны прямого действия. ИНСУЛИН Основные механизмы действия инсулина:
1. Инсулин повышает проницаемость плазматических мембран для глюкозы. Этот эффект инсулина является главным лимитирующим звеном метаболизма углеводов в клетках. 2. Инсулин снимает тормозящее действие глюкокортикостероидов на гексокиназу. 3. На генетическом уровне инсулин стимулирует биосинтез ферментов метаболизма углеводов, в том числе ключевых ферментов. 4. Инсулин в клетках жировой ткани ингибирует триглицеридлипазу - ключевой фермент распада жиров. Регуляция секреции инсулина в кровь происходит с участием нейро-рефлекторных механизмов. В стенках кровеносных сосудов есть особые хеморецепторы, чувствительные к глюкозе. Повышение концентрации глюкозы в крови вызывает рефлекторную секркцию инсулина в кровь, глюкоза проникает в клетки и ее концентрация в крови снижается. Остальные гормоны вызывают повышение концентрации глюкозы в крови.
ГЛЮКАГОН. 1. Вызывает повышение активности гликогенфосфорилазы. В результате ускоряется распад гликогена. Так как глюкагон оказывает эффект только в печени то можно сказать, что он "гонит глюкозу из печени". 2. Понижает активность гликогенсинтетазы, замедляя синтез гликогена. 3. Активирует липазу в жировых депо. АДРЕНАЛИН. Имеет рецепторы во многих тканях, а механизмы действия у него такие же, как у глюкагона. 1. Ускоряет распад гликогена. 2. Замедляет синтез гликогена. 3. Ускоряет липолиз.
ГЛЮКОКОРТИКОСТЕРОИДЫ (ГКС). 1. Ингибируют гексокиназу - таким образом они замедляют утилизацию глюкозы. В результате концентрация глюкозы в крови возрастает. 2. Данные гормоны обеспечивают процесс гликонеогенеза субстратами. 3. На генетическом уровне усиливают биосинтез ферментов катаболизма белков. Гормоны косвенного действия СОМАТОТРОПНЫЙ ГОРМОН. 1. Усиливает выделение глюкагона, поэтому наблюдается ускорение распада гликогена. 2. Вызывает активацию липолиза, поэтому способствует утилизации жира в качестве источника энергии.
ЙОДСОДЕРЖАЩИЕ ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ. Поэтому эти гормоны усиливают биосинтез белков на уровне транскрипции. Среди этих белков - окислительные ферменты, в частности разнообразные дегидрогеназы. Кроме того, они стимулируют синтез АТФаз, т.е. ферментов, которые разрушают АТФ. Для процессов биоокисления требуются субстраты - продукты окисления углеводов и жиров. Поэтому при увеличении продукции этих гормонов наблюдается усиление распада углеводов и жиров. Список использованной литературы 1.Биохимия. Краткий курс с упражнениями и задачами /под редакцией член – корр РАН, проф. Е.С. Северина и проф. А.Я. Николаева – М.: ГЭОТАР-МЕД, 2001.- 448 с. 2.Гринстейн Б., Гринстейн А. Наглядная биохимия: Пер. с анг.-М.: ГЭОТАР-МЕД, 2000.- 119 с – («Экзамен на отлично») 3.Биохимические основы патологических процессов / Под ред. Е.С. Северина. – М.: Медицина, 2000. – 304 с. 4.Бышевский А.Ш., Терсенов О. А. Биохимия для врача. — Екатеринбург: «Уральский рабочий», 1994. — 384 с., ил. 5.Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Пер. с англ.: — М.: Мир, 1993. — 899 с., ил.
ДИНАМИЧЕСКАЯ БИОХИМИЯ Ч. 1. ОБМЕН И ФУНКЦИИ УГЛЕВОДОВ УЧЕБНОЕ ПОСОБИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ Караганда 2003
|
||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 227; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.144.32 (0.126 с.) |