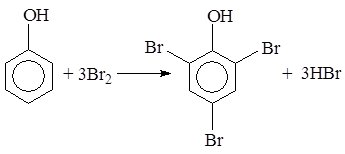Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
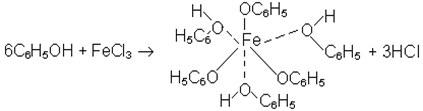
Дослiд 3. Реакцiя фенолу з ферум (III) хлоридом
У пробiрку вносять 2 краплi розчину фенолу, додають 3 краплi води i краплю розчину ферум (III)хлориду. З’являється iнтенсивне червоно-фiоле-тове забарвлення. Феноли з ферум (III)хлоридом у водному розчинi дають кольорову реакцiю внаслiдок утворення забарвленої сполуки, або, точнiше, забарвленого iона. Ця реакцiя служить для якiсного визначення фенолу:
синій розчин Дослiд 4. Отримання трибромфенолу
У пробiрку вносять 2 краплi бромної води i додають краплю фенолу. При цьому бромна вода знебарвлюється, i утворюється бiлий осад трибромфенолу. Хiмiзм процесу:
2,4,6-трибромфенол
Гiдроксильна група належить до найбiльш сильних орто-пара-орiєн-тантiв. Реакцiя електрофiльного замiщення Гідрогену у бензольному ядрi для фенолiв проходить значно легше i в бiльш м’яких умовах, нiж для бензолу.
Лабораторна робота № 9 АЛЬДЕГІДИ ТА КЕТОНИ Дослiд 1. Окиснення альдег iдiв амонійним розчином аргентум оксиду (реакцiя "срiбного дзеркала")
У чисту пробiрку вводять по 2 краплi розчину амiаку і аргентум нітра-ту. Утворюється осад аргентум гiдроксиду, який розчиняють надлишком (1-2 краплi) розчину амонiаку. Потiм додають краплю розчину формальдегiду i повiльно пiдiгрiвають сумiш у пробiрцi над полум’ям пальника. При обережному нагрiваннi сумiш пробiрки бурiє i на стiнках може видiлитися срiбло у виглядi блискучого дзеркального нальоту (комплексний iон металу вiднов-люється до металiчного срiбла). Альдегiд окиснюється до кислоти, яка утво-рює амонійну сiль. Хiмiзм процесу: AgNO3 + NH4OH ® AgOH + NH4NO3 2AgOH ® Ag2O + H2O Ag2O + 4NH4OH ® 2[Ag(NH3)2]OH + 3H2O Ця реакцiя – якiсна на альдегiди: H-COH + 2[Ag(NH3)2]OH ® HCОONH4 + 2Ag + 3NH3 + H2O Дослiд 2. Окиснення альдегiдiв купрум (II) гiдроксидом
У пробiрку вносять 4 краплi розчину їдкого натру, розбавляють його 4 краплями води i додають 2 краплi розчину купрум (II)сульфату. До осаду купрум (II) гiдроксиду, який випав, додають краплю розчину формальдегiду i збовтують сумiш у пробiрцi. Нагрiвають над полум’ям пальника до кипiння тiльки верхню частину так, щоб нижня лишалася для контролю холодною. В нагрiтiй частинi пробiрки видiляється жовтий осад купрум (I) оксиду Сu2О, а iнодi на стiнках пробiрки з`являється навiть металiчна мiдь.
Хiмiзм процесу: СuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4 H-COH + 2Cu(OH)2 ® HCOOH + 2CuOH + H2O 2CuOH ® Cu2O + H2O Ця реакцiя також якiсна на альдегiди.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 1659; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.140.227 (0.005 с.) |