
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моль. Эквиваленты и мольные массы эквивалентов простых и сложных веществ. Закон эквивалентов.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Задания к контрольной работе №1
Моль. Эквиваленты и мольные массы эквивалентов простых и сложных веществ. Закон эквивалентов.
Эквивалент (Э) - это условно существующая частица вещества, которая при взаимодействии равнозначна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно - восстановительных реакциях. Условная частица - это целое или доля реально существующей частицы (атома, молекулы, иона). Число эквивалентности Z (эквивалентное число) показывает, сколько эквивалентов вещества составляют одну реальную частицу вещества. Например, Химическое сродство Для решения задач этого раздела рекомендуем воспользоваться таблицами 2, 3. Первый закон термодинамики не позволяет определить, в каком направлении процесс может протекать самопроизвольно. Критерием самопроизвольного протекания реакции в изолированной системе служит функция состояния S, названная Р. Клаузиусом энтропией. Самопроизвольные процессы могут идти только с увеличением энтропии и будут идти до тех пор, пока система не перейдет в равновесное состояние и энтропия не достигнет максимального для данных условий значения. На основе постулата Планка рассчитано абсолютное значение энтропии многих простых веществ, химических соединений и приведено в справочной литературе (при стандартных условиях). С помощью справочных данных можно рассчитать изменение энтропии, происходящее при химической реакции по следствию из закона Гесса:
где Пример 1. Определите возможность протекания реакции:
Решение: Используя значения стандартных энтропий веществ (табл. 2) рассчитаем стандартную энтропию реакции:
В результате реакции энтропия уменьшилась и, следовательно, процесс в изолированной системе самопроизвольно протекать не может. В природе и технике большинство химических процессов протекают в неизолированных системах, то есть в условиях теплообмена с окружающей средой. В этих системах критерием направленности процесса служит изменение термодинамических потенциалов G, F.
G – энергия Гиббса для условий p = соnst и Т = const; F – энергия Гельмгольца для условий V = const и Т = const. Изменение энергии Гиббса (
Термодинамические потенциалы G и F можно также рассчитать с помощью следствия из закона Гесса с использованием стандартных величин
Пример 2. Определите возможность протекания реакции:
в системе при стандартных условиях и при температуре 1000 К. Установить температуру, при которой система будет находиться в равновесии. Решение: Воспользуемся результатами решения предыдущих примеров:
Для приближенных расчетов
При равновесии:
T = Таким образом, при стандартных условиях реакция возможна, так как
Контрольные вопросы 41. Вычислите изменение энтропии в результате реакции образования аммиака из азота и водорода. При расчете можно исходить из 42. Определите
Вычисления сделайте на основании стандартных теплот образования и стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях. 43. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению:
При какой температуре начнется реакция? 44. Вычислите стандартные значения
и определите, какой из карбонатов обладает большей термической устойчивостью?
45. Вычислите возможность протекания при стандартных условиях реакции:
46. Вычислите изменение энергии Гиббса при
47. В каком направлении нижеприведенная реакция будет протекать самопроизвольно:
Необходимые для расчета 48. Определите, при какой температуре начнется реакция восстановления: 49. Образование сероводорода из простых веществ протекает по уравнению
Исходя из значений
50. Вычислите возможность протекания при стандартных условиях реакции:
51. Вычислите изменение энергии Гиббса при
зная 52. Вычислите значения
и составьте ряд термической стабильности карбонатов 53. Какие из приведенных реакций протекают самопроизвольно и являются экзотермическими:
54. Укажите, какая из двух реакций будет протекать самопроизвольно:
55. В каком направлении ниже приведенная реакция будет протекать самопроизвольно:
Рассчитать с использованием 56. На основании значений
Укажите, в каком направлении эти реакции будут протекать, приближаясь к равновесию. 57. Определить стандартное изменение энтропии при
Сделать вывод о возможности самопроизвольного протекания реакций. 58. Для каких оксидов 59. Пользуясь значениями
Сделать вывод о возможности самопроизвольного протекания реакции. 60. Реакция горения ацетилена протекает по уравнению:
Вычислите Химическая кинетика Химическая кинетика изучает скорость химических реакций (υ), которая определяется как изменение концентрации реагирующих веществ или продуктов реакции в единицу времени в постоянном реакционном пространстве. В общем случае υ где ∆C – изменение концентрации; τ – время протекания реакции в секундах. Скорость реакции зависит от: 1. концентрации реагирующих веществ; 2. природы реагирующих веществ; 3. температуры реакционной смеси; 4. наличия катализатора в системе. Зависимость скорости химической реакции от концентрации определяется законом действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам. Математическое выражение закона действующих масс для системы аА + bB = cC + dD выглядит следующим образом:
где k – коэффициент пропорциональности или константа скорости, которая не зависит от концентрации, но зависит от природы реагирующих веществ, температуры и катализатора; [А] и [В] – концентрации веществ А и В; a, b – стехиометрические коэффициенты. Влияние температуры на скорость химической реакции определяется правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость реакции изменяется в 2-4 раза.
где υ2 и υ1 – скорости реакций при температурах Т2 и Т1 соответственно; γ – температурный коэффициент Вант-Гоффа, который может принимать значения от 2 до 4; ∆Т = Т2 –Т1. Если один из реагентов находится в твердой фазе (гетерогенная система), то скорость химической реакции зависит от общей поверхности твердого вещества или от степени его дисперсности. Однако в общем случае изучение скорости реакции проводят в условиях не изменяющейся поверхности. Тогда в выражение скорости реакции входит только концентрация жидкого или газообразного компонента и не входит площадь поверхности. Например, скорость реакции между поверхностью раскаленного угля и парами воды
В системах, где одно или несколько веществ являются газами, скорость химической реакции зависит также от внешнего давления. В этом случае в выражение скорости может быть введено значение парциального давления. Пример 1. Во сколько раз изменится скорость прямой и обратной реакций в системе Решение: Обозначим концентрации реагирующих веществ: [SO2] = а; [O2] = b; [SO3] = с. Согласно закону действия масс скорости прямой и обратной реакции до изменения объема имеют следующие выражения:
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза, т.е. [SO2] = 3а; [O2] = 3b; [SO3] = 3с. Тогда при новых концентрациях скорости прямой и обратной реакций можно записать следующим образом:
Отсюда
Следовательно, скорость прямой реакции увеличится в 27 раз, а обратной – только в 9 раз. Пример 2. Вычислить, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 °С. Решение: Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле: υ2 = υ1∙γ∆T/10 = υ1∙270-30/10 = υ1∙24 = 16∙υ1 Следовательно, скорость реакции при температуре 70°С больше скорости реакции при температуре 30°С в 16 раз.
Контрольные вопросы 61. Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению А + 2В = АВ2 и определите, во сколько раз увеличится скорость этой реакции, если: а) концентрация вещества А увеличится в 2 раза; б) концентрация вещества В увеличится в 2 раза; в) концентрация обоих веществ увеличится в 2 раза.
62. Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 63. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 64. Напишите выражение для скорости реакции 65. Реакция между оксидом азота (II) и хлором протекает по уравнению 66. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40°С, если γ = 3,2? 67. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)? 68. При повышении температуры на 50°С скорость реакции возросла в 1200 раз. Вычислите температурный коэффициент реакции. 69. Вычислите температурный коэффициент реакции, если константа скорости ее при 120°С равна 6,7·10-2. 70. Реакция между веществами А и В выражается уравнением А + 2В = С. Начальные концентрации соответственно равны 0,3 и 0,5 моль/л. Константа скорости равна 0,4 л2/(моль2∙с). Вычислите скорость реакции в начальный момент и в тот момент, когда концентрация вещества А уменьшилась на 0,1 моль/л. 71. Температурный коэффициент реакции равен 3. Вычислите, во сколько раз увеличится скорость реакции при увеличении температуры с 22 до 62°С? 72. Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гомогенной системе: a) б) в) 73. Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гетерогенной системе: а) б) в) 74. Определите, как изменится скорость прямой реакции
75. Как изменится скорость прямой реакции
76. При повышении температуры на 30°С скорость химической реакции увеличилась в 64 раза. Вычислите, во сколько раз увеличится скорость этой реакции при повышении температуры на каждые 10°С. 77. Рассчитайте температурный коэффициент реакции, если при нагревании системы от 40°С до 80°С скорость возросла в 64 раза. 78. Температурный коэффициент реакции равен 3. При какой температуре следует проводить эту реакцию, чтобы скорость реакции, идущей при 100°С, уменьшилась в 27 раз? 79. Как изменится скорость прямой и обратной реакции, если объем газовой смеси 80. Во сколько раз следует увеличить давление в системе
Химическое равновесие
Для решения задач этого раздела рекомендуем воспользоваться литературой 6, 7, 9 и таблицей 1 ᾽᾽Стандартные энтальпии образования веществ᾽᾽.
Химические реакции бывают обратимыми и необратимыми. Для обратимых реакций характерно состояние химического равновесия. Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны между собой, т.е.
Равновесное состояние системы характеризуется константой химического равновесия. Так, например, для обратимой реакции
константа химического равновесия выражается следующим образом В общем случае в обратимых химических реакциях равновесие устанавливается в тот момент, когда отношение произведения концентраций продуктов реакции, возведенных в степени, равные стехиометрическим коэффициентам, к произведению концентраций исходных веществ, также возведенных в соответствующие степени, равно постоянной величине, называемой константой равновесия. Константа равновесия зависит от природы реагирующих веществ и от температуры. Концентрации, при которых устанавливается равновесие, называются равновесными. Изменение внешних условий, таких как температура, концентрация, давление, приводят к нарушению равновесия в системе и переходу ее в новое равновесное состояние. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, производить какое-либо внешнее воздействие, то в этой системе самопроизвольно происходят процессы, ослабляющие оказанное воздействие. Пример 1. Куда будет смещаться равновесие при изменении температуры для системы 2NO2 ⇄ N2O4; ∆H= -57 кДж/моль? Решение: В ходе реакции наблюдается выделение теплоты, реакция является экзотермической. В соответствии с принципом Ле Шателье равновесие для данной системы будет смещаться в сторону ослабления оказанных воздействий. Значит, при повышении температуры равновесие смещается в сторону эндотермической реакции, т.е. влево. Если же температуру системы понижать, то равновесие сместится вправо, т.е. в сторону прямой реакции. Пример 2. В какую сторону сместится равновесие в системе:
Решение: По принципу Ле Шателье изменение концентрации одного из исходных веществ приводит к определенным изменениям в равновесном состоянии системы. В конкретном случае при уменьшении концентрации иода равновесие сместится в сторону его воспроизведения, т.е. в сторону обратной реакции, в результате которой из иодоводорода и будет получаться дополнительное количество иода. Пример 3. Как сместится равновесие в системе:
Решение: В соответствии с принципом Ле Шателье увеличение внешнего давления вызовет такие изменения, которые приведут к уменьшению давления в системе. Так как из 4 моль газа (из четырех объемов) образуется 2 моль (два объема) аммиака, то равновесие сместится вправо, т.е. в сторону меньшего объема. Пример 4. Константа равновесия гомогенной системы:
[СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Решение: При равновесии скорость прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы: υпр = k1[СО][Н2О]; υобр = k2[СО2][Н2];
В условии задачи даны исходные концентрации, тогда как в выражение
Зная константу равновесия, находим значение х, затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации: [СО2]р = 1,2 моль/л; [Н2]р = 1,2 моль/л; [СО]р = 3-1,2 = 1,8 моль/л; [Н2О]р = 2-1,2 = 0,8 моль/л.
Контрольные вопросы 81. Напишите выражение для константы равновесия следующих обратимых процессов: а) б) 82. При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2] = 2,5; [H2] = 1,8; [NH3] = 3,6 моль/л. Рассчитайте значение константы равновесия и исходные концентрации. 83. Как повлияет повышение давления и температуры на равновесие следующих обратимых реакций: а) б) в) 84. Используя справочные данные (табл. 1), определите, в какую сторону произойдет смещение равновесия гомогенных реакций:
при следующих воздействиях: а) охлаждение системы; б) увеличение давления. 85. Константа равновесия для реакции 86. Исходные концентрации 87. Почему при изменении давления смещается равновесие системы 88. При некоторой температуре равновесие в гомогенной системе 89. Константа равновесия гомогенной системы 90. Константа равновесия системы при постоянной температуре 91. Равновесие гомогенной системы при Т=const
92. Напишите выражение для константы равновесия гетерогенной системы 93. Напишите выражение для константы равновесия гетерогенной системы 94. Составьте выражение для константы равновесия реакции, протекающей в закрытой системе при постоянной температуре:
95. Установите, во сколько раз уменьшится или увеличится равновесная концентрация оксида углерода в реакции: 96. Как увеличить выход продуктов реакций
за счет изменения концентрации реагентов, давления, температуры? 97. Вычислите константу равновесия для следующей реакции 98. Вычислите константу равновесия реакции 99. Константа равновесия системы 100. Вычислите равновесные концентрации веществ в реакции Свойства растворов Важной физико-химической характеристикой твердых и жидких тел является давление пара, определяющее состояние равновесия между конденсированной и газообразной фазами. Чем выше давление пара, тем больше равновесие смещается в сторону процессов сублимации и испарения. Поэтому давление насыщенного пара над раствором используется для объяснения его поведения и свойств. Понижение давления пара над раствором приводит к изменению температур кипения и замерзания по отношению к чистым растворителям. Известно, что жидкость кипит или кристаллизуется, когда давление ее насыщенного пара становится равным внешнему давлению или давлению насыщенного пара над твердой фазой, в которую она переходит. Раствор вследствие пониженного давления его паров труднее достигает точки кипения или точки кристаллизации. В связи с этим растворы кипят при более высоких и кристаллизуются при более низких температурах, чем чистые растворители. По закону Рауля: повышение температуры кипения или понижение температуры кристаллизации раствора прямо пропорционально моляльной концентрации растворенного вещества:
где
Закон Рауля имеет практическое значение - по изменению температуры кипения и кристаллизации определяют молекулярные веса неизвестных веществ. Преобразуем математические уравнения закона Рауля. Зная, что
получим
где М – молярная масса вещества;
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 298; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.154.171 (0.154 с.) |
 , таким образом, два эквивалента гидроксида кальция составляют одну молекул 2Э (
, таким образом, два эквивалента гидроксида кальция составляют одну молекул 2Э ( ) =
) =  .
. 
 ;
; – стандартная энтропия вещества, n – cтехиометрические коэффициенты в уравнении реакции.
– стандартная энтропия вещества, n – cтехиометрические коэффициенты в уравнении реакции.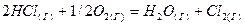 в изолированной системе.
в изолированной системе.
 G) характеризует максимально полезную работу процесса и указывает на возможное самопроизвольное его протекание. Самопроизвольным является всякий процесс, в результате которого, энергия системы уменьшается (
G) характеризует максимально полезную работу процесса и указывает на возможное самопроизвольное его протекание. Самопроизвольным является всякий процесс, в результате которого, энергия системы уменьшается ( ), так и энтропийный (
), так и энтропийный ( ) факторы. Для расчета используется соотношение:
) факторы. Для расчета используется соотношение: ;
; 
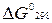 и
и  (табл. 2).
(табл. 2).

 -57240 - 298 · (-64,175) = -38115Дж
-57240 - 298 · (-64,175) = -38115Дж можно принять:
можно принять:
 = - 57240 Дж;
= - 57240 Дж;  =
= 
 реакции, протекающей по уравнению:
реакции, протекающей по уравнению:



 для реакций:
для реакций:



 зная
зная 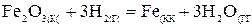
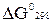 реагирующих веществ взять из справочной литературы.
реагирующих веществ взять из справочной литературы.


 и
и для этой реакции в стандартных условиях.
для этой реакции в стандартных условиях.
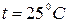
 ,
, ,
,  ,
,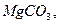







 0 для следующих процессов:
0 для следующих процессов:

 для следующих реакций:
для следующих реакций:


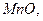
 принципиально осуществима реакция восстановления водородом в стандартных условиях, выводы сделайте на основании расчета
принципиально осуществима реакция восстановления водородом в стандартных условиях, выводы сделайте на основании расчета  и
и 

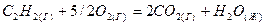
 ,
, ,
, ,
, зависит только от концентрации водяного пара
зависит только от концентрации водяного пара .
. ⇄
⇄  , если объем газовой смеси уменьшить в три раза?
, если объем газовой смеси уменьшить в три раза?

 = k (3a)2 3b = 27 k a2 b;
= k (3a)2 3b = 27 k a2 b; 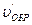 = k1(3c)2 = 9 k c2
= k1(3c)2 = 9 k c2 = 27 k a2 b/ k a2 b = 27;
= 27 k a2 b/ k a2 b = 27; = 9 k c2/ k1 c2 = 9.
= 9 k c2/ k1 c2 = 9.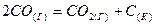 , чтобы скорость реакции увеличилась в 4 раза?
, чтобы скорость реакции увеличилась в 4 раза? ⇄
⇄  , возросла в 1000 раз?
, возросла в 1000 раз? и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в 3 раза.
и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в 3 раза. ⇄
⇄  . Как изменится скорость реакции при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза?
. Как изменится скорость реакции при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза? ⇄
⇄ 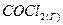 ;
; ⇄
⇄  .
. ⇄
⇄  ;
; ⇄
⇄  ;
; ⇄
⇄  .
.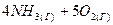 ⇄
⇄  , если объем газовой смеси уменьшить в 2 раза?
, если объем газовой смеси уменьшить в 2 раза? ⇄
⇄  , чтобы скорость образования HI возросла в 100 раз?
, чтобы скорость образования HI возросла в 100 раз? υпр = υобр
υпр = υобр
 ⇄
⇄  , если увеличить давление?
, если увеличить давление? ⇄
⇄  при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации:
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации:
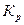 входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация
входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация  х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ составляют:
х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ составляют: ;
;  ;
;  .
.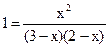 ;
; 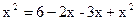 ;
; 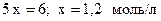 .
. ⇄
⇄  ⇄
⇄ 
 ⇄
⇄ 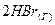 , ∆H < 0
, ∆H < 0 ⇄
⇄  , ∆H > 0
, ∆H > 0 и
и  в гомогенной системе
в гомогенной системе 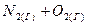 ⇄
⇄  ? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем.
? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем.

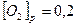

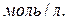 Вычислите константу равновесия и исходную концентрацию оксида азота и кислорода.
Вычислите константу равновесия и исходную концентрацию оксида азота и кислорода. равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют:
равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: 







 ⇄
⇄  . Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции?
. Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции? ⇄
⇄  . Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз.
. Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз.

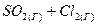 ⇄
⇄  , а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/ли5,5 моль/л.
, а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/ли5,5 моль/л. ⇄
⇄  , если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль
, если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль  .
.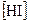 и
и  , если исходная концентрация йодоводорода равна 2 моль/л.
, если исходная концентрация йодоводорода равна 2 моль/л. ⇄
⇄  , если константа равновесия реакции равна 1,89, а исходная концентрация
, если константа равновесия реакции равна 1,89, а исходная концентрация 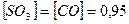
 и
и 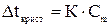


 - моляльная концентрация, моль/г
- моляльная концентрация, моль/г - эбуллиоскопическая константа
- эбуллиоскопическая константа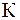 - криоскопическая константа.
- криоскопическая константа.
 и
и  .
. - масса растворителя, г;
- масса растворителя, г; - масса растворенного вещества, г.
- масса растворенного вещества, г.


