Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассказ первый - порядок из хаоса
Первый критерий: что-нибудь, где-нибудь должно изменяться Начнем с логического начала. Если память требует изменений в биохимии и структуре определенных клеток, значит, при образовании энграмм что-то и где-то в мозгу должно изменяться, но мы не знаем точно, что и где. Хуже того, анатомическое строение мозга у кур сильно отличается от его строения у млекопитающих, и до сих пор нет хорошего атласа; поэтому мне нельзя было опираться на догадки, на которые наводит знакомство с мозгом млекопитающих: у цыплят, в частности, нет того, что я мог бы назвать гиппокампом. В связи с этим для начала мне нужен был метод, который не зависел бы от локализации и механизмов изучаемых процессов. Практически любой биохимический процесс, в особенности связанный с повышением активности нейронов и синтезом в них макромолекул, требует затраты энергии. Мозг получает энергию, сжигая глюкозу; поэтому, установив, где и когда используется больше глюкозы в первые минуты после обучения, можно узнать, какая область мозга имеет отношение к хранению следов памяти. К счастью, для этого имеется довольно простой способ. Он основан на применении синтетического вещества, очень похожего на глюкозу - 2-дезоксиглюкозы (2-дГ). Если 2-дГ ввести в кровяное русло, нейроны (и все другие клетки тела) будут обмануты и начнут поглощать ее так же, как глюкозу. Внутри клетки первый же из набора ферментов, расщепляющих глюкозу, тоже примет 2-дГ за природный сахар и станет превращать ее в 2-дезоксиглюкозо-6-фосфат (2-дГ-6Ф). Это первый этап нормального расщепления глюкозы. Однако следующий по порядку фермент, который должен был бы воздействовать на глюкозо-6-фосфат, оказывается умнее и не желает иметь дело с 2-дГ-6Ф. Поэтому последний накапливается в клетках, и его количество служит мерой того, сколько они используют глюкозы. Если вводимая в кровоток 2-дГ содержит радиоактивную метку, то происходит накопление меченого 2-дГ-6Ф, и остается только измерить радиоактивность в клетке. Согласно плану эксперимента, 2-дГ вводят цыплятам, клюющим смоченные метилантранилатом или водой бусины, выжидают полчаса, чтобы в клетках накопился 2-дГ-6Ф, забивают цыплят, извлекают и замораживают их мозг, а потом измеряют в нем радиоактивность. Но задача состоит не в том, чтобы просто выяснить, возросло ли содержание метки в мозгу обученных птенцов по сравнению с контрольными; нужно еще установить, в каком отделе мозга это произошло. Вот здесь-то и нужна методика с использованием 2-дГ. Замороженный мозг помещают в лабораторную разновидность миниатюрной мясорезки, называемую криостатом, и делают серию очень тонких срезов. Срезы переносят на предметные стекла, которые затем прижимают к листу рентгеновской пленки, заворачивают в черную светонепроницаемую бумагу и оставляют в темной комнате. После этого остается подождать несколько дней или месяцев (сроки зависят от количества радиоактивности) и проявить пленку, называемую теперь радиавтографом (а сам процесс называют радиавтографиеи).
Каждый срез оставит на пленке отпечаток, который будет тем темнее, чем больше радиоактивной метки содержалось в ткани. Степень затемненности каждого участка измеряют с помощью автоматического сканера, который своим тонким лучом прощупывает изображение и регистрирует поглощение света. С помощью компьютера черно-белое изображение можно перевести в цветное, которое легче и приятнее рассматривать, хотя цвета совершенно условны и не дают никакой дополнительной информации. Теперь можно сравнить количество метки последовательно в каждом отделе мозга контрольных и обучавшихся цыплят и попытаться выявить разницу. Я проводил такой опыт четыре сумасшедших недели в 1980 году вместе с фанатично преданной делу Маргарет Кошут - специалистом по радиоавтографии из Варшавы, а на следующий год повторил его более углубленно с нейроанатомом из Будапешта Андрашем Чиллагом, который помог идентифицировать те анатомические структуры, где Маргарет и я обнаружили изменения. Результаты были ясны. Два участка - IMHV (Intermediate Medial Hyperstriatum Ventrale) и LPO (Lobus Parolfactorius) - «светились» у обученных животных сильнее, чем у контрольных. При этом сразу после обучения содержание радиоактивной метки было особенно высоким в левом IMHV и в левом LPO. Иначе говоря, несмотря на двустороннюю симметрию куриного мозга, состоящего, как и у млекопитающих, из двух внешне идентичных полушарий, эффект обучения был асимметричен: научением у цыплят в большей мере ведало левое полушарие [5]1.
*1) Существует множество усердно распространяемых мифов и почти мистических истолкований асимметрии человеческого мозга, от радикально-феминистских взглядов и идей биологического детерминизма о левосторонней рассудочной природе мужского мозга и правосторонней эмоциональной природе мозга женщин до утверждений нейропсихолога сэра Джона Эклса - католика и лауреата Нобелевской премии - о том, что функциональная асимметрия свойственна только человеку и что левое полушарие служит пристанищем души [6]. Хотя в наши дни этот почти нездоровый интерес к возможной роли и уникальности асимметрии нашего мозга облечен в изощренные формулировки современной неqробиологии, своими корнями он уходит во вторую половину XIX века. Именно тогда, исходя из результатов посмертного вскрытия людей, утративших дар речи (афазия) в результате инсульта или иных поражений мозга, французский нейроанатом Поль Брока установил локализацию «речевого центра» в левой лобной доле. На этом основании Брока, в вслед за ним и многие другие разработали целый спекулятивный аппарат для доказательства уникальности функциональной асимметрии (латерализации) мозга у человека и значительно большей ее выраженности у мужчин и белых по сравнению с женщинами, детьми и чернокожими. И тогда, и теперь это обычно не более чем идеологические фантазии [7]. Но если Эклс прав и функциональная латерализация действительно нужна для существования души, то любой из моих цыплят может в такой же степени претендовать на обладание ею, как и сам сэр Джон. Эти результаты были важны для нас по нескольким причинам. Во-первых, было очень интересно найти изменение в IMHV после выработки пассивного избегания, потому что Габриел Хорн раньше уже показал ключевую роль этой области мозга в импринтинге. Результаты экспериментов с пассивным избеганием и импринтингом начинали совпадать, что было хорошей новостью для обеих лабораторий. Но ни его, ни наша лаборатория не имела ни малейшего понятия, какой может быть функциональная связь (если она вообще существует) между IMHV и LPO или какова роль каждой из этих областей в деятельности мозга. Насколько мы знали, у цыплят IMHV представляет собой нечто вроде «ассоциативной коры» млекопитающих - области, где сходятся и, вероятно, интегрируются сигналы от многих сенсорных систем. Еще меньше ясности было в отношении LPO. Некоторые исследователи считали эту долю в основном «выходной» областью, координирующей двигательные реакции, в том числе клевание. По мнению других, она имела больше отношения к эмоциональным реакциям птиц, во всяком случае к чувству опасности и к ощущению неприятного вкуса (рис. 10.2).
Рис. 10.2. Разрез переднего мозга цыпленка. На этой микрофотографии показано расположение IMHV и LPO. Другие отделы мозга: НА - hyperstriatum accessorium; N - neostriatum; PA - paleostriatum augmentatum. Темноокрашенная древовидная структура слева вверху - мозжечок. Во-вторых, полученные результаты подтвердили то, о чем мы уже начинали догадываться: выраженную функциональную разницу между левой и правой частями мозга у кур. Накапливалось все больше данных о латерализации функций в мозгу у птиц; в частности, цыплята ведут себя по-разному, реагируя на предметы, которые видят правым или левым глазом [8], тогда как у певчих птиц, таких, как канарейки и зебровые амадины, «центр пения» расположен в одном из отделов левого полушария довольно близко к IMHV [9]. Но в то время мы не представляли себе, о чем могут говорить эти различия между двумя половинами мозга. Некоторые догадки появятся в конце следующей главы.
В-третьих, эти результаты имели и практическое значение: теперь мы узнали, где следует искать другие возможные изменения. Сконцентрировав внимание на IMHV и LPO и отбрасывая «ненужные» нам ткани, мы могли надеяться усилить любой изучавшийся эффект путем снижения уровня фонового шума. Обе указанные области очень малы; иссеченные из мозга, они весят не более двух миллиграммов каждая. Андраш придумал специальную пластмассовую форму, в которую мы помещали мозг, делали его срезы бритвенным лезвием, а потом тонким скальпелем вырезали под микроскопом нужные участки. Теперь мы были готовы двигаться дальше. Второй критерий: ход изменений во времени. Если выводы Мэри Гиббс о фазах памяти (см. рис. 10.1) были верны, то следовало ожидать, что в первые минуты или часы после клевания горькой бусины в левых, а возможно, и в правых IMHV и LPO будет происходить ряд клеточных изменений, связанных с этими фазами. Поскольку в следующих абзацах речь пойдет о чистой биохимии и я не вижу способа избежать этого, читатель, который не переносит всех этих подробностей, может найти обобщенную схему описываемых процессов на рис. 10.3, а потом перепрыгнуть сразу на страницу 34. Но биохимия - мой хлеб, и я искренне надеюсь, что все эти детали заслуживают хотя бы беглого знакомства с ними.
Рис. 10.3. Молекулярный каскад памяти. Кривые схематически показывают последовательность молекулярных изменений, наблюдаемых в IMHV цыпленка в разные сроки после опыта с горькой бусиной. Мы еще раньше обнаружили кратковременное повышение активности мускариновых рецепторов ацетилхолина. Если бы я работал, как полагается, систематически, то я должен был бы вернуться назад и подробно выяснить, что происходит с этими и другими рецепторами в IMHV. Но я сделал это лишь спустя несколько лет и показал тогда, что сильнее всего изменялось содержание NMDA-рецепторов для глутамата, о которых я говорил в предыдущей главе (и не буду касаться их снова). Но сначала мое внимание привлекли полученные на гиппокампе данные о роли фосфорилированных белков в синаптических мембранах (см. гл. 9). Я не мог устоять перед искушением изучить их у цыплят, может быть потому, что много лет назад моя собственная диссертация была посвящена этим белкам, хотя тогда я не осознавал в полной мере их значение (см. гл. 3).
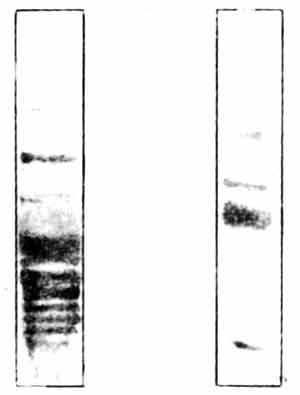
Пре- и постсинаптические мембраны можно выделить из IMHV методом центрифугирования, примерно так, как описано в главе 3, и исследовать их в чистом виде. Разумеется, они содержат и белки, и фосфорилирующий их фермент протеинкиназу С. Если к ничтожному количеству мембранного материала добавить радиоактивный АТФ и несколько минут инкубировать полученную смесь в крошечной пробирке, мембранные белки окажутся мечеными и фосфорилированными. Другой простой, но остроумный метод позволяет выделить отдельные белки и измерить количество радиоактивной метки в каждом из них. В этом методе используются различия в молекулярном весе и электрических свойствах между сотнями присутствующих в мембранах белков, каждый из которых несет на себе специфический набор положительных и отрицательных зарядов. Для того чтобы разделить такие белки, берут небольшую прямоугольную полоску из студенистого инертного материала - крахмального или акриламидного геля, наносят на один ее конец каплю раствора с белковой смесью и пропускают через гель электрический ток. Белки перемещаются под действием тока с разной скоростью, зависящей от их молекулярного веса и электрического заряда, и через несколько часов распределяются по всей длине полоски. Эта процедура называется, гель-электрофорезом. Гель пропитывают красителем, который окрашивает белки, и они становятся видны на бесцветном фоне геля как последовательность синих полос, похожих на линии, проведенные чернилами. Участки геля, содержащие разные белки, вырезают бритвенным лезвием и определяют их радиоактивность, или же весь гель накладывают на рентгеновскую пленку и получают радиоавтограф, точно так же как в опытах с 2-дГ1. В итоге получается то, что представлено на рис. 10.4. *1) Моя самая первая книга, вышедшая много лет назад, была посвящена вопросам биохимии. Пытаясь рассказать, как проводятся биохимические исследования, я рискнул сравнить лабораторию с кухней. Мне казалось, что по-настоящему необычное в нашей работе состоит в том, что мы используем такие мощные аппараты, как центрифуги, способные создавать гравитационное поле порядка полумиллиона g и больше, такие чрезвычайно опасные агенты, как радиоизотопы и высокоактивные токсины, можем измерять неуловимо малые количества вещества в миллиардные доли грамма, тогда как наши общие принципы разделения и манипуляций с материалами прекрасно знакомы любой хозяйке, умеющей приготовить соус или испечь пирог.
Рис. 10.4. Белки синаптических мембран. На рисунке показаны два геля. Пробы синаптических мембранных белков наносили на верхние концы гелей и в течение нескольких часов подвергали электрофорезу. При этой процедуре тысячи различных белков с разной скоростью мигрируют вдоль геля. Гель слева обработан красителем, выявляющим белки. Обратите внимание на множество полос, каждая из которых представляет один или большее число мигрирующих белков. Справа показан гель, в котором методом радиавтографии установлена локализация продуктов фосфорилирования белков левого геля. Из множества белков фосфорилированию подверглись лишь около четырех. Наиболее интенсивно окрашенная полоса в средней части геля - белок В50 с мол. массой около 50 000; это специфический пресинаптический белок, и именно он изменяется в результате обучения.
Мы измеряли фосфорилирование белков в синаптических мембранах из мозга цыплят в разные сроки после обучения и установили, что спустя 30 минут после клевания горькой бусины усиливалось фосфорилирование одного из ключевых пресинаптических белков. Это изменение не было долговременным и через три часа после обучения уже исчезало. Спустя полчаса после обучения возрастала также активность протеинкиназы С в мембранах левого IMHV [110]. Таким образом, при обучении происходило временное изменение фосфорилирования какого-то пресинаптического мембранного белка, регулируемое ферментом протеинкиназой. Но это было всего лишь преходящим сдвигом: если он и необходим для формирования долговременной памяти, его все же нельзя считать ее единственной биохимической основой. Необходимо какое-то более продолжительное событие, способное вызвать длительную перестройку синапсов. Именно для такой перестройки может понадобиться синтез новых белков. Биосинтез белков определяется информацией, заключенной в ДНК, т. е. в генах клеточного ядра. Для образования новых белков необходимо, чтобы активировалась ДНК и нужные гены включились в работу. Поэтому изменение фосфорилирования синаптической мембраны, по-видимому приводящее к поступлению в клетку кальция, должно служить своего рода сигналом для ядерной ДНК. Сейчас мы не знаем всех деталей работы этого механизма, но к концу восьмидесятых годов стало ясно, что поступление такого сигнала в ядро активирует группу «генов раннего действия». Этот феномен впервые наблюдали в быстро делящихся раковых клетках, но вскоре была показана его универсальная природа. «Ранние» гены обеспечивают активацию других («поздних») генов и выработку в клеточном ядре инструкций для последующего синтеза ключевых структурных белков - тех, что в конце концов включаются в состав синаптической мембраны, изменяя ее строение. Структурные белки кодируются поздними генами, тогда как ранние гены ответственны лишь за образование группы промежуточных сигнальных пептидов, получивших такие варварские наименования, как c-fos и c-jun. Эти и другие подобные им пептиды воздействуют на ядерную ДНК, включая в работу надлежащие поздние гены. Этот сложный каскад сигналов схематически представлен на рис. 10.5.
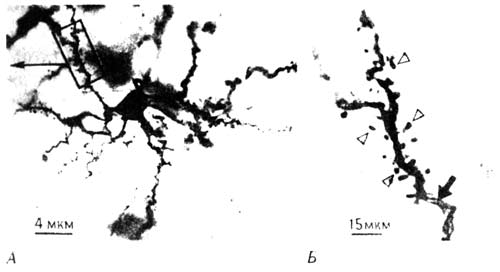
Рис. 10.5. Сигналы между синапсом и ядром. На рисунке изображен синапс на шипике дендрита (разумеется, без соблюдения масштаба), а также тела пресинаптического и постсинаптического нейронов. В процесе формирования памяти нейромедиатор (глутамат, показан черной стрелкой) освобождается из пресинаптического участка и взаимодействует с рецептором на постсинаптической клетке, что приводит к фосфорилированию мембранных белков (черные кружочки) протеинкиназой С (ПК) и поступлению внутрь клетки ионов кальция (Са). Кальций служит сигналом для ядра, где начинается синтез «ранних» (c-fos) и «поздних» генов, которые через РНК кодируют синтез белковых и гликопротеиновых молекул (белые кружочки), а те в свою очередь транспортируются к мембране и включаются в нее, изменяя ее форму и размеры. Параллельно аналогичный процесс запускается под действием ретроградного сигнала (светлая стрелка) в пресинаптической клетке). Наиболее интересны структурные белки, ибо именно они непосредственно изменяют клетку, а ранние гены и механизм их действия относятся уже к молекулярио-биологическому «подсобному хозяйству», которое представляется таинственным не только большинству людей, далеких от биохимии, но и самим биохимикам. Пептиды c-fos и c-jun тоже представляют интерес, но не просто потому, что служат одним из связующих звеньев между ранними процессами в клеточной мембране и синтезом структурных белков, а потому, что становятся активными только в клетках, претерпевающих пластические изменения; их содержание и локализацию внутри клеток можно с высокой точностью определять с помощью той или иной разновидности радиоавтографического метода, описанного выше. Когда в 1989 году мы начали исследовать роль этого механизма в выработке пассивного избегания, в литературе по молекулярной нейробиологии уже высказывалось немало соображений о том, как можно было бы выявить специфическую активацию c-fos и с-jun при образовании следов памяти. Никто, однако, не поставил ключевого решающего эксперимента. Я не молекулярный биолог, и мне никогда не пришло бы в голову осваивать методы, необходимые для оценки активности ранних генов, если бы к нам в лабораторию не приехал вдруг из Москвы молодой специалист в этой области Костя Анохин (внук ученика Павлова, психолога и физиолога Петра Анохина, чью «теорию функциональных систем» я упоминал в главе 9). В распоряжении Кости были специфические «зонды», используемые в таких методах, и он проявлял большую тягу к экспериментальной работе. В течение нескольких недель после его приезда мы показали, что через полчаса после обучения (т. е. примерно в то же время, когда изменялось фосфорилирование мембранных белков) в клетках IMHV резко возрастало образование пептидов c-fos и c-jun. Таким образом, мы обнаружили жизненно важный этап на пути от синапса к ядру [11]. Если не считать этих сложностей, вся остальная биохимическая часть работы сравнительно проста. В одной из моих первых серий экспериментов на модели пассивного избегания (после того как я закончил работу с Мэри и еще не установил, что изменения происходят в IMHV и LPO) я исследовал влияние обучения на общий белковый синтез с использованием метода предшественников, описанного в одной из предыдущих глав. Спустя 30 минут после обучения и на протяжении последующих суток я наблюдал усиление синтеза белков в областях мозга, включавших и IMHV. Этот результат согласовался с известным амнестическим эффектом ингибиторов белкового синтеза. Однако я полагал, что значительная часть этого синтеза могла быть связана с образованием новых синапсов или модификацией старых, поэтому нужно было исследовать не белки вообще, а белки синаптических мембран. Многие из самых важных и характерных белков синаптических мембран относятся к классу гликопротеинов, которые можно описать как молекулы, состоящие из двух частей: длинной цепи аминокислот, погруженной в клеточную мембрану, и еще одной цепочки из молекул сахаров (например, глюкозы, фукозы и галактозы), выступающей из мембран во внеклеточное пространство. Цепочки сахаров «липкие»: когда одна из них находит подходящую цепочку, выступающую над мембраной соседней клетки, они «узнают» друг друга и соединяются. Таким образом, гликопротеины служат узнающими молекулами, и я полагал, что если синапсы — специфические места узнавания и соединения клеток — действительно изменяются при обучении, то гликопротеины должны играть в этом не последнюю роль. Эксперимент, которым я был занят, когда начал писать эту книгу, и о котором рассказал в главе 2, как раз и проводился с использованием фукозы — одного из предшественников гликопротеинов. Еще в 1980 году мы показали, что наряду с включением аминокислот в белки в первые сутки после обучения усиливается и включение фукозы в гликопротеины пре- и постсинаптических мембран. Сложность состояла в том, что гликопротеины чрезвычайно трудно поддаются анализу и, кроме того, в этих мембранах существует множество различных типов гликопротеинов. В последнее десятилетие мы потратили очень много времени на трудоемкие и зачастую весьма неблагодарные попытки идентифицировать эти белковые соединения (мы пытались даже получить специфические антитела, способные их узнавать). Все, что я на данный момент знаю, во всяком случае все, о чем стоит упомянуть, — это то, что в пре- и постсинаптических мембранах имеется целый ряд гликопротеинов разного молекулярного веса, участвующих в формировании у цыплят реакции на бусину [12]. Ход изменений во времени. Если верна гипотеза об участии гликопротеинов в той или иной форме перестройки синапсов, то нельзя ли в самом деле наблюдать эти изменения в нейронах IMHV? Не так уж трудно приготовить препараты мозговой ткани для изучения в обычном микроскопе (максимальное увеличение в несколько тысяч раз) или с помощью электронного микроскопа (увеличение в сотни тысяч раз). Гораздо сложнее перейти от визуальной качественной оценки микроскопического изображения к количественным характеристикам тех или иных компонентов в изучаемом объекте. Если при обучении не образуется чего-то совершенно нового, на препаратах будут скорее всего заметны лишь небольшие изменения в числе, форме или распределении уже существовавших структур, в частности синапсов. При световой микроскопии нельзя увидеть отдельные синапсы, но можно окрасить нейроны и рассмотреть строение их дендритов, чтобы выявить возникшие изменения. Однако если изменения появятся в нервных окончаниях с пресинаптической стороны, то для их количественной оценки понадобятся методы электронной микроскопии, поскольку световой микроскоп не дает достаточного увеличения. Такие количественные морфологические наблюдения, т. е. определение формы, числа и величины клеток в мозгу, даже сегодня, при наличии компьютерных систем и весьма совершенных способов анализа изображений, требуют больших затрат времени и, если наблюдатель недостаточно внимателен, таят в себе опасность неверного истолкования. Какую долю клеток из сотен тысяч, имеющихся в каждом крошечном участке мозга, нужно исследовать, чтобы получить репрезентативную картину? Как можно быть уверенным, что наблюдаемые под микроскопом изменения «действительно» происходят в живом мозгу, а не являются артефактом — искусственно вызванным результатом применения того или иного метода фиксации, приготовления срезов или окрашивания мозговой ткани с целью сделать видимым ее строение? Как можно перенести результаты измерений на двумерных срезах на трехмерную живую ткань? Все эти технические вопросы встали передо мной и моим коллегой Майком Стюартом в начале нашей работы на цыплятах, когда стало ясно, что нам понадобятся измерения такого рода. Майк настолько увлекся этой задачей, что создал действительно первоклассную лабораторию количественной морфологии. Но что именно следовало измерять у цыплят, учитывая множество открывающихся возможностей? В конце XIX века миланский анатом Камилл о Гольджи почти что неожиданно для себя открыл краситель на основе солей серебра, который окрашивал в срезах очень небольшую (по-видимому, случайную) выборку нейронов, настолько четко выделяя отдельные клетки, что видны были и мельчайшие детали клеточного тела, и дендриты, и даже мириады крошечных шипиков, усеивавших поверхность дендритов. Любопытно, что сам Гольджи, получивший Нобелевскую премию (отчасти и за эту работу), не верил в существование в мозгу отдельных нейронов, представляя себе его ткань как непрерывную сеть волокон. Он упорствовал в этом заблуждении вопреки всем данным, которые доставляла его же собственная методика окрашивания. Значение открытия Гольджи было оценено лишь знаменитым нейроанатомом из Мадрида Раман-и-Кахалом, который тоже стал Нобелевским лауреатом (хотя Гольджи отказывался не только принять его доводы, но даже разговаривать с ним). Каждого, кто видит препараты нейронов, окрашенных по Гольджи, восхищают сложность и изящество их ветвления. Даже сейчас, через десятки лет после того, как я впервые увидел такие препараты, они кажутся мне необычайно красивыми, и я погружаюсь в созерцание клеточной чащи, которая выглядит тем более таинственной, что окраска придает препарату какую-то осязаемость, почти трехмерность. Она делает видимыми лишь некоторые из множества нейронов, так что клетки выступают на общем фоне как облетевшие деревья в тумане (рис. 10.6).
Рис. 10.6. Нейроны IMHV. А. Отдельный нейрон, окрашенный по Гольджи. Б. Дендрит при большем увеличении с шипиками на его поверхности. Но одно дело восхищаться красотой таких изображений и совсем другое — давать их структуре количественную оценку. Что нужно измерить, чтобы отличить нейрон, изменившийся после обучения? Поверхность всех дендритов, отходящих от тела клетки, покрыта синапсами, возможно, числом до десятка тысяч, которые принадлежат другим нейронам и обеспечивают связь между клетками. Одни синапсы размещаются прямо на самих дендритах, другие на крошечных шипиках, отходящих от их поверхности (они видны на рис. 10.6). Перестройка синаптических связей между нейронами в соответствии с гипотезой Хебба может быть связана с изменением длины дендритов, характера их ветвления или количества шипиков. Насколько сильно каждый из синапсов будет воздействовать на постсинаптическую клетку, зависит от разных факторов: от близости синапса к телу нейрона, от локализации его на стволе дендрита или многочисленных шипиках и т.д. В синапсе медиатор, выделяемый на пресинаптической стороне, связывается с постсинаптическим рецептором, что приводит к изменению электрических свойств постсинаптической мембраны и возбуждению вокруг нее слабого электрического тока. Действие этого тока на остальную часть дендрита, а потом и на тело клетки в большой степени определяется геометрией участка, окружающего синапс. Расчеты биофизиков показали, что от синапсов, расположенных на шипиках, электрическая реакция распространяется эффективнее, чем от синапсов на самих дендритах, а ток в отдельных шипиках зависит от их формы. Поэтому любое изменение в структуре дендритов или в расположении на них синапсов может изменять нейрофизиологические взаимодействия между пре- и постсинаптическими клетками. Иначе говоря, характер межнейронных связей может изменяться не только при увеличении или уменьшении каждого отдельного синапса (например, синапс может переместиться со ствола дендрита на шипик). Есть веские основания полагать, что форма и характер ветвления дендритов тоже имеют важное значение и могут изменяться под воздействием обучения или других форм приобретения опыта. Приготовление микроскопических препаратов неизбежно связано с фиксацией и окраской ткани, поэтому то, что мы видим, всегда выглядит как очень жесткая структура. Но в живом организме сеть дендритов подвижна, как ветки деревца при легком ветре [13], и нетрудно предвидеть, что их взаимное расположение будет меняться. Однако анализировать эти изменения не так-то просто. Гораздо проще подсчитывать число дендритных шипиков, и именно этим занимался в середине 80-х годов Санджай Пател, один из диссертантов, работавший в лаборатории Майка Стюарта. Он обучал цыплят и спустя сутки приготовлял препараты правого и левого IMHN, окрашенные по методу Гольджи. После этого он отбирал нейроны определенного типа с длинными аксонами, измерял длину каждой ветви дендрита и подсчитывал на ней шипики, а затем вычислял количество последних на один микрометр (одну миллионную долю метра) длины дендрита. К нашей общей радости (и, должен сказать, к моему удивлению), результаты подсчета оказались весьма впечатляющими. Через 24 часа после обучения число шипиков на дендритах в левом IMHV увеличивалось на 60% (но практически не изменялось в правом IMHV). Форма шипиков тоже несколько менялась: создавалось впечатление, что кончик у каждого из них раздувался, словно маленький воздушный шарик. Именно это и должно было происходить, согласно биофизической теории, в случае усиления электрической связи между пре- и постсинаптическими областями системы у цыплят, клевавших горькую бусину. К точно такому же изменению должен был приводить повышенный биосинтез гликопротеинов [14]. Итак, мы получили четкие данные о весьма значительном изменении постсинаптических структур в процессе приобретения опыта. Но в арсенале морфологических методов Майка Стюарта была не только световая, но и электронная микроскопия. При том увеличении электронного микроскопа, которое мы обычно используем, ноготь большого пальца имел бы 250 метров в ширину, а упорядоченная картина, выявляемая при окраске по Гольджи, обращается в хаос, истолковать который может только очень дисциплинированное воображение. Электронная микроскопия не позволяет просто увеличить окрашенное изображение и от начала до конца рассмотреть каждую отдельную клетку и все ее связи; изменения шипиков, видимые в обычный микроскоп, трудно отнести к определенным синапсам, выявляемым с помощью электронной микроскопии. Впрочем, опыт и верный глаз помогают разобраться в хаосе электронно-микроскопической картины и различить отдельные синапсы, клеточные тела, аксоны и дендриты, чтобы измерить их. На рис. 10.7 показана электронная микрофотография синапса из IMHV с обозначениями, которые помогут понять, что на ней видно. Если говорить точно, то синапс — это то место, где пресинаптическое окончание тесно сближено с постсинаптической мембраной. На фото это место имеет вид утолщенной, темной полоски, где мембраны двух клеток практически (хотя и не совсем) соприкасаются. Это утолщение представляет собой тот участок постсинаптической мембраны, где имеются рецепторные молекулы, связывающие нейромедиатор после его высвобождения из мелких пузырьков, плотно упакованных в пресинаптическом окончании. В качестве параметров, заслуживающих измерения, сами собой напрашиваются число таких окончаний в данном объеме ткани, их средняя величина (объем) и длина синаптического утолщения. Запасшись временем и терпением (если вы собираете материал для диссертации или просто горите энтузиазмом), можно даже подсчитать число пузырьков в каждом окончании.
Рис. 10.7. Синапс в IMHV. Отдельный синапс с пузырьками. Звездочкой отмечен синаптический контакт с головкой дендритного шипика. Широкими стрелками показано утолщение постсинаптической мембраны. (Фото любезно предоставил Майк Стюарт.) Майк, работавшие у него выпускники университета и приезжие стажеры определяли все эти параметры в синапсах IMHV и LPO. В начале наших исследований это делали через сутки после обучения цыплят, исходя их того, что для любого структурного изменения нужно время. В последующем Майк убедился, что изменения можно впервые обнаружить уже через час после клевания бусины. Полученные им данные ясны: происходило увеличение числа синапсов в LPO, числа пузырьков в каждом синапсе и даже длины постсинаптического утолщения в левых IMHV и LPO. Все это наряду с изменением числа и величины шипиков на дендритах было именно тем, чего следовало ожидать, если у цыплят, клевавших бусину и запоминавших связь между этим действием и ощущением горького вкуса, перестраивались синапсы в IMHV и LPO. Такая перестройка кодировала (или отображала) эту новую ассоциацию и связанное с ней изменение поведения — «не клевать» вместо «клевать», когда цыплята вторично видели бусину [15]. Резюмируем все сказанное до сих пор. Как видно из рис. 10.3, можно думать, что клевание горькой бусины запускает у цыпленка каскад биохимических процессов в двух, специфических участках мозга. Вначале происходят кратковременные изменения мозгового кровотока и использования энергии; при этом быстро усиливаются взаимодействия между нейромедиатором и его рецепторами, что ведет к изменению свойств синаптических мембран и к повышению эффективности связи между пре- и постсинаптическим нейронами. Эти изменения в свою очередь порождают сигналы для клеточного ядра, в котором сначала активируются несколько «ранних» генов, а потом и гены, необходимые для синтеза новых компонентов синаптических мембран, особенно гликоцротеинов. В последующие часы эти гликопротеины включаются в синаптические мембраны, увеличивая число шипиков на дендритах и размеры зон синаптического контакта в левом IMHV и в левом и правом LPO. Не так уж мало, если учесть, что цыпленок всего лишь однажды клюнул горькую бусину! Третий критерий: необходимость и достаточность Пока все идет хорошо, но самый факт сопутствующих изменений не доказывает, что они необходимы для образования следов памяти. Иными словами, я должен еще проверить ситуацию на соответствие моему третьему, редукционистскому критерию. Пока я этого не сделал, вся сложная последовательность событий, установленная за десять лет работы, может оказаться просто результатом неприятного вкуса во рту цыпленка, не имеющим ничего общего с научением и памятью. Одним из способов такой проверки мог бы служить довольно грубый опыт Мэри Гиббс, которая помещала метилантранилат в клюв цыплятам с закрытыми глазами и не находила после этого никаких изменений в рецепторах для синаптического медиатора. Однако лишение птенцов способности видеть само по себе отнюдь не безразлично для их реакции, поэтому результаты таких опытов не слишком убедительны. В идеале мне были бы нужны две группы успешно обученных цыплят, в одной из которых цыплята в последующем забывали бы усвоенную связь, а в другой помнили ее. Во втором случае у них должны были выявляться все описанные выше процессы на уровне синапсов, а в первом их не было бы. Размышляя над решением этой проблемы, я натолкнулся на статью Ларри Беновица, нейробиолога из Гарвардского университета, опубликованную в начале семидесятых годов. В ней описывалось, как цыплят обучали пассивному избеганию и сразу после этого пропускали через голову слабый электрический разряд, что, по-видимому, заставляло их забыть связь между видом и вкусом бусины: при повторном предъявлении они клевали ее так же энергично, как и в первый раз. Но если ток пропускали не ранее десяти минут после обучения, память о приобретенном опыте сохранялась и цыплята избегали повторно клевать бусину [16]. Это можно бьшо объяснить тем, что ранние этапы образования энграмм связаны с электрической активностью нейронов, а она нарушалась при воздействии тока сразу после обучения; при более позднем пропускании тока эти этапы успевали завершиться и процесс мог беспрепятственно идти дальше.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 97; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.203 (0.03 с.) |