
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции с участием гидроксильной группы.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
1. Диссоциация в водных растворах:
2. Взаимодействие с активными металлами (сходство с простыми спиртами):
3. Взаимодействие со щелочами (отличие от спиртов):
Образующиеся феноляты легко разлагаются при действии кислот. Поэтому при действии Н2СО3 (СО2 + Н2О) и др. кислот феноляты легко разлагаются и обратная реакция не возможна. С6Н5ОNа + СО2 + Н2О ® С6Н5ОН + NаНСО3 4. Взаимодействие с галогеналканами с образованием простых эфиров:
5. Взаимодействие с ангидридами кислот с образованием сложных эфиров:
6. Взаимодействие с солями (хлоридом железа III). Данная реакция является качественной реакцией на фенольный гидроксид Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13: Фенол ® Фиолетовое, Гидрохинон ® Грязно-зеленое, Пирокатехин ® Зеленое, Пирогаллол ® Красное. Резорцин ® Фиолетовое 3С6Н5ОН + FеС13 ® (С6Н5О)3Fе¯ + 3НС1 Фиолетовое окрашивание 7. Р-ция восстановления с цинковой пылью при нагревании: С6Н5ОН + 3Н2 1.1..Р-ции по бензольному кольцу (SЕ ) Как было сказано выше, –ОН группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и пара- положения: 1. Галогенирование фенола:
Происходит обесцвечивание бромной воды и образование белого осадка. Эта реакция используется как качественная реакция на фенол. 2. Нитрование фенола. Под действием 20% раствора азотной кислоты на холожу фенол превращается в смесь орто- и пара- нитрофенол:
2-нитрофенол – 40% 4-нитрофенол – 10% Для получения 2,4,6-тринитрофенола (пикриновой кислоты) фенол предварительно растворяют в концентрированной серной кислоте, а зате6м подвергают нитрованию концентрированной азотной кислотой:
3. Сульфирование фенола:
4. Р-ция конденсации. При взаимодействии с формальдегидом фенол образует полимеры различного строения (линейного, разветвленного, сетчатого) – фенолформальдегидные смолы.
Фрагмент фенолоформальдегидной смолы 5.Р-ция гидрирования (восстановление):
1. Окисление. Фенолы легко окисляются под действием кислорода воздуха:
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.
2. Фенол. Резорцин. Адреналин. Применение в медицине. Трехатомные фенолы.
Фенол и его производные обладают дезинфицирующим свойством.. Карболовая к-та – 3%-ный раствор фенола – для дезинфекции хирургических инструментов. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей. Резорцин – используется при лечении кожных заболеваний в составе примочек или мазей. Гидрохинон – в организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспоста электронов от окисляемого субстрата к кислороду. Пирокатехин применяется для синтеза адреналина – гормона надпочечников. Адреналин является одним из важнейших регуляторов жизнедеятельности организма. Это первый гормон, который удалось получить синтетически. Амины - Это производные аммиака NH3, где один, два или три атома Н замещены на радикал R (алифатический или ароматический). Классификация I. По количеству NH2 групп различают: моноамины, диамины: СН3-СН2-NH2 NH2 – CH2 – CH2 – NH2 Этиламин Этилендиамин II. В зависимости от числа атомов Н, замещенных на R, различают первичные, вторичные и третичные амины. NH2 – аминогруппа, –NH – иминогруппа. СН3-СН2-NH2 – этиамин, первичный амин СН3-СН2-NH - СН3-СН3 – диэтиламин, вторичный амин
III. По характеру углеводородного радикала различают: · алифатические СН3-СН2-NH2 - этиламин · ароматические С6Н5NH2 – аминобензол, анилин
Номенклатура Рациональная – название радикала (R) + «амин»: СН3 – СН2– СН2– NН2 СН3 – NН– СН3 Пропиламин Диметиламин МН рассматривает гр. –NH2 как заместитель в первичных аминах и ее название ставят в приставке перед названием основной цепи (корня):
Изомерия Для первичных аминов – изомерия углерод-углеродной цепи и положения гр. – NH2 (1, 2); для вторичных и третичных аминов – изомерия радикала - метамерия 1) СН3 – СН2– СН2– NН2 Пропиламин Изопропиламин 2) СН3 – СН2– СН2– СН2– NН2 Бутиламин Изобутиламин 3) СН3 – СН2– СН2–NН–СН3 СН3 – СН2–NН – СН2–СН3 Метилпропиламин Диэтиламин Физические свойства Метиламин, диметиламин, триметиламин – газы, хорошо растворимые в воде; средние члены гомологического ряда аминов – жидкости, высшие – твердые вещ-ва. Амины в заметных количествах образуются при гниении органических остатков, содержащих белки. Ряд аминов образуется в организме человека и животных из a-аминокислот под действием ферментов. Такие амины принято называть биогенными аминами, например, кадаверин и путресцин. Строение молекулы амина Связи N – H, C – N полярны, однако полярность NH связи больше, чем CN согласно различной ЭО атомов N, С, Н. Поэтому первичные и вторичные амины, подобно спиртам, склонны к образованию Н-связей.
Нуклеофильный и оснóвный центры В связи с меньшей полярностью связи С – N (0,45 D) по сравнению с полярностью N – Н (1,3 D) для аминов не характерны реакции замещения гр. NН2 – и кислотные свойства. Важнейшее свойство аминов связано с наличием свободной электронной пары у атома N и его способностью присоединять «+» частицы. С этим связано проявление аминами свойств оснований, т.е. присоединять Н+ от воды и кислот, а также вступать в р-ции алкилирования, ацилирования, выполняя при этом роль Nu. Химические свойства I. Оснóвные свойства Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами. Поскольку электроотрицательность атома N меньше электроотрицательности атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС. 1. При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную реакцию: С2Н5 Гидроксидэтиламмония 2. При взаимодействии с кислотами образуются соли: С2Н5 Хлоридэтиламмония Щелочи разлагают соли аминов и выделяют свободные амины: [С2Н5 Особенно сильные оснóвные свойства у четвертичных аммониевых оснований, которые по силе соответствуют щелочам:
Оснóвные свойства ароматических аминов ослаблены за счет р,p-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов. II. Реакции алкилирования и ацилирования В этом случае амины проявляют нуклеофильные свойства за счет электронной пары атома азота. 1. Реакция алкилирования (замещение атомов водорода в гр. NH2 на углеводородный радикал, в результате чего образуется вторичный амин): С2Н5NH2 + СН3CI → С2Н5NH-CH3 + HCI метилэтиламин 2. Реакция ацилирования (замещение атомов водорода в гр. NH2 на ацильный радикал):
Подобным образом алкилируется и ацилируется С6Н5NH2. С6Н5NH2 + СН3CI → С6Н5NH-CH3 + HCI (реакция алкилирования) С6Н5NH2 + СН3 COCI → С2Н5NH-C-CH3 + HCI (реакция ацилирования) ║ О III. Реакция с альдегидом с образованием основания Шиффа: С2Н5 – NH2 + O = IV. Качественные реакции на амины (реакция с HNO2) 1) С2Н5 – NH2 + O = N – OH 2) Желтый Нитрозоамины Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов. 3) R3N: + НNO2 ® [R3NH]+NO2- Соль При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола: [С6Н5 Соль диазония [С6Н5 V. Реакции по радикалу
Сульфаниловая кислота – важный продукт в синтезе лекарственных веществ (сульфаниламидных препаратов) и красителей. Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин: Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты. Диамины. Простейшим диамином является этилендиамин. Он образуется при аммонолизе 1,2-дихлорэтана.
Тетраметилендиамин (путресцин) и пентаметилендиамин (кадаверин), образуются при декарбоксилировании диаминокислот и обусловливают ядовитость гниющих белков. Аминоспирты Это соединения, содержащие в молекуле одновременно гр. –NН2 и –ОН. Первый член гомологического ряда
Коламин входит в состав сложных липидов. Производное коламина – димедрол – обладает противоаллергическим и слабым снотворным действием. Коламин по гр. –NН2 проявляет свойства аминов и спиртов. Р-ции, протекающие по –ОН гр: с Ме, РС15, НС1, R–C1, R–COC1; р-ции окисления и дегидратации. 1. Взаимодействие с активными металлами.
2. Взаимодействие с РCl5 и НСl (реакции SN)
3. Взаимодействие с галогеналканами:
4. Взаимодействие с ангидридами кислот:
1. Взаимодействие с сильными кислотами приводит к образованию устойчивых солей.
2. Взаимодействие с водой.
3. Взаимодействие с ангидридами кислот.
4. В реакции алкилирования коламин образует метилированное производное по типу четвртичного аммониевого основания – холин – триметилоксиэтилгидроксид аммония:
В организме донором метильных групп является аминок-та метионин Холин является составной частью фосфолипидов. Особенно его много в нервных тканях, мозге, печени, мышцах сердца, почках. Сложный эфир холина и уксусной кислоты – ацетилхолин, является посредником при передаче нервного импульса в тканях организма.
Вопросы для самоконтроля: 1. Классификация и номенклатура спиртов 2. Виды изомерии спиртов. 3. На основе электронного строения пропанола-1, охарактеризуйте химические свойства спиртов. 4. Применение спиртов в медицине. 5. Классификация и номенклатура фенолов. Изомерия. 6. Строение фенола, взаимное влияние бензольного кольца и гидроксильной группы. 7. Физические свойства и химические свойства фенола. 8. Фенол. Резорцин. Гидрохинон. Пирокатехин. Применение в медицине. Фенолы как антиоксиданты. 9. Классификация и изомерия аминов. 10. На основе электронного строения этиламина охарактеризуйте химические свойства аминов. 11. Какие из алифатических аминов проявляют более выраженные основные свойства и почему? 12. Строение этилендиамина. 13. Строение коламина. Как влияют функциональные группы в коламине друг на друга. 14. Ацетилхолин – сложный эфир холина и уксусной кислоты, участвует при передаче нервного возбуждения в нервных тканях, т. е. является нейромедиатором. Напишите реакцию его образования. 15. Пикриновая кислота входит в состав взрывчатых веществ. Напишите реакцию её образования. 16. Напишите реакции взаимодействия анилина с Br2, HO-NO2, HO-SO3H
Экспериментальная часть Лабораторная работа
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 569; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.212.153 (0.007 с.) |

 фенолят - ион
фенолят - ион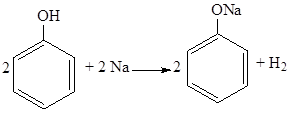

 метилфениловый эфир
метилфениловый эфир фенилацетат
фенилацетат С6Н12 + ZnО
С6Н12 + ZnО 2,4,6-трибромфенол
2,4,6-трибромфенол
 пикриновая кислота
пикриновая кислота



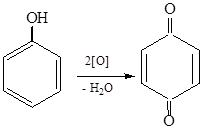 хинон
хинон - триэтиламин, третичный амин
- триэтиламин, третичный амин 2-Аминопропан
2-Аминопропан


 H2 + HOH ® [С2Н5
H2 + HOH ® [С2Н5  H3]OH-
H3]OH-

 – СН3
– СН3  С2Н5 – N =
С2Н5 – N =  С2Н5OH
С2Н5OH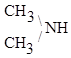 + HONO
+ HONO  -NO¯
-NO¯ N2 + HCl + С6Н5OH
N2 + HCl + С6Н5OH


 2-Аминоэтанол-1, моноэтаноламин, коламин
2-Аминоэтанол-1, моноэтаноламин, коламин


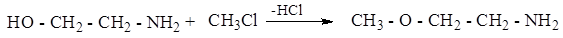
 Реакции по NH2- группе.
Реакции по NH2- группе. гидрохлорид 2- аминоэтанола
гидрохлорид 2- аминоэтанола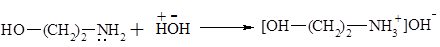



 в организме образуется при ацетилировании холина с помощью ацетилкофермента А.
в организме образуется при ацетилировании холина с помощью ацетилкофермента А.


