
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные законы химии. Закон сохранения массы, энергии, закон сохранения заряда, закон постоянства состава. Законы идеальных газов, закон авогадро. Относительная плотность газа.Стр 1 из 10Следующая ⇒
Эквивалент, фактор эквивалентности, молярная масса эквивалента. Закон эквивалентов и его применение для расчетов. Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности: М Э = М - f Э. Закон эквивалентов – вещества реагируют и образуются согласно их эквивалентам. Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. m1 / Mэ1 = m2 / Mэ2 или V1 / Vmэ1 = V2 / Vmэ2 или m1 / Mэ1 = V2 / Vmэ2 где m 1 и m 2 – массы реагентов и (или) продуктов реакции, г; Mэ1, Mэ2 – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль; V 1, V 2 – объемы реагентов и (или) продуктов реакции, л; Vmэ1, Vmэ2 – молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
Квантово-механическая модель строения атома. Двойственная корпускулярно-волновая природа электрона. Принцип неопределенности Гейзенберга. Волновая функция. Квантовые числа, их физический смысл. Атомные орбитали. Форма электронных облаков для s-, p-, d- и f-состояний. Квантовые числа Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трех квантовых чисел: главного n, орбитального l и магнитного ml. Главное квантовое число n характеризует энергию атомной орбитали. Форма s -орбиталей сферическая, p -орбитали напоминают гантели, d - орбитали четырехлепесткового цветка или удвоенной гантели, f -орбитали имеют более сложную форму.
5. Максимальное число электронов в электронных оболочках и подоболочках. Принцип Паули, правило Хунда. Последовательность энергетических уровней в многоэлектронных атомах. Правила Клечковского.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Количество электронов в каждой оболочке вычисляется по формуле: 2N2 Возможные варианты подуровней оболочек приведены в следующей таблице:
Принцип Паули: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Правило Хунда: В наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален. Первое правило Клечковского: Электрон обладает наинизшей энергией на той электронной подоболочке, где сумма главного и орбитального квантового числа минимальна. второе правило Клечковского: Электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа.
Современная формулировка периодического закона. Структура периодической системы. Периоды, группы, подгруппы. Изменение свойств элементов в периодической системе. Периодический закон и его роль в изучении химии. Изменение кислотно-основных свойств соединений по группам и периодам периодической системы. Современная формулировка периодического закона такова: Периодическая система составлена в виде таблицы, в которой химические элементы расположены в определенном порядке: по мере роста их атомных масс. Все химические элементы в Периодической системе объединены в периоды и группы. Периодическая система включает семь периодов и восемь групп. Первый, второй и третий периоды называют малыми, поскольку они содержат небольшое количество элементов. Все остальные периоды называют большими. В нижней части таблицы Д. И. Менделеева расположены химические элементы, образующие семью лантаноидов и семью актиноидов. Периодическая система элементов содержит десять рядов. Малые периоды (первый, второй и третий) состоят из одного ряда, большие периоды (четвертый, пятый и шестой) содержат по два ряда каждый. В седьмом периоде находится один ряд.
Рассмотрим изменение свойств атомов и их соединений в зависимости от положения в периодической системе химических элементов. Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх. В связи с этим основные свойства оксидов уменьшаются, а кислотные свойства увеличиваются в том же порядке — при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента По периоду слева направо основные свойства гидроксидов ослабевают, по главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают. По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента. По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается. На их основе ученые: а) Систематизировали и обобщили все сведения о химических элементах и образуемых ими веществах; б) Дали обоснование различным видам периодической зависимости, существующим в мире химических элементов, объяснив их на основе строения атомов элементов. в) Предсказали, описали свойства еще не открытых химических элементов и образованных ими веществ, а также указали пути их открытия.
Радиусы атомов (орбитальные и эффективные) и их изменение по периодической системе. Атомные и ионные радиусы, и зависимость от электронного строения и степени окисления. Энергия ионизации атомов и ионов. Сродство к электрону. Электроотрицательность. Орбитальные радиусы (rорб) - это расстояния от ядра до главного максимума функции радиального распределения электронной плотности. Эти величины рассчитаны квантово-механическими методами для всех элементов периодической системы. Эффективные радиусы (rэфф), в отличие от орбитальных, определяют экспериментально из значений межъядерных расстояний в молекулах или в кристаллах. На атомные радиусы элементов оказывают влияние следующие факторы: 1. Эффективный заряд ядра. Увеличение Zэфф при прочих равных условиях усиливает притяжение валентных электронов к ядру и, следовательно, уменьшает радиус. 2. Число энергетических уровней, заполненных электронами. Увеличение числа электронных слоев атома способствует увеличению его радиуса. 3. Электронная конфигурация атома. Проанализируем закономерности изменения атомных радиусов в периодической системе элементов. В периодах число электронных слоев не изменяется, а эффективный заряд ядер растет. Можно ожидать, что в периодах слева направо будет наблюдаться тенденция к уменьшению атомных радиусов.
Несколько сложнее изменение атомных радиусов в больших периодах. Так, в IV периоде атомные радиусы монотонно уменьшаются по рядам s-элементов (К - Са) и d-элементов (Sc - Zn) Для VI периода наблюдается резкое уменьшение радиуса при переходе от элемента IIIB-подгруппы к элементу IVB-подгруппы. Энергия ионизации - это количество энергии, необходимое для отрыва электрона от атома или иона данного элемента. Различают первую, вторую, третью и т.д. энергии ионизации, соответствующие удалению первого, второго, третьего и т.д. электрона атомной частицы. Сродство к электрону (Еэл) - это энергетический эффект присоединения электрона к атомной частице. Электроотрицательность элемента - это характеристика, определяющая способность его атома притягивать к себе электроны, участвующие в образовании химических связей.
9. Ковалентная связь. Метод валентных связей. Механизм образования ковалентной связи (обменный, донорно-акцепторный, дативный). Свойства ковалентной связи: направленность, насыщаемость. Характеристики химической связи: длина, энергия. σ-, и π-связи, их особенности. Ковалентная связь - это связь между атомами, при которой образуются одна или несколько общих электронных пар. Для описания ковалентной связи используют преимущественно два метода, основанных на разных приближениях при решении уравнения Шредингера: метод молекулярных орбиталей и метод валентных связей. Метод валентных связей основывается на положении, что каждая пара атомов в химической частице удерживается вместе при помощи одной или нескольких электронных пар. Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный. При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими. По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов.
Атомы, у которых внешняя электронная оболочка включает d -орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Одно из существенных свойств ковалентной связи - ее насыщаемость. При ограниченном числе внешних электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома (и, следовательно, число химических связей). Именно это число тесно связано с понятием валентности атома в молекуле (валентностью называют общее число ковалентных связей, образуемых атомом). Другое важное свойство ковалентной связи - ее направленность в пространстве. Энергия E 0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи. Межъядерное расстояние между химически связанными атомами называется длиной химической связи. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи. С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи.
10. Гибридизация волновых функций, примеры sp-, sp2-, sp3-, sp3d-, sp3d2 – гибридизаций. Делокализация π-связи. Длина одинарных и кратных связей, их энергия. Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Делокализованная связь - это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов.
Основные положения метода молекулярных орбиталей (МО). МО в двухатомных молекулах, образованных элементами I и II периодов. Связывающие, несвязывающие и разрыхляющие орбитали. Порядок связи в рамках метода МО. основан на следующих правилах. 1) При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные. 2) Число полученных молекулярных орбиталей равно числу исходных атомных. 3) Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей. 4) При перекрывании атомных орбиталей возможно образование и σ-связи (перекрывание по оси химической связи), и π-связи (перекрывание по обе стороны от оси химической связи).
5) Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО. 6)На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов. 7)Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии). 8)Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них. Попробуем убедиться в возможности существования двухатомной молекулы Li2, используя метод МО ЛКАО. Исходный атом лития содержит электроны на двух энергетических уровнях – первом и втором (1 s и 2 s). Перекрывание одинаковых 1 s -орбиталей атомов лития даст две молекулярные орбитали (связывающую и разрыхляющую), которые согласно принципу минимума энергии будут полностью заселены четырьмя электронами. Выигрыш в энергии, получаемый в результате перехода двух электронов на связывающую молекулярную орбиталь, не способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь. Вот почему вклад в образование химической связи между атомами лития вносят лишь электроны внешнего (валентного) электронного слоя. Перекрывание валентных 2 s -орбиталей атомов лития приведет также к образованию одной σ-связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1). Согласно методу МО п орядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленный на два. Индукционное взаимодействие Если рядом с полярная молекула окажется полярная рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости. Энергия притяжения между постоянным и наведенным диполем (энергия Дебая) определяется выражением: E Д = −2 μнав2 γ / r 6,
Агрегатное состояние вещества как проявление взаимодействия между частицами вещества. Твердое, жидкое, газообразное и плазменное состояние вещества. Аморфное и кристаллическое состояние вещества. Металлическое состояние, его особенности. В обычных условиях химические частицы не существуют индивидуально. Они образуют вещества в соответствующем агрегатном состоянии: газовом, жидком или твердом. Переход вещества из одного агрегатного состояния в другое не приводит к изменению его состава, но сопровождается изменением его структуры. Твердые тела характеризуются устойчивостью формы. Составляющие их атомы, ионы и молекулы совершают малые колебания относительно некоторых фиксированных положений. Жидкости характеризуются сильным взаимным притяжением молекул и наличием ближнего порядка в их расположении. Молекулы жидкости совершают частые столкновения с ближайшими соседями и относительно более редкие перемещения, приводящие к смене окружения. Газовое состояние характеризуется слабым взаимодействием составляющих вещество частиц. В результате свободного движения молекул газы заполняют весь предоставляемый им объем. Особое состояние газообразных веществ - плазма. Плазма - частично или полностью ионизированный газ - образуется в результате термической ионизации атомов и молекул при высоких температурах, под действием электромагнитных полей большой напряженности, при облучении газа потоками заряженных частиц высокой энергии. Плазма отличается от нейтрального газа тем, что в ней наблюдается одновременное взаимодействие большого числа частиц. Главный признак аморфного состояния вещества - отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния. Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз. Для металлов характерна металлическая кристаллическая решетка. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью. Металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов. 17. Термодинамические системы: открытые, закрытые, изолированные. Внутренняя энергия и энтальпия, их физический смысл. Стандартное состояние вещества. Стандартная температура. Стандартная энтальпия образования из простых веществ и стандартная энтальпия сгорания. Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела. Изолированные системы не могут обмениваться с окружающей средой ни веществом, ни энергией. Закрытые системы обмениваются с внешним миром только энергией, а открытые – и веществом, и энергией. Следует подчеркнуть, что реальные системы никогда не бывают абсолютно изолированными, они лишь в той или иной степени приближаются к данному понятию, но полностью с ним не совпадают. Закрытые и открытые системы могут существовать реально, причем наиболее распространенными системами в природе являются открытые системы. К их числу относятся все биологические системы: животные и растительные клетки, организмы, человек и т.д. Примером закрытой системы является любой герметический сосуд, в котором протекает та или иная химическая реакция. Физический смысл внутренней энергии заключается в том, что она характеризует общий запас энергии системы. Сюда входят все виды энергии (вращательного и поступательного движения молекул, энергия внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергия вращения электронов в атомах, и т.д.). Но не включает потенциальную энергию Энтальпию часто называют теплосодержанием системы, но это не количество теплоты в теле. Ее изменение, как и изменение внутренней энергии системы, не зависит от пути процесса, так как изменение объема при постоянном давлении определяется только начальным и конечным состоянием системы. Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моль вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях Стандартная энтальпия образования обозначается Δ H f Стандартная энтальпия сгорания — Δ H горо, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Термохимические уравнения. Закон Гесса и следствие из него. Примеры применения закона Гесса для вычисления изменения энтальпии в различных процессах. Экзо- и эндотермические реакции. Термохимия – раздел физической химии, в котором изучаются тепло- вые эффекты химических реакций. Закон Гесса формулируется так: Тепловой эффект химической реакции определяется только природой и состоянием исходных веществ и продуктов и не зависит от промежуточных химических реакций, т.е. от способа перехода от исходного состояния к конечному. Первое следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции. Выделением лишней энергии в виде кинетической энергии молекул, т. е. тепла. Такие реакции называют экзотермическими. Так, экзотермической реакцией является любое горение (сгорание пороха). Эндотермические, они сопровождаются поглощением тепла. Самым наглядным примером эндотермической реакции служит приготовление пищи.
Уравнение Больцмана
где константу k=1,38•10–23 Дж/К мы знаем теперь как постоянную Больцмана, а Ω является числом микросостояний, которые возможны в имеющемся макроскопическом состоянии. Принцип Больцмана связывает микроскопические свойства системы (Ω) с одним из её термодинамических свойств (S). Изменение стандартной молярной энтропии в химической реакции определяется уравнением:
Для химической реакции изменение энтропии аналогично изменению энтальпии
Скорость химически реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость реакции. Закон действия масс. Константа скорости реакции. Зависимость скорости и константы скорости реакции от температуры. Правило Вант-Гоффа, уравнение Аррениуса. Понятие об активированном комплексе. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Средняя скорость реакции равна:
где с2 и с1 - концентрации исходных веществ в моменты времени t2 и t1. Знак минус «-» в этом выражении ставится при нахождении скорости через изменение концентрации реагентов. концентрации продуктов со временем нарастают, и в этом случае используется знак плюс «+». Скорость реакции в данный момент времени или мгновенная (истинная)скорость реакции v равна:
Гомогенные реакций – реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой. Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. Факторы, влияющие на скорость химической реакции: природа реагирующих веществ, концентрация реагентов, температура, наличие катализатора. Еще в XIX веке голландский физико-химик Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
Здесь γ (греческая буква «гамма») - так называемый температурный коэффициент или коэффициент Вант-Гоффа, kt и kt+10 – константы скорости реакции при температурах t и (t + 10) оС. Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Здесь k – константа скорости, e равное приблизительно 2, R – газовая постоянная, T – абсолютная температура в Кельвинах, Ea – энергия активации,А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k. Если левую и правую части уравнения Аррениуса разделить на постоянную А и записать число e его приближенным численным значением, то уравнение примет вид:
Активированный комплекс, группировка атомов в решающий момент элементарного акта химической реакции. Понятием об активированном комплексе широко пользуются в теории скоростей химических реакций. Необратимые и обратимые процессы. Гомогенные и гетерогенные равновесия. Условия химического равновесия. Константа равновесия в гомогенных и гетерогенных системах, ее связь с термодинамическими функциями. Расчет равновесных и исходных концентраций. Химически необратимые реакции при данных условиях идут практически до конца, до полного расхода одного из реагирующих веществ (NH4NO3 → 2H2O + N2O – никакая попытка получить нитрат из Н2О и N2O не приводит к положительному результату). Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых. Примером обратимой реакции служит взаимодействие водорода с иодом:
На основании равенства скоростей прямой и обратной реакций при равновесии можно записать:
Таким образом, видим, что при установившемся равновесии произведение концентраций продуктов реакции, деленное на произведение концентраций исходных веществ, в степенях, равных соответствующим стехиометрическим коэффициентам, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия. При неизменных внешних условиях положение равновесия сохраняется сколь угодно долго. При измении внешних условий положение равновесия может измениться. Изменение температуры, концентрации реагентов (давления для газообразных веществ) приводит к нарушению равенств скоростей прямой и обратной реакций и, соответственно, к нарушению равновесия. Через некоторое время равенство скоростей восстановится. Но равновесные концентрации реагентов в новых условиях будут уже другими. Численное значение константы обычно изменяется с изменением температуры. При постоянной температуре значения Кс не зависят ни от давления, ни от объема, ни от концентраций веществ. Зная численное значение Кс, можно вычислить значения равновесных концентраций или давлений каждого из участников реакции. Имеем Структура системы уравнений термодинамического равновесия (она включает лишь произведение целых степеней концентраций и линейные связи между ними) такова, что ее можно свести к одному алгебраическому уравнению высокой степени. Для того чтобы термодинамическое равновесие в реакционноспособной среде возникало за конечные промежутки времени, необходимы условия, обеспечивающие быстрое протекание как прямых, так и обратных химических реакций. Но так как для протекания некоторых химических реакций требуется большая энергия активации, химический состав смеси газов зачастую отличается от соответствующего химическому равновесию – смесь находится в состоянии условного или замороженного равновесия.
Способы выражения состава растворов. Массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльность, молярная доля. Расчеты, связанные с приготовлением растворов заданной концентрации. (ЕСТЬ ЗАДАЧИ В ПОЛНОЙ ВЕРСИИ, стр 67) Состав раствора может быть выражен безразмерными (доли, отношения) и размерными величинами (молярная концентрация, массовая концентрация, моляльность, титр и т.д.). Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т. е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора. Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора. Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг,т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя. Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в % Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора.
Растворы неэлектролитов. Диаграмма состояния воды. Закон Рауля. Криоскопия, эбуллиоскопия. Понятие об антифризах. Идеальные растворы. Понятие об активности. Неидеальные растворы. Стандартные состояния компонентов растворов. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов. в растворы неэлектролитов (мол. растворах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
Кривая ОС — это кривая равновесия твердое состояние — жидкость, или кривая плавления,— показывает те пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии. Двигаясь по горизонтали влево в области пара (в нижнею части диаграммы), аналогичным образом придем к кривой 0В. Это—кривая равновесия твердое состояние—пар, или кривая сублимации. Ей отвечают те пары значений температуры к давления, при которых в равновесии находятся лед и водяной пар. Все три кривые пересекаются в точке О. Координаты этой точки—это единственная пара значений температуры и давления,. при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки. В 1887 г. французский ученый Ф.М. Рауль открыл закон, согласно которому относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества: (p0 – p)/p0 = χв-ва
(p0 – p)/p0 = nв-ва/(nв-ва + nр-ля) При этом принимаем, что χв-ва + χр-ль = 1 Из закона Рауля следует, что понижение давления пара над раствором не зависит от природы растворенного вещества, а зависит только от количества частиц растворенного вещества. Для практических расчетов чаще применяются криоскопический и эбулиоскопический законы Рауля, которые имеют вид:
где ΔТзам. – понижение температуры замерзания, К – криоскопическая постоянная растворителя, ΔТкип. – повышение температуры кипения, Э – эбулиоскопическая постоянная растворителя, Сm – моляльная концентрация растворенного вещества.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 380; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.202.224 (0.129 с.) |




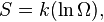

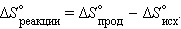
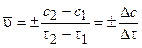
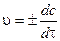


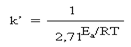


 .
. . Исходя из этого выражения, можно рассчитать х и, значит, равновесные концентрации реагентов.
. Исходя из этого выражения, можно рассчитать х и, значит, равновесные концентрации реагентов.





 Кривая ОА представляет собой график этой зависимости: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом — сосуществуют. Кривая ОА называется кривой равновесия жидкость—пар или кривой кипения.
Кривая ОА представляет собой график этой зависимости: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом — сосуществуют. Кривая ОА называется кривой равновесия жидкость—пар или кривой кипения.


