
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация, номенклатура, изомерия.Стр 1 из 4Следующая ⇒
СПИРТЫ И ФЕНОЛЫ Схема лекции. 1. Одноатомные спирты со связью С(sp3)-ОН 1.1. Классификация, номенклатура, изомерия. 1.2. Способы получения 1.2.1. Из алкенов 1.2.2. Из галогенопроизводных. 1.2.3. Синтез спиртов с использованием реактива Гриньяра. 1.2.4. Восстановление карбонильных соединений. 1.3. Физические свойства 1.4. Химические свойства 1.4.1. Реакции с разрывом связи С-Н 1.4.1.1. Кислотно-основные свойства 1.4.1.2. Этерификация 1.4.1.3. Дегидратация 1.4.1.4. Реакции с галогеналканами. 1.4.2. Реакции с разрывом связи С-О 1.4.2.1.Реакции с галогеноводородами 1.4.2.2. Реакции с галогенидами фосфора и серы 1.4.3 Окисление 1.4.4 Восстановление 2. Многоатомные спирты 2.1. Классификация, номенклатура, изомерия. 2.2. Способы получения. 2.3. Физические и химические свойства 3. Фенолы 3.1. Классификация, номенклатура. 3.2. Физические свойства 3.3. Химические свойства
Определение: Гидроксипроизводные углеводородов, в молекулах которых гидрокси-группа присоединена к насыщенному атому углерода, называются спиртами. По номенклатуре ИЮПАК насыщенные спирты называются алканолами. Количество гидроксильных групп определяет атомность спирта.
ОДНОАТОМНЫЕ СПИРТЫ Классификация, номенклатура, изомерия. По числу гидроксильных групп в молекуле различают одно-, двух- и многоатомные спирты. По числу атомов углерода, с которыми связана гидроксильная группа, спирты классифицируют как первичные, вторичные и третичные. По строению углеводородной цепи различают насыщенные, ненасыщенные и ароматические спирты. Для спиртов действуют тривиальная номенклатура, рациональная и систематическая. Рациональная номенклатура строится от метилового спирта или метанола, который в рациональной номенклатуре называется карбинол. Остальные спирты рассматриваются как производные карбинола, к которому присоединены различные радикалы. В систематической наличие гидроксильной группы обозначается суффиксом «ол». Суффикс ол добавляется к названию углеводорода: метан - метанол; этан – этанол и т.д. В иерархии функциональных групп гидрокси-группа обозначается после галоидов, углеводородных радикалов и кратных связей:
Изомерия спиртов определяется положением гидроксильной группы и начиная с С4 – изомерия углеродного скелета.
Способы получения Из алкенов Гидратацией алкенов, в частности гидратация этилена является промышленным способом получения этилового спирта, а гидратация пропилена является промышленным способом получения изопропилового спирта:
Гидроборирование алкенов. Протекает в соответствии с правилом Марковникова. Только в роли электрофильной частицы выступает боргидрид-ион:
Из галогенопроизводных. Действием водных растворов едкого натра на галогенопроизводные:
Физические свойства Спирты до С10 при нормальных условиях являются жидкостями. Начиная с С11 и выше спирты, при нормальных условиях, являются твердыми веществами. Спирты С1 - С2 смешиваются с водой во всех отношениях и имеют характерный запах. По мере увеличения молекулярной массы растворимость спиртов в воде понижается. Твердые спирты лишены запаха и почти не растворимы в воде. Жидкие спирты являются хорошими растворителями многих органических веществ. Температура кипения спиртов возрастает по мере увеличения молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты изомерного строения. При одинаковом количестве углеродных атомов первичные спирты кипят при более высокой температуре, чем вторичные, а вторичные кипят при более высокой температуре, чем третичные. Температура кипения спиртов значительно выше, чем температура кипения углеводородов и их галогенопроизводных. Это отличие обусловлено способностью спиртов к ассоциации, за счет образования водородных связей между протоном гидроксильной группы одной молекулы спирта и атомом кислорода другой молекулы. Спирты – ассоциированные жидкости.
Химические свойства Химические свойства спиртов обусловлены присутствием гидроксильной группы –ОН. Реакции с участием этой группы протекают либо с разрывом связи С-О, либо с разрывом связи О-Н. Кислотно-основные свойства Спирты являются амфотерными соединениями. Они способны выступать в роли как кислот, так и оснований. Диссоциацией по связи О-Н, спирты проявляют себя как типичные кислоты Бренстеда:
Соответственно спирты способны взаимодействовать со щелочными и щелочноземельными металлами (магний) с замещением атома водорода гидроксильной группы на катион металла. При этом выделяется водород (в момент выделения «in sity» атомарный и поэтому очень активный) и образуется алкоголят:
Алкоголяты легко гидролизуются:
Кислотные свойства спиртов понижаются в ряду метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп, понижающих стабильность аниона. Свойства оснований спирты проявляют по отношению как к кислотам Бренстеда, так и к кислотам Льюиса. Донорным атомом в молекуле спирта является атом кислорода. Кислоты Бренстеда протонируют атом кислорода гидроксильной группы:
Кислоты Льюиса образуют со спиртами донорно-акцепторные комплексы, в которых атом кислорода выступает в роли донора неподеленной электронной пары:
Спирты являются слабыми основаниями. Основные свойства возрастают в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп.
Этерификация Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
Эфиры неорганических кислот получаются при взаимодействии спиртов и хлорангидридов неорганических кислот:
Образование уксусноэтилового эфира:
Дегидратация При действии на спирты водоотнимающих веществ происходит межмолекулярное и внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты: серная, фосфорная, щавелевая, беннзолсульфокислота; оксиды металлов: оксид алюминия, оксид тория. При межмолекулярной дегидратации образуются простые эфиры. Механизм реакции включает две стадии. На первой стадии образуется сложный эфир, который на второй стадии вступает в реакцию нуклеофильного замещения со второй молекулой спирта:
В случае внутримолекулярной дегидратации спиртов, протекающей при более высокой температуре, от сложного эфира минеральнлй кислоты отщепляется кислота с образованием непредельного соединения. В этом случае на второй стадии протекает реакция элиминирования:
При этом водород отщепляется в соответствии с правилом Зайцева, с образованием наиболее алкилированного олефина. Эта закономерность в сочетании с правилом Марковникова дает возможность переходить от одних спиртов к другим. Например, от изобутилового к третичному бутиловому спирту:
1.4.1.4. Реакции с галогеналканами. Спирты являются слабыми нуклеофилами поэтому практически не реагируют с галогеналканами. Исключение составляют аллил и бензилгалогениды и некоторые третичные галогенпроизводные. Реакции протекают по механизму SN1. Алкоксид-анионы являются сильными нуклеофилами и основаниями и способны реагировать с галоидными алкилами по механизму SN2:
Окисление В качестве окислителей спиртов могут быть использованы: хромовый ангидрид, хромовая кислота, перманганат калия, двуокись марганца и т.д. Во всех случаях первичные спирты дают альдегиды, а вторичные – кетоны. Кроме того, при пропускании паров первичного или вторичного спирта над медным катализатором при 3000С протекает реакция дегидрогенизации (дегидрирования) спиртов. Также из первичных спиртов получаются альдегиды, а из вторичных – кетоны:
Третичные спирты окисляются трудно, при этом происходит разрыв углерод-углеродных связей и образуется смесь кислот и кетонов.
1.4.4. Восстановление Спирты устойчивы к действию восстановителей. Они не восстанавливаются водородом над катализаторами. Поэтому спирты используют в качестве растворителей и доноров электронов. Методы восстановления спиртов основаны на превращении спиртов в соединения другого класса, которые уже легко восстанавливаются. Например:
МНОГОАТОМНЫЕ СПИТРЫ Способы получения. Важнейшие способы следующие: 1. Гидролиз дигалогенпроизводных предельных углеводородов или хлоргидринов:
2. Гидратация окисей алкенов:
3. Окисление олефинов по Вагнеру разбавленным раствором перманганата калия или пероксидом водорода. 4. Полиметиленгликоли общей формулы НО-СН2(СН2)хСН2-ОН можно получить каталитическим гидрированием или восстановлением литийалюминийгидридом эфиров дикарбоновых кислот:
5. Глицерин в промышленных масштабах получают из жиров (животных и растительных) гидролизом в присутствии кислоты или щелочи:
6. Синтетический глицерин в промышленных масштабах получают из пропилена, двумя путями:
Первый путь предусматривает присоединений хлорноватистой кислоты к аллиловому спирту. По второму методу аллиловый спирт обрабатывают пероксидом водорода:
7. Глицерин можно получить из ацетилена:
ФЕНОЛЫ Ароматические гидроксисоединения – производные ароматических углеводородов – разделяются на две большие группы: фенолы и ароматические спирты Ароматические гидроксисоединения, в которых гидроксильная группа связана с ароматическим ядром, называются фенолами.
Способы получения 1. Сплавление со щелочами:
этот метод широко применяется в промышленности. Реакцию ведут при 320-3500С. Более вывысокие выхода получаются при применении едкого кали.
2. Гидролиз галогенопроизводных. Например получение фенола из хлорбензола:
Процесс ведут в присутствии солей меди.
3. Разложение гидропероксидов: Самый выгодный способ получения фенола основан на кислотном разложении гидропероксида изопропил бензола (кумола):
4. Окислительное декарбоксилирование карбоновых кислот. Реакцию проводят при 200-3000С в присустывии солей меди (II):
5. Действие на первичные ароматические амины азотистой кислотой и дальнейший гидролиз образовавшейся соли диазония:
6. Гомологи фенола можно получить аналогичными реакциями из сульфо- галогено- или аминопроизводных гомологов бензола. Гомологи также можно получать алкилированием фенола.
Физические свойства Фенолы обычно являются кристаллическими веществами, малорастворимые в воде. Хорошо перегоняются с водяным паром. Обладает характерным запахом. Являются антисептиками. Сильно ядовиты. При попадании на кожу вызывает ожоги.
Химические свойства 1. Кислотные свойства. Фенолы являются кислотами более сильными, чем спирты и вода, но слабее угольной кислоты. Поэтому фенолы легко реагируют с раствором едкого натра с образованием фенолята:
Электронодонорные заместители в пара- орто-положениях понижают кислотные свойства. Электроноакцепторные заместители в пара- и орто-положениях повышают кислотные свойства. Так 2,4,6-тринитрофенол обладает выраженными кислотными свойствами. Поэтому называется пикриновой кислотой. Способен вытеснять угольную кислоту из ее солей, т.е. способен образовывать фенолят в растворе соды. Связь между углеродом бензольного кольца и атомом кислорода гидроксильной группы обладает повышенной прочностью за счет частичной двоесвязанности. Поэтому реакции с разрывом связи С-О для фенола не характерны.
Восстановление К числу реакций, протекающих с разрывом связи С-О, относится восстановление фенола цинковой пылью при перегонке. В ходе реакции гидроксильная группа замещается водородом:
Другим примером разрыва связи С-О является нуклеофильное замещение гидроксильной группы в активированных фенолах. Например, замещение гидроксильной группы в 2,4,6-тринитрофеноле на галоид по механизму «присоединение-отщепление»:
В основном химические свойства фенола формируют реакции, протекающие с разрывом связи С-Н, а также реакции замещения ароматическое кольцо.
О-алкилирование Сам фенол является слабым основанием, поэтому в реакции алкилирования с галоидными алкилами обычно используют фенолят натрия:
О-ацилирование Кислотные свойства фенола играют позитивную роль в реакциях фенола с хлорангидридами и ангидридами карбоновых кислот:
В форме фенолята фенол ацилируется хлорангидридом бензойной кислоты, поскольку у хлорангидрида бензойной кислоты связь хлора и углерода более прочная, чем такая связь в хлорангидридах алифатических кислот:
С хлорангидридами минеральных кислот также образуются эфиры. Причем с пятихлористым фосфором образуются эфиры, хлорированные в ароматическое кольцо.
Реакции замещения
Галогены реагируют с фенолом без катализатора. Фенол взаимодействует с бромом в водном растворе. Причем реакция не останавливается на стадии монобромирования. В начале образуется 2,4,6-трибромфенол, а затем тетрабромпроизводное:
Аналогично под действием концентрированной азотной кислоты в присуствии серной кислоты фенол превращается в тринитрофенол (пикриновую кислоту):
Мононитрофенолы образуются при нитровании фенола разбавленной азотной кислотой в среде уксусной кислоты при комнатной температуре:
Два полученные изомера существенно различаются по своим свойствам. орто -нитрофенол, в отличие от пара-изомера, не растворяется в воде, имеет более низкую температуру кипения и перегоняется с водяным паром. Эти особенные свойства орто- нитрофенола обусловлены наличием внутримолекулярной водородной связи:
Ориентация электрофильного замещения в орто-положение характерно для фенола. Так сульфирование фенола при температуре 15-200С приводит к образованию орто -фенолсульфокислоты, а при температуре 1000С образуется пара -фенолсульфокислота:
Различие условий указывает, что орто -фенолсульфокислота явяляется продуктом кинетически контролируемым, а образование пара -фенолсульфокислоты контролируется термодинамически.
Реакция Реймера-Тимана: При взаимодействии фенола со щелочным раствором хлороформа образуется салициловый альдегид:
Реакция Кольбе-Шмитта При взаимодействии сухого фенолята натрия с углекислым газом образуется салициловая кислота:
Реакция с формальдегидом Фенолы легко конденсируются с формальдегидом (а также уксусным альдегидом, бензальдегидом, фталевым ангидридом, ацетоном) в присутствии кислот или щелочей. Конденсация с формальдегидом проходит по следующему механизму:
Окисление При окислении фенола пероксидом водорода в присутствии железного катализатора образуется пирокатехин:
При действии хромовой кислоты на фенол и гидрохинон образуется п -бензохинон, из пирокатехина получается о -бензохинон:
Восстановление Пр гидрировании водородом в присутствии катализатора фенолы превращаются в спирты, производные циклогексана:
СПИРТЫ И ФЕНОЛЫ Схема лекции. 1. Одноатомные спирты со связью С(sp3)-ОН 1.1. Классификация, номенклатура, изомерия. 1.2. Способы получения 1.2.1. Из алкенов 1.2.2. Из галогенопроизводных. 1.2.3. Синтез спиртов с использованием реактива Гриньяра. 1.2.4. Восстановление карбонильных соединений. 1.3. Физические свойства 1.4. Химические свойства 1.4.1. Реакции с разрывом связи С-Н 1.4.1.1. Кислотно-основные свойства 1.4.1.2. Этерификация 1.4.1.3. Дегидратация 1.4.1.4. Реакции с галогеналканами. 1.4.2. Реакции с разрывом связи С-О 1.4.2.1.Реакции с галогеноводородами 1.4.2.2. Реакции с галогенидами фосфора и серы 1.4.3 Окисление 1.4.4 Восстановление 2. Многоатомные спирты 2.1. Классификация, номенклатура, изомерия. 2.2. Способы получения. 2.3. Физические и химические свойства 3. Фенолы 3.1. Классификация, номенклатура. 3.2. Физические свойства 3.3. Химические свойства
Определение: Гидроксипроизводные углеводородов, в молекулах которых гидрокси-группа присоединена к насыщенному атому углерода, называются спиртами. По номенклатуре ИЮПАК насыщенные спирты называются алканолами. Количество гидроксильных групп определяет атомность спирта.
ОДНОАТОМНЫЕ СПИРТЫ Классификация, номенклатура, изомерия. По числу гидроксильных групп в молекуле различают одно-, двух- и многоатомные спирты. По числу атомов углерода, с которыми связана гидроксильная группа, спирты классифицируют как первичные, вторичные и третичные. По строению углеводородной цепи различают насыщенные, ненасыщенные и ароматические спирты. Для спиртов действуют тривиальная номенклатура, рациональная и систематическая. Рациональная номенклатура строится от метилового спирта или метанола, который в рациональной номенклатуре называется карбинол. Остальные спирты рассматриваются как производные карбинола, к которому присоединены различные радикалы. В систематической наличие гидроксильной группы обозначается суффиксом «ол». Суффикс ол добавляется к названию углеводорода: метан - метанол; этан – этанол и т.д. В иерархии функциональных групп гидрокси-группа обозначается после галоидов, углеводородных радикалов и кратных связей:
Изомерия спиртов определяется положением гидроксильной группы и начиная с С4 – изомерия углеродного скелета.
Способы получения Из алкенов Гидратацией алкенов, в частности гидратация этилена является промышленным способом получения этилового спирта, а гидратация пропилена является промышленным способом получения изопропилового спирта:
Гидроборирование алкенов. Протекает в соответствии с правилом Марковникова. Только в роли электрофильной частицы выступает боргидрид-ион:
Из галогенопроизводных. Действием водных растворов едкого натра на галогенопроизводные:
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 445; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.199.88 (0.124 с.) |

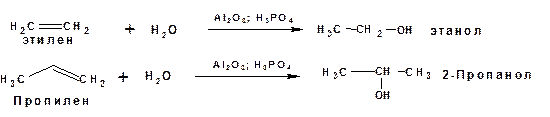




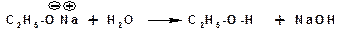
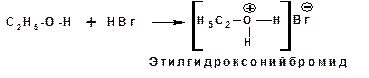




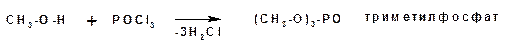










 При щелочном гидролизе получают натриевые соли высших жирных кислот, которые называются мыла. Отсюда этот процесс и вообще гидролиз сложных эфиров при действии щелочей называется омылением.
При щелочном гидролизе получают натриевые соли высших жирных кислот, которые называются мыла. Отсюда этот процесс и вообще гидролиз сложных эфиров при действии щелочей называется омылением.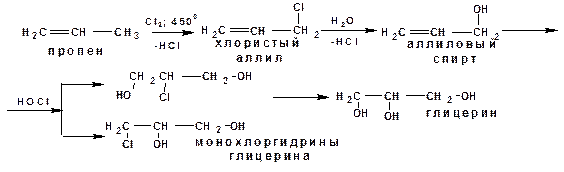


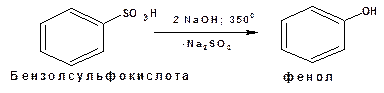
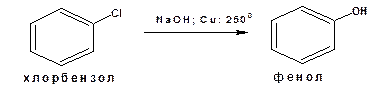









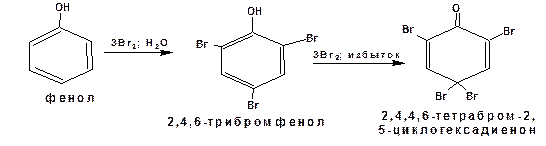
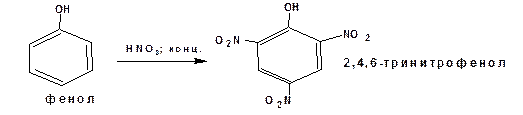

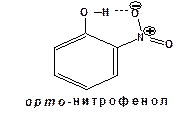



 При низкой температуре образуется полимер линейного строения, замещение только в орто-положение. При высокой температуре образуются продукты пара-замещения что приводит к пространственной сшивке полимера. Таким образом, получают фненолформальдегидные смолы.
При низкой температуре образуется полимер линейного строения, замещение только в орто-положение. При высокой температуре образуются продукты пара-замещения что приводит к пространственной сшивке полимера. Таким образом, получают фненолформальдегидные смолы.





