Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бактериальные газовые фильтры.
Почвенные микробы оказывают положительное влияние на атмоферу, разрушая такие воздушные «загрязнители», как метан, водород, СО, бензол, трихлорэтилен, формальдегид. Почвенные микроорганизмы оказывают большое влияние на глобальное содержание разных газов. Относительно стабильные газы — СО2, NO, N2O и метан. Эти газы называют парниковыми газами, так как они отражают тепловые лучи, не позволяя теплу уходить от поверхности Земли, и вызывают глобальное потепление. Метан может потребляться метанотрофами, обитающими в почве и воде. Критическим фактором, влияющим на потребление метана почвой, является концентрация иона аммония. При увеличении содержания аммония в почве из-за сельскохозяйственной деятельности или вследствие загрязнения потребление метана снижается. Таким образом почвенные и водные метанотрофы могут рассматриваться как своеобразный бактериальный газовый фильтр. Микробный метаболизм может приводить к образованию различных газов. Наиболее значимыми газообразными продуктами, достигающими атмосферы, являются молекулярный кислород, углекислый газ, сероводород, аммиак, метан, оксиды азота и серы. Накопление «отхода» оксигенного фотосинтеза цианобактерий – молекулярного кислорода, привело к кардинальным изменениям физико-химических условий жизни на нашей планете и превратило земную атмосферу из «восстановленной» в «окисленную». Микробная деструкция органического вещества, сульфатное и аэробное дыхания – это постоянные «поставщики» значительных количеств аммиака, сероводорода, углекислого газа и биогаза (метана в смеси с СО2). Однако бόльшая их часть не попадает в атмосферу, поскольку перехватывается группами микроорганизмов бактериального газового фильтра (тионовыми, нитрифицирующими, метанотрофными). Относительно стабильные газы (СО2, NO, N2O и метан) могут накапливаться в атмосфере при нарушении баланса между их эмиссией и потреблением, в основном, за счет антропогенных факторов. Эти газы называют парниковыми газами, так как они отражают тепловые лучи, не позволяя теплу уходить от поверхности земли, и вызывают глобальное потепление. Значительное влияние на содержание разных газов в атмосфере оказывают многие почвенные микроорганизмы, разрушая такие атмосферные «загрязнители» как метан, водород, СО, бензол, трихлорэтилен, формальдегид. Из «экзотических» явлений можно отметить способность Pseudomonas syringae синтезировать белок, который служит ядром формирования льда на поверхности листьев и снега в грозовых тучах. Такой снегоформирующий почвенный микроорганизм может влиять на погоду в глобальном масштабе. Нарушение жизнедеятельности почвенных и водных микроорганизмов вследствие загрязнения или сельскохозяйственных работ может усиливать эмиссию парниковых газов. Так, при увеличении содержания аммония потребление метана метанотрофами, обитающими в почве и воде, снижается. Накопление метана и углекислого газа в атмосфере приводит к «парниковому эффекту».
76. Роль микроорганизмов в самоочищении водотоков и почв.!нужны примеры!
Водные микроорганизмы осуществляют в водоемах замкнутые циклы основных элементов, поскольку в микробных сообществах представлены и первичные продуценты орг. в-ва (фотоавтотрофы, прокариоты-хемоавтотрофы), и консументы (простейшие), и деструкторы (большинство гетеротрофных прокариот и грибов). Водные микроорганизмы присутствуют в планктоне и бентосе, прикрепляясь к плавающим частицам и обитая в донных осадках. Простейшие представлены фораминиферами и радиоляриями. Среди водорослей преобладают диатомеи. Отдельные виды микроскопических грибов из оомицетов и хитридиевых приспособились к жизни в пресноводных и морских водоемах. Некоторые хитридиевые паразитируют на диатомовых водорослях. Другой важной группой нитчатый грибов являются гифомицеты из группы грибов Инголда. Эти грибы способны образовывать под водой четырехлучевые споры. В олиготрофных и бедных органическим веществом водых присутствуют скользящие и простековые микроорганизмы, способные прикрепляться к доступному субстрату, обрастать его, образуя хлопья. В аэробной зоне водоема расположено множество экологических ниш. В поверхностной зоне преобладают микроорганизмы, способные находиться во взвешенном состоянии: клетки, имеющие жгутики, простеки, прикрепленные диски, газовые вакуоли, или организмы малых размеров. Доминирующими формами здесь являются олиготрофы и простекобактерии родов Hyphomicrobium, Planctomyces, Blastobacter, Caulobacter. Спириллы относятся к типично планктонным бактериям. Из способов метаболизма преобладают фототрофия, метилотрофия и нитрификация. Вся толща водной массы в зависимости от градиентов факторов поделена на ряд подзон: подзона фотосинтеза, подзоны продукции биомассы гетеротрофных и хемолитотрофных микроорганизмов, подзона деструкции орг. в-ва, подзона термоклина. В водоемах с повышенной соленостью наблюдается заметная первичная продукция орг. в-ва за счет хемосинтеза. Основная масса орг. в-ва разлагается в аэробной водной толще и не достигает дна. Миксобактерии спосбны лизировать живые клетки цианобактерий и зеленых водорослей. Биополимеры мортмассы микроорганизмы, фитопланктона и высших растений и животных разлагают различные миксобактерии. В поверхностном слое ила обитают прикрепленные или скользящие микроорганизмы. Это микроаэрофильные организмы различных родов, факультативно анаэробные цитофаги и бациллы, нитчатые бактерии, железобактерии, зеленые нитчатые бактерии. Анаэробный распад в приповерхностном слое донных осадков осуществляют клостридии и энтеробактерии. Нижние слои ила составляют сульфатредукторы и метаногены, завершающие анаэробную деструкцию упавших на дно растительных и животных остатков.
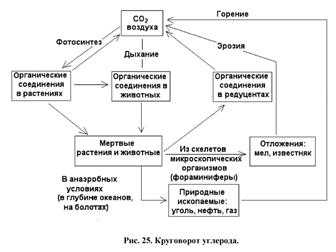
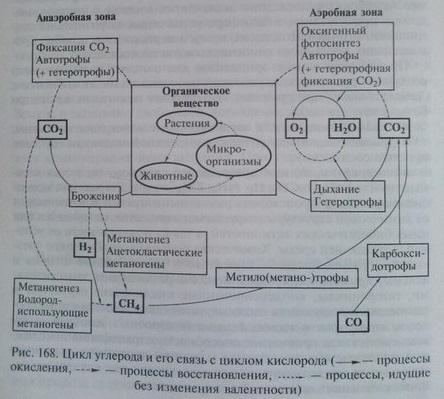
Глобальный цикл углерода. С углеродом тесно связан весь процесс возникновения и развития биосферы, т.к. именно углерод является основой белковой жизни на нашей планете, т.е. углерод является важнейшим химическим компонентом живого вещества. Именно этот химический элемент, благодаря своей способности образовывать прочные связи между своими атомами, является основой всех органических соединений. Основным резервуаром углерода в биосфере, из которого этот элемент заимствуется живыми организмами для синтеза органического вещества, является атмосфера. Углерод содержится в ней, главным образом, в форме диоксида СО2. Небольшая доля атмосферного углерода входит в состав других газов – СО и различных углеводородов, в основном метана СН4. Но они в кислородной атмосфере неустойчивы, и вступают в химические взаимодействия с образованием, в конечном счёте, того же СО2. Из атмосферы углерод усваивается автотрофными организмами-продуцентами (растениями, бактериями, цианобионтами) в процессе фотосинтеза, в результате которого, на основе взаимодействия с водой, формируются органические соединения – углеводы. Далее, в результате процессов метаболизма, с участием веществ, поступающих с водными растворами, в организмах синтезируются и более сложные органические вещества. Они не только используются для формирования растительных тканей, но также служат источником питания для организмов, занимающих очередные звенья трофической пирамиды – консументов. Таким образом, по трофическим цепям, углерод переходит в организмы различных животных. Возвращение углерода в окружающую среду происходит двумя путями. Во-первых – в процессе дыхания. Суть процессов дыхания заключается в использовании организмами окислительных химических реакций, дающих энергию для физиологических процессов. Окисление органических соединений, для которого используется атмосферный или растворённый в воде кислород, имеет результатом разложение сложных органических соединений с образованием СО2 и Н2О. В итоге углерод в составе СО2 возвращается в атмосферу, и одна ветвь круговорота замыкается.
Второй путь возвращения углерода – разложение органического вещества. В условиях биосферы процесс этот в основном протекает в кислородной среде, и конечными продуктами разложения являются те же СО2 и Н2О. Но большая часть углекислого газа при этом не поступает прямо в атмосферу. Углерод, высвобождающийся при разложении органического вещества, в основном остаётся в растворённой форме в почвенных, грунтовых и поверхностных водах. Или в виде растворённого углекислого газа, или же в составе растворённых карбонатных соединений – в форме ионов НСО3- или СО32-. Он может после более или менее продолжительной миграции частично возвращаться в атмосферу, но большая или меньшая его доля всегда осаждается в виде карбонатных солей и связывается в составе литосферы. Часть атмосферного углерода непосредственно поступает из атмосферы в гидросферу, растворяясь в воде. Главным образом, углекислый газ поглощается из атмосферы, растворяясь в водах Мирового Океана. Сюда же поступает и часть углерода, в тех или иных формах растворённого в водах суши. СО2, растворённый в морской воде, используется морскими организмами на создание карбонатного скелета (раковины, коралловые постройки, панцири иглокожих и т.д.). Он входит в состав пластов карбонатных пород биогенного происхождения, и на более или менее продолжительное время «выпадает» из биосферного круговорота. В бескислородных средах разложение органического вещества также идёт с формированием в качестве конечного продукта углекислого газа. Здесь окисление протекает за счёт кислорода, заимствуемого из минеральных веществ бактериями-хемосинтетиками. Но процесс в этих условиях идёт медленнее, и разложение органического вещества обычно является неполным. В результате существенная часть углерода остаётся в составе не до конца разложившегося органического вещества и накапливается в толще земной коры в битуминозных илах, торфяниках, углях. Хранители углерода – это живая биомасса, гумус, известняки и каустобиолиты. Естественными источниками углекислого газа, кроме вулканических эксгаляций, являются процессы разложения органичесекого вещества, дыхание животных и растений, окисление органических веществ в почве и других природных средах. Таким образом, часть углерода всё время выпадает из биологического круговорота, связываясь в литосфере в составе различных горных пород. Почему же тогда не возникает дефицита углерода в атмосфере? Причина в том, что его потеря компенсируется постоянным поступлением СО2 в атмосферу в результате вулканической деятельности. То есть, в атмосферу постоянно поступают глубинные углекислый газ и окись углерода. Это позволяет поддерживать баланс углерода в биосфере нашей планеты.
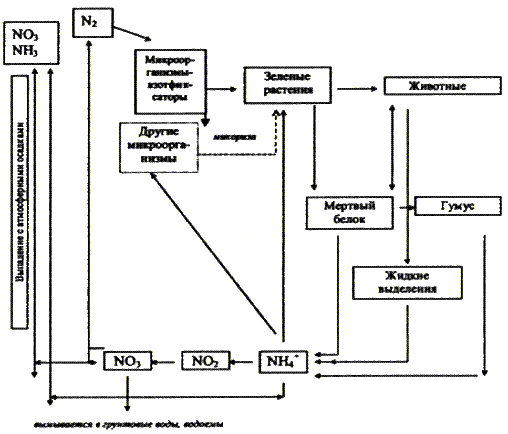
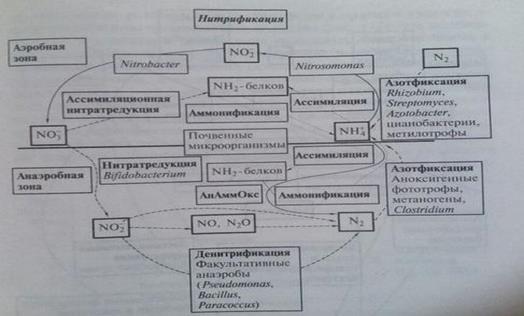
Глобальный цикл азота Азот и его соединения играют в жизни биосферы такую же важную и незаменимую роль, как и углерод. Биофильность азота сравнима с биофильностью углерода. Основным резервуаром азота в биосфере также является воздушная оболочка. Около 80% всех запасов азота сосредоточено в атмосфере планеты, что связано с направлением биогеохимических потоков соединений азота, образующихся при денитрификации. Основной формой, в которой содержится азот в атмосфере, является молекулярная – N2. В качестве несущественной примеси в атмосфере содержатся различные оксидные соединения азота NOx, а также аммиак NH3. Последний в условиях земной атмосферы наиболее неустойчив и легко окисляется. В то же время, величина окислительно-восстановительного потенциала в атмосфере недостаточна и для устойчивого существования оксидных форм азота, потому его свободная молекулярная форма и является основной. В отличие от углерода, атмосферный азот не может напрямую использоваться высшими растениями. Поэтому ключевую роль в биологическом круговороте азота играют организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие способностью путём прямой фиксации непосредственно извлекать азот из атмосферы и, в конечном счёте, связывать его в почве. К ним относятся: некоторые свободноживущие почвенные бактерии; симбионтные клубеньковые бактерии (существующие в симбиозе с бобовыми); цианобионты, которые также бывают симбионтами грибов, мхов, папоротников, а иногда и высших растений. В результате деятельности организмов – фиксаторов азота он связывается в почвах в нитритной форме (соединения на основе NH3). Нитритные соединения азота способны мигрировать в водных растворах. При этом они окисляются и преобразуются в нитратные – соли азотной кислоты HNO3. В этой форме азотные соединения способны эффективно усваиваться высшими растениями и использоваться для синтеза белковых молекул на основе пептидных связей C-N. Далее, по трофическим цепям, азот попадает в организмы животных. В окружающую среду (в водные растворы и в почву) он возвращается в процессах выделительной деятельности животных или разложения органического вещества. Возврат свободного азота в атмосферу, как и его извлечение, осуществляется в результате микробиологических процессов. Это звено круговорота функционирует благодаря деятельности почвенных бактерий-денитрификаторов, вновь переводящих азот в молекулярную форму.
В литосфере, в составе осадочных отложений, связывается весьма небольшая часть азота. Причина этого в том, что минеральные соединения азота, в отличие от карбонатов, очень хорошо растворимы. Выпадение некоторой доли азота из биологического круговорота также компенсируется вулканическими процессами. Благодаря вулканической деятельности в атмосферу поступают различные газообразные соединения азота, который в условиях географической оболочки Земли неизбежно переходит в свободную молекулярную форму. Таким образом, основными специфическими чертами круговорота азота в биосфере можно считать следующие: à преимущественную концентрацию в атмосфере, играющей исключительную роль резервуара, из которой живые организмы черпают запасы необходимого им азота; à ведущую роль в круговороте азота почв и, в особенности, почвенных микроорганизмов, деятельность которых обеспечивает переход азота в биосфере из одних форм в другие
Вследствие чрезвычайно высокой растворимости солей азотной кислоты и солей аммония, азота в почве мало и почти всегда недостаточно для питания растений. Поэтому потребность культурных растений в азотных удобрениях всегда высока. Поэтому ежегодно в почву вносится по разным оценкам от 30 до 35 млн. тонн азота в виде минеральных удобрений. Таким образом, поступление за счет азотных удобрений составляет 30% от общих поступлений азота на сушу и в океан. Это часто приводит к существенному загрязнению окружающей среды и тяжелым заболеваниям человека и животных. Особенно велики потери нитратных форм азота, так как он не сорбируется почвой, легко вымывается природными водами, восстанавливается в газообразные формы и до 20-40% его теряется для питания растений. Существенным нарушением цикла азота является и все возрастающее количество отходов животноводства, промышленных отходов и стоков больших городов, поступление в атмосферу аммония и оксидов азота при сжигании угля, нефти, мазута и т.д. Опасно проникновение оксидов азота в стратосферу (выхлопы сверхзвуковых самолетов, ракет, ядерные взрывы), так как это может быть причиной разрушения озонового слоя. Все это, естественно, сказывается на биогеохимическом цикле азота.
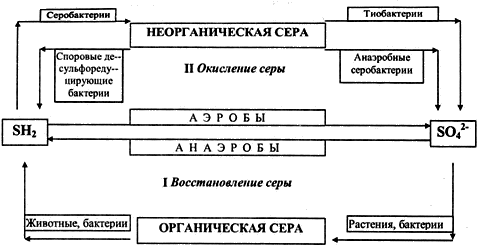
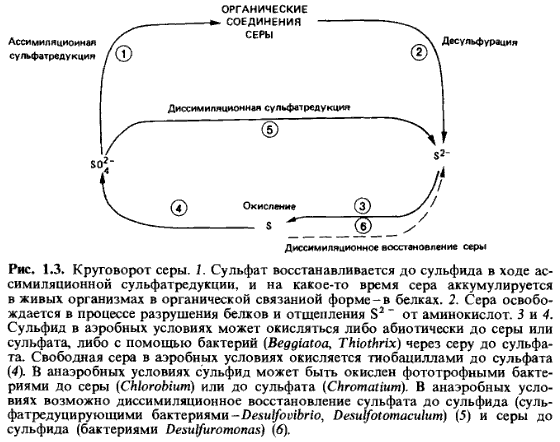
Глобальный цикл серы. Сера является одним из элементов, играющих чрезвычайно важную роль в круговороте веществ биосферы. Она относится к числу химических элементов, наиболее необходимых для живых организмов. В частности, она является компонентом аминокислот. Она предопределяет важные биохимические процессы живой клетки, является незаменимым компонентом питания растений и микрофлоры. Соединения серы участвуют в формировании химического состава почв, в значительных количествах присутствуют в подземных водах, что играет решающую роль в процессах засоления почв. В засоленных почвах содержание серы может достигать значений, измеряемых целыми процентами. Таким образом, основным резервуаром, из которого она черпается живыми организмами, является литосфера. Это обусловлено тем, что устойчивое существование сернистых соединений в условиях современной атмосферы Земли, содержащей свободный кислород и пары Н2О, невозможно. Сероводород (H2S) в кислородной среде окисляется, а кислородные соединения серы, реагируя с Н2О, образуют серную кислоту H2SO4, которая выпадает на поверхность Земли в составе кислотных дождей. Поэтому оксиды серы SOх, хотя и могут усваиваться растениями непосредственно из атмосферы, существенной роли в круговороте серы этот процесс не играет. В составе земной коры соединения серы существуют, в основном, в двух минеральных формах: сульфидной (соли сероводородной кислоты) и сульфатной (соли серной кислоты). Редко встречается самородная сера, которая неустойчива и склонна, в зависимости, от значений окислительно-восстановительного потенциала среды, формировать или кислородные, или водородные соединения. Первичной, глубинной по происхождению, минеральной формой нахождения серы в земной коре, является сульфидная. Сульфидные соединения в условиях биосферы практически нерастворимы, и потому сульфидная сера растениями не усваивается. Но, в то же время, сульфиды в кислородной среде неустойчивы. Поэтому сульфиды на земной поверхности, как правило, окисляются, и в результате этого сера входит в состав сульфатных соединений. Сульфатные соли обладают достаточно хорошей растворимостью, и сера в географической оболочке активно мигрирует в водных растворах в составе сульфат-иона SO42-. Именно в этой, сульфатной форме сера, в составе водных растворов, эффективно усваивается растениями, а далее – животными организмами. Усвоению способствует то, что сульфатные соединения серы способны накапливаться в почвах, участвуя в процессах обменной сорбции и входя при этом в состав почвенного поглощающего комплекса (ППК). Разложение органического вещества в кислородной среде приводит к возвращению серы в почву и природные воды. Сульфатная сера мигрирует в водных растворах, и может снова использоваться растениями. Если же разложение идёт в бескислородной среде, ведущую роль играет деятельность серобактерий, которые восстанавливают SO42- до H2S. Сероводород выделяется в атмосферу, где окисляется и возвращается в другие компоненты биосферы в сульфатной форме. Часть серы в восстановительной обстановке может связываться в сульфидных соединениях, которые, при возобновлении доступа кислорода, снова окисляются и переходят в сульфатную форму. Биогеохимический цикл серы состоит из 4 стадий (рис. 3.5.4): ● усвоение соединений серы живыми организмами (растениями и бактериями) и включение серы в состав белков и аминокислот. ● Превращение органической серы живыми организмами (животными и бактериями) в конечный продукт – сероводород. ● Окисление минеральной серы живыми организмами (серобактериями, тионовыми бактериями) в процессе сульфатредукции. На этой стадии происходит окисление сероводорода, элементарной серы, ее тио- и тетрасоединений. ● Восстановление минеральной серы живыми организмами (бактериями) в процессе десульфофикации до сероводорода. Таким образом, важнейшим звеном всего биогеохимического цикла серы в биосфере является биогенное образование сероводорода.
Изъятие серы из биосферного круговорота происходит в результате накопления сульфатных отложений (в основном гипсовых), слои и линзы которых становятся компонентами литосферы. Компенсируются потери во-первых, в процессах вулканизма (поступление H2S и SOx в атмосферу, а оттуда, с атмосферными осадками – на поверхность Земли). А во-вторых, в результате деятельности термальных вод, с которыми в верхние горизонты земной коры и на дно Мирового океана поступают сульфидные соединения. Таким образом, к характерным особенностям круговорота серы можно отнести второстепенную роль процессов атмосферной миграции, а также многообразие форм нахождения, обусловленное переходом её из сульфидных форм в сульфатные и обратно, в зависимости от изменения окислительно-восстановительных условий. Промышленные процессы выносят в атмосферу большое количество серы. В отдельных случаях значительная концентрация соединений серы в воздухе служит причиной нарушений в окружающей среде, в том числе, кислотных дождей. Присутствие в воздухе двуокиси серы негативно влияет как на высшие растения, так и на лишайники, причем эпифитные лишайники могут служить индикаторами повышенных содержаний серы в воздухе. Лишайники поглощают влагу из атмосферы всем слоевищем, поэтому концентрация серы в них быстро достигает предельно допустимого уровня, что ведет к гибели организмов. Антропогенное поступление серы в биосферу существенно изменяет круговорот этого элемента, а приход серы в биосферу превышает ее расход, в результате чего, должно происходить постепенное ее накопление.
Микробный цикл железа. Железо – широко распространенный на Земле элемент, существующий в земной коре в основном в виде труднорастворимых окисных и сульфидных минералов. Микроорганизмы способны осуществлять в природе замкнутый цикл железа. Они используют соединения железа в энергодающих и конструктивных процессах, а также могут откладывать железо внутри клеток и во внеклеточных структурах. Направление микробной метаболической активности в значительной степени зависит от наличия и концентрации молекулярного кислорода. В присутствии кислорода стабильно только трехвалентное железо, тогда как в анаэробных условиях стабильность двух- и трехвалентного железа одинакова. В водных растворах при рН>6 катионы Fe2+ и Fe3+ неустойчивы и выпадают в виде нерастворимых соединений. Вещества, содержащие в своем составе двухвалентное железо, легко окисляются как микроорганизмами, так и в чисто химических процессах, и образовавшиеся нерастворимые соединения трехвалентного железа либо осаждаются в нижележащие анаэробные слои в водных системах, либо депонируются в аэробной экосистеме почвы. Аэробное окисление двухвалентного железа способны осуществлять морфологически, физиологически и филогенетически разные микроорганизмы. Это, прежде всего, группа железоокислителей-хемолитоавтотрофов (бактерии Leptospirillum ferrooxidans, L. thermoferrooxidans, Acidithiobacillus ferrooxidans, A. thiooxidans, Sulfobacillus acidophilus, S. thermosulfidooxidans и археи рода Ferroplasma), а также факультативные литоавтотрофы – археи родов Sulfolobus, Acidianus, Sulfurococcus и бактерии Acidimicrobium ferrooxidans, Galionella ferruginea, представители рода Thiomonas. Большая группа аэробных гетеротрофных окислителей железа представлена так называемыми хламидобактериями родов Leptothrix и Sphaerotilus, образующими мощные поверхностные структуры, в которых откладываются нерастворимые соединения трехвалентного железа, и видами семейства Hyphomicrobiaceae, имеющими выросты-простеки. Анаэробное окисление двухвалентного железа показано в природе при хемолитотрофии, когда конечным акцептором электронов в ЭТЦ служит, как правило, нитрат. К такому процессу способны неидентифицированные факультативно литоавтотрофные представители классов Beta- и Gammaproteobacteria, а также литоавтотрофный Pseudomonas stutzeri. Из архей анаэробно окислять двухвалентное железа в присутствии нитрата способен Ferroglobus placidus. Использование закисных форм железа в качестве донора электронов для аноксигенного фотосинтеза изучено у ряда представителей пурпурных несерных бактерий родов Rhodobacter, Rhodovulum, Rhodomicrobium. Есть данные об окислении двухвалентного железа в процессе аноксигенного фотосинтезаwtcctктерий родов оавтотрофные представители классов "ми, образующими мощные пове у нитчатых цианобактерий. В анаэробных зонах трехвалентное железо восстанавливается прежде всего в процессе «железного» дыхания, при этом образованные растворимые катионы Fe2+ могут легко диффундировать в вышележащие аэробные системы. Для ряда микроорганизмов, например, для Chloroflexus aurantiacus показано, что окисление железа имеет защитную функцию «борьбы» с активными формами кислорода и не связано с получением энергии.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 656; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.164.241 (0.029 с.) |