Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бактериальная почечная болезнь
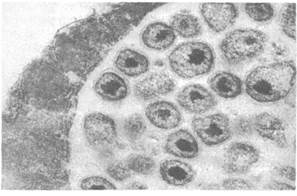
Бактериальная почечная болезнь (БПБ) относится к наиболее серьезным инфекциям и является одной из самых распространенных в мире болезней культивируемых лососевых. Первое сообщение об этой болезни появилось в 1933 г. Типичные поражения наблюдали в селезенке и других внутренних органах атлантического лосося из рек Дия и Спей в Шотландии. Два года спустя сходное заболевание было обнаружено у ручьевой форели в Массачусетском хозяйстве (США). Этиология. Возбудителем БПБ является Renibacterium salmo-ninarum. Она представляет собой грамположительную неспоровую неподвижную палочку, которая медленно растет на обогащенных питательных средах (рис. 28). При температуре 16 °С через 28 дней на плотных средах вырастают мелкие, круглые, выпуклые, матово-белые колонии с ровными краями диаметром около 1 мм. При последующих пересевах такие колонии начинают формироваться в течение недели. Эпизоотология. Бактериальная почечная болезнь отмечается у рыб как в пресной, так и в морской воде. Она установлена у атлантического лосося, американской палии, кумжи, радужной форели, чавычи, кижуча и нерки. Возбудитель БПБ выделен от озерного гольца-кристивомера (Salvelinus namaycush), горбуши, симы и лосося Кларка. На рыбозаводах заболеваемость может составлять 10—25 % независимо от вида и возраста рыбы.
Рис. 28. Renibacterium salmoninarum — возбудитель бактериальной почечной болезни
Возбудитель передается как горизонтально через пищеварительный тракт, так и вертикально, локализуясь на наружной и внутренней сторонах оболочек икринок и внутри икры, где они локализуются в желтке латентно инфицированной самки. Наибольшее число случаев почечной болезни возникает в марте—мае. Вероятно, первичное - инфицирование происходит за несколько месяцев ранее и вспыхивает, когда температура воды поднимается. У форели и лосося увеличение потерь среди молоди наступает с весенним повышением температур. Инкубационный период варьирует в зависимости от температуры воды. При температуре выше 15 "С первые потери начинают появляться через 30—35 дней после заражения. При температуре 11—13 "С инкубационный период удлиняется от 60 до 90 дней. Возбудитель БПБ никогда не инфицирует рыб других видов, кроме лососевых. При этом лососи более чувствительны, чем форель. Болезнь чаще всего проявляется у весенней чавычи, кижуча и нерки с тех пор, как эти виды стали выращивать на рыбозаводах до годовалого возраста. Наиболее восприимчивы к заболеванию ручьевая форель и кумжа, наименее — радужная форель.
Заболевание редко поражает рыбу моложе шестимесячного возраста. Взрослые рыбы—носители возбудителя — являются основным источником инфекции. Скармливание молоди фарша из инфицированных и погибших рыб без термической обработки приводит к ее заражению. В морской воде заболевание обычно сопровождается повышенной смертностью, вероятно, из-за увеличения содержания соли в почках, что создает более благоприятные условия для роста бактерий. В пресной воде БПБ чаще встречается в мягкой, чем в жесткой воде. Основными факторами, имеющими значение для патогенеза заболевания, являются генотип и уровень содержания в крови ионов железа, меди, марганца, цинка, кальция, иода, фтора и витамина А. Особенно важным является содержание иода и фтора. Клинические признаки и патогенез. Течение болезни — хроническая бактериемия. Бактерии, однократно попавшие в рыбу с инфицированной пищей или подхваченные от других инфицированных рыб в хозяйстве или в водоисточнике, начинают медленно размножаться в кровяном русле. Возбудитель инфекции постепенно развивается в почках и других органах, таких как печень, селезенка, сердце. Белый гной и клеточные обломки накапливаются в волдырях и язвах, которые развиваются в этих органах до тех пор, пока поражения становятся легко заметными. Очаги поражения, развивающиеся в заднем отделе почки, обычно легче обнаружить, они могут достигать сантиметра и более в диаметре и проникать в мускулатуру, приводя к образованию пузырей под кожей. Когда заболевание переходит в стадию выраженных клинических признаков, терапевтическая обработка уже малоэффективна. Больные рыбы вялые, с пучеглазием, кровоизлияниями у оснований плавников, вздутиями и подкожными рубцами на боковой поверхности тела. При разрезе вздутий обнаруживают гнойное содержимое. При вскрытии рыб наблюдают водянку, бледный цвет печени, воспаление брюшины, наличие беловатых узелков в почках. Крупные узелки сливаются, при этом почки заметно набухают, особенно в заднем отделе, а иногда почка сморщена или «жгутоподобна». Отмечают также резкое снижение гематокрита и количества белков сыворотки крови. Эти симптомы не всегда развиваются у каждой больной рыбы. Часто единственным признаком заболевания являются серовато-белые узелки в почках.
Диагноз. Для диагностики БПБ предложено несколько методов. Наиболее простой метод включает в себя выявление коротких грамположительных палочек в мазках-отпечатках и гистологических препаратах пораженных органов рыб. В заглазничной ткани бактерии могут быть обнаружены задолго до генерализации инфекции. Недостаток этого метода заключается в том, что при бессимптомном течении инфекции или носительстве бактерии не выявляются, так как в тканях они находятся в незначительном количестве. В препаратах, приготовленных из органов погибающей или мертвой рыбы, обнаруживают огромное количество бактерий, расположенных попарно и соединенных в мелкие V-образные конфигурации. При диагностике бактериальной почечной болезни следует быть особенно внимательным. В мазках из печени, почек и селезенки рыб часто в большом количестве присутствуют окрашенные гранулы меланина, причем таких же размеров, как и возбудители почечной болезни. Разделение их в мазках, окрашенных по Граму, требует определенных навыков. В мазках, окрашенных метиленовым синим, бактерии почечной болезни окрашиваются в голубой цвет, тогда как гранулы меланина остаются темно-коричневыми. В неокрашенных (контрольных) мазках гранулы пигмента имеют тот же темно-коричневый цвет, тогда как бактерии остаются почти невидимыми. Бактериологический метод с последующей идентификацией наиболее достоверен, однако возбудитель очень требователен к условиям культивирования и медленно растет. За рубежом для диагностики БПБ используют быстрые и точные серологические методы: реакцию агглютинации, прямой и Непрямой методы флюоресцирующих антител. Серологические Реакции более чувствительны. Меры борьбы. Международным эпизоотическим бюро заболевание отнесено к группе опасных инфекций. В нашей стране инструктивная документация по организации мер борьбы не разработана. Эффективность предупреждения бактериальной почечной болезни зависит от знания источника и способа инфицирования. Так как не исключена передача возбудителя с икрой, она должна быть получена от здоровых производителей. Запрещают кормление лососей сырым фаршем. Водоисточник и водоснабжающую систему освобождают от сорной рыбы. Перевозка инфицированной или подвергавшейся контакту с инфекцией рыбы или икры из хозяйства в хозяйство запрещена. Проводят индивидуальное тестирование маточного стада, выбраковывая инфицированных производителей. За рубежом из лечебных препаратов зарекомендовали себя сульфамеразин (доза 200 мг/кг массы рыбы, добавляют в корм в течение 10—15 дней) и сульфаметазин — его используют по такой же схеме, причем он может быть более эффективным, чем сульфамеразин. Однако более результативен эритромицин тиоционат (доза 0,1 г/кг массы рыбы, добавляют в корм в течение 21 дня).
МИКОБАКТЕРИОЗ
Микобактериоз — системное инфекционное заболевание многих пресноводных, морских и аквариумных рыб. Раньше большинство микобактериальных инфекций относили к туберкулезу рыб. Впервые микобактериоз у рыб был описан в 1897 г. во Франции. В прудах заболели карпы, контаминированные слюной и выделениями людей, больных туберкулезом. У карпов развивались небольшие серые очаги поражения между брюшной стенкой и гонадами, которые при гистологическом исследовании оказались бугорками, содержащими кислотоустойчивые бактерии, патогенные для лягушек и ящериц, не патогенные для голубей и морских свинок. В 1913 г. спонтанная микобактериальная инфекция была описана у трески. С тех пор микобактериоз неоднократно наблюдался у многих видов морских, анадромных, аквариумных и пресноводных рыб. Этиология. Микобактерии рыб — грамположительные, кислотоустойчивые, неподвижные палочки обычно длиной 1—4 мкм, шириной 0,3—0,7 мкм. От рыб выделено 6 видов: Micobacterium piscium, M. marinum, M. platypoecilus, M. anabanti, M. fortuitum Cruz, M. balnei. Систематика этой группы бактерий постоянно уточняется. В 9-м издании Берджи оставлены М. marinum и М. fortuitum; остальные рассматриваются как синонимы. Эпизоотология. Микобактериоз поражает более 150 видов рыб из 34 семейств. Большинство восприимчивых видов встречается в семействах Cyprinidae, Characinidae, Poccilidae, Cichlidae, Salmonidae. Заболевание широко распространено в декоративном рыбоводстве. Особенно страдают рыбы в крупных морских аквариумах. Естественный путь инфицирования происходит при заглатывании возбудителя с водой, а в случае разведения лососей при кормлении свежем фаршем из контаминированной рыбы. У живородящих рыб возможна передача возбудителя трансовариальным путем. Распространена болезнь повсеместно. Изучение микобактериоза представляет интерес и с эпидемиологической точки зрения, так как доказано, что М. marinum может вызывать инфекцию у теплокровных животных и человека. На коже людей на месте внедрения возбудителя появляются локальные эритемодерматозные папулы. Входными воротами служат различные ссадины, царапины. Спорадические случаи заболевания называют «гранулемой рыбоводных танков», источником которых являются контаминированные аквариумы и рыбы, содержащиеся в них. Особую опасность заболевание представляет для рыбоводов, владельцев декоративных аквариумов и потребителей тропических рыб.
Клиническая картина и патогенез. Симптомы, вызываемые ми-кобактериальной инфекцией, зависят от вида пораженной рыбы. У аквариумных рыб отмечают отказ от корма, истощение, грану-лематозные поражения на голове, поверхности тела и жабрах, по-бледнение окраски, дефекты и потерю чешуи, разрушение плавников, экзофтальмию, деформацию челюстей и позвоночника. Рыба может становиться вялой, забивается в угол аквариума или плавает, двигаясь резкими толчками. У чувствительных анадромных рыб клинические признаки обычно отсутствуют, но у отдельных особей могут быть один или несколько симптомов: задержка роста, более светлое по сравнению с нормальным окрашивание, непроявление вторичных половых признаков. Патологоанатомическая картина у всех пораженных видов рыб Достаточно сходная. Отдельные серо-белые миллиардные (просо-видные) образования — гранулемы могут присутствовать в печени, почках, редко в селезенке, при этом последняя может увеличиться в размерах в 2—3 раза. У инфицированной рыбы кислотоустойчивые бактерии могут быть обнаружены в мазках-отпечатках из жабр, сердца, мышц, пилорических отростков, кожных поражений, глаз, мозга, гонад и мезентериальных узлов. У лососей печеночная ткань может быть почти полностью замещена кислотоустойчивыми бактериями, в результате чего развиваются асцит и Желтуха органов брюшной полости. Наиболее общим проявлением болезни у лососей и аквариумных рыбок является слипание внутренностей. На гистологических срезах пораженная ткань имеет расплавления, сходные с теми, что видны в гранулемах ихтиофонуса. Гистологические исследования узелков показали, что они являются гранулемами с кислотоустойчивыми бактериями, окруженными моноцитами. Наблюдают два типа гранулематозных узелков. Первый — медленно развивающиеся поражения, состоящие из эпителиальных пленок, со стенкой из фибробластов; второй — быстро развивающиеся поражения, содержащие многочисленные гистиоциты, заполненные кислотоустойчивыми бактериями. Диагноз. Его ставят на основании клинических признаков, данных патологоанатомического вскрытия рыб и результатов бактериологического обследования. В мазках из почек, селезенки и других пораженных органов при окраске по Цилю—Нильсену обнаруживают кислотоустойчивые бактерии. Меры борьбы. Они направлены на профилактику микобактери-озов и в основном на предупреждение проникновения заболевания в благополучные хозяйства и аквариальные. На лососевых рыбозаводах соблюдают биотехнику выращивания рыбы. Не допускают кормление ее сырым фаршем из больной или инфицированной микобактериями рыбы. За рубежом в качестве лечебного средства используют канамицин. Препарат задают рыбе с кормом 3—4 раза в день в количестве 10—20 мг/кг массы рыбы в течение 7 дней. Для декоративного рыбоводства наиболее важно поддержание строгой санитарии в неблагополучных аквариумах. Нельзя допускать переуплотненных посадок: на каждую рыбу рекомендуется не менее 5 л воды. Каждая новая рыба должна быть обследована визуально в отношении признаков болезни и подвергнута карантину в течение 2—4 нед, прежде чем будет помещена в общий аквариум с другими рыбами.
СТРЕПТОКОККОЗ
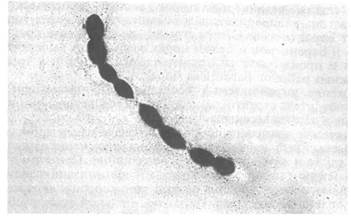
Стрептококкоз — это заболевание пресноводных и морских рыб. Этиология. Возбудителем заболевания является Streptococcus sp., таксономическое положение которого пока точно не определено. В ряде случаев этиологический агент был идентифицирован как S. milleri, S. difficile, S. shioli. Стрептококкоз на Европейском Севере России вызывают специфические штаммы Streptococcus sp., близкие по биохимическим свойствам к S. faecalis и S. faecium, но не идентичные им. Это грамположительные кокки, неподвижные, некислотоустойчивые, диаметром 0,62—0,65 мкм в диаметре (рис. 29), в мазке располагающиеся попарно или в виде коротких цепочек. На пластинчатых средах, содержащих соли желчных кислот, растет в виде небольших беловатых колоний. У возбудителя стрептококкоза установлено наличие как экзо- так и эндотоксинов, под воздействием которых развивается патологический процесс в почечной ткани рыб. Эпизоотология. Стрептококкоз поражает заводскую молодь атлантического лосося и радужную форель в морских и пресноводных хозяйствах. На рыбозаводах смертность сеголетков лососевых рыб от заболевания достигает 30 %. С возрастом она уменьшается до 1 %, но почти всегда наблюдается снижение темпа роста инфицированных рыб. На морских фермах у форели отмечается снижение не менее 20 % товарной массы. Стрептококковая инфекция выявлена также у молоди и производителей атлантического лосося в реках, а также у окуня, гольяна и девятииглой колюшки в озерах Кольского полуострова. Отмечены случаи заболевания трески в прибрежных районах Баренцева моря. Заболевание описано у многих видов рыб в Японии, США, ЮАР, Австралии, Испании. Гибель рыб в естественных популяциях от заболевания наблюдали в устьях рек побережья Флориды в стадах менхедена, лобана, горбыля и морских сомов. У культивируемых рыб, особенно при использовании интенсивной биотехники выращивания, заболевание протекает более тяжело. Вспышки стрептококкоза у желтохвоста связывают с кормлением морской рыбой. При исследовании свежей и мороженой рыбы, которую использовали в качестве корма, стрептококки выделяли от сардины, анчоуса, песчанки и других кормовых рыб. Даже в мороженой рыбе стрептококки оставались жизнеспособными в течение 6 мес. Случаи стрептококкоза зарегистрированы также у аю, лосося-амаго (Oncorhynchus rhodurus), камбалы (Paralichthys olivaceus), тиляпии, радужной форели. В Италии стрептококкоз является серьезной проблемой для форелевых ферм. В Японии эта болезнь регистрируется почти во всех районах страны и наносит значительный ущерб при промышленном выращивании желтохвоста.
Рис. 29. Streptococcus sp, — возбудитель стрептококкоза
В России заболевание наблюдают у молоди атлантического лосося. Болезнь распространена в большинстве морских товарных хозяйств Европейского Севера страны, где выращивают радужную форель. В Баренцевом и Белом морях возбудитель выделяли у по-катника и производителей атлантического лосося и у трески из прибрежных районов Баренцева моря. Заражение выращиваемых лососевых рыб происходит через воду. Возбудитель стрептококкоза выделяется из воды, ила и ракообразных в период весеннего паводка. Клинические признаки и патогенез. В начале заболевания у молоди лососевых рыб наблюдают экзофтальмию, чаще одностороннюю, а также и внутриглазные кровоизлияния. При этом отмечают гиперемию глазного дна, ириса и кератинизацию роговицы. Экзофтальм и последующий разрыв конъюнктивы обусловливаются скоплением экссудата. На заключительной стадии заболевания может происходить выпадение глаз. Заболевание сопровождается анемичностью жабр, гиперемией и гнойными узелками в ротовой полости и на внутренних сторонах жаберных крышек, воспалением ануса. Пораженная рыба пуглива. При вскрытии обнаруживают гиперемию печени и кишечника, бледность сердечной мышцы, светлые предпочки и отек заднего отдела почки, светлую окраску и зернистость селезенки. Селезенка может быть атрофированной или, наоборот, увеличенной. Встречаются рыбы с поражением и гиперемией головного мозга и внутричерепным экссудатом, рыхлостью мозговой ткани. Гистологическими методами установлено расширение кровеносных сосудов, кровоизлияния на поверхности мозга, разрыхление твердой и мягкой мозговой оболочек, некроз клеток внутреннего слоя зрительных долей среднего мозга, воспаление зрительного нерва. При хронической форме заболевания после выпадения глаза рыба может выжить, глазная впадина при этом зарастает пигментированной тканью. Для каждого вида рыб есть свойственные только ему клинические признаки стрептококкоза, но наиболее общими и типичными являются патология глаз, мозга и почечной ткани. Поражения глаз, зрительного нерва, головного мозга свидетельствуют о высокой специфичности возбудителя заболевания, так как такие патологии нетипичны для прочих бактериальных инфекций рыб. Диагноз. Его ставят на основании клинических признаков болезни, патологоанатомических изменений и результатов микробиологического исследования рыбы. Меры борьбы. Они недостаточно разработаны. Соблюдение ве-теринарно-санитарных норм и улучшение культуры рыбоводства сдерживают распространение заболевания. Для лечения стрептококкоза рыб используют эритромицин. В России были начаты работы по созданию вакцины против стрептоккокоза. Профилактически в корм добавляют культуру ацидофильной палочки (0,1 — 1,0 % суточного рациона корма в течение Юдней).
ЭПИТЕЛИОЦИСТОЗ (МУКОФИЛЕЗ)
Эпителиоцистоз — довольно редкое заболевание карпа, а также других более чем 25 видов пресноводных и морских рыб, широко распространенное в мире, ранее известное как мукофилез. Этиология. В 1981 г. венгерские ученые на основании электронно-микроскопических исследований жабр карпа, пораженных му-кофилюсом, установили, что этот организм представляет собой одну увеличенную клетку хозяина, внутри которой находится огромное число мельчайших включений прокариотной природы, близких по строению к риккетсиям или хламидиям. Сходный возбудитель, обнаруженный в 1969 г. в США у лепоми-са (Lepomis macrochirus), поражал только эпителиальные клетки жабр, которые приобретали вид мелких цист, в связи с чем заболевание получило название эпителиоцистиса. По аналогии болезнь карпа стали называть не мукофилезом, а эпителиоцистисом (epitheliocystis). Проведенные в России в середине 90-х годов исследования на карпе подтвердили результаты исследований венгерских ученых. Дальнейшие исследования показали, что данное заболевание широко распространено среди различных видов рыб, как пресноводных, так и морских. Согласно последним данным американских ученых, проводивших комплексные ультраструктурные, биохимические и иммунологические исследования возбудителя эпителиоцистиса белого осетра, он ближе к хламидиям, чем к риккетсиям. Ультраструктурные исследования возбудителей из разных рыб-хозяев показали, что они имеют определенные различия. Это позволяет предположительно рассматривать их как отдельные виды или формы. Немногочисленные попытки экспериментального заражения рыб пока не увенчались успехом. Эпизоотология. Интересно, что массовое поражение рыб отмечается только при искусственном культивировании и не встречается в естественных условиях. Вспышки эпителиоцистиса сопровождаются либо высокой смертностью рыб, либо заболевание становится хроническим с незначительным отходом. Заболевание карпа эпителиоцистисом отмечено в хозяйствах Венгрии, Израиля и Испании, Причем в отдельных случаях наблюдалась гибель молоди. Вспышки заболевания у карпа в прудовых хозяйствах Украины были зарегистрированы в конце 70-х годов XX в. Молодь карпа поражается уже На 14—15-й день после выклева. С ростом рыб интенсивность инвазии возрастает, достигая максимума к середине лета при температуре 24—26 "С. При этом возможна гибель сильно зараженных рыб. Отход обычно наблюдается в течение 7—Ю дней. С понижением температуры происходит постепенное освобождение рыбы от возбудителя. Возможно повторное заражение годовиков весной следующего года, но уже с низкой степенью поражения рыб. В середине 90-х годов в России заболевание отмечали в ряде прудовых и тепловодных хозяйств. Повышенные плотности посадки рыб способствуют заражению, размножению и накоплению возбудителя, что приводит к гибели сильно зараженных особей.
Рис. 30. Возбудитель эпителиоцистоза
Клинические признаки. В пораженных жабрах карпа при микроскопии отмечают наличие мелких и белых округлых цист. На гистологических срезах в зависимости от степени развития и зрелости микроорганизмов эпителиальные клетки жабр имеют различные величину и характер окрашивания. Пораженные клетки увеличиваются в размерах до 50 мкм и приобретают мелкозернистую структуру. При электронной микроскопии в них видно скопление огромного числа включений размером около 2—5 мкм, у которых отсутствует настоящее ядро и есть многослойная, сложно устроенная монолитная оболочка (рис. 30). Очевидно, что на этой стадии возбудитель при разрушении клетки попадает в воду и заражает других рыб. Жизненный цикл этого патогенного микроорганизма еще не изучен, в первую очередь неясны пути его проникновения в организм хозяина и время, которое проходит от начала заражения до завершения развития. Меры борьбы. Они не разработаны. При вспышке заболевания положительные результаты дает улучшение условий содержания рыб, включая увеличение проточности и внесение извести по воде в прудах из расчета 100—200 кг/га.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ 1. Назвать основные бактериальные болезни карпа. 2. Перечислить основные заболевания, вызываемые энтеробактериями. 3. Какие болезни рыб вызывают миксобактерии? 4. При каких бактериальных заболеваниях на рыбоводные хозяйства накладывают карантин? 5. Назвать основные методы борьбы с бактериальными инфекциями. Глава 7. МИКОЗЫ Возбудителями микозных болезней являются микроскопические грибы, относящиеся к нескольким классам. В настоящее время существует несколько точек зрения на систематическую градацию грибов. Мы придерживаемся системы, изложенной в «Курсе низших растений», под ред. М. В. Горленко (1981). У гидробион-тов в основном паразитируют пресноводные и галофильные, условно-патогенные виды, выделяющиеся из воды и других субстратов. Клетки грибов представляют собой тонкие длинные ветвящиеся нити, называемые гифами, длина которых достигает 100 мкм и более, а ширина — от 0,5 до 40 мкм. Гифы большинства грибов, паразитирующих у рыб, не разделены внутренними перегородками. Они имеют оболочку, ядро и цитоплазму, содержащую вакуоли и различные включения. Переплетаясь, они образуют мицелий — вегетативное тело гриба. Размножение грибов происходит половым и бесполым путем. Как известно, большинство грибов являются сапрофитами, т. е. существуют за счет разлагающихся органических веществ. Однако некоторые группы грибов могут временно или постоянно существовать как паразиты, в том числе и как паразиты рыб. Среди микозных болезней имеются отдельные, вызывающие значительную смертность рыб, инкубируемой икры и других гидробионтов (раков, крабов и др.). Микозные болезни у гидробионтов встречаются достаточно часто как в аквакультуре, так и в естественных водоемах. Они изучены недостаточно. Для многих возбудителей неизвестны их систематическое положение, жизненный цикл, свободно живущие стадии, не разработаны эффективные лечебные средства.
БРАНХИОМИКОЗ
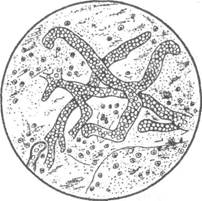
Бранхиомикоз — опасное инфекционное (микозное) заболевание рыб разных видов и возрастов, возникающее в прудовых, садковых рыбоводных хозяйствах и естественных водоемах, особенно в озерах. Оно может вызывать массовую гибель рыбы. Этиология. Возбудителем бранхиомикоза являются два вида грибов рода Branchiomyces — В. sanguinis и В. demigrans (рис. 31). Они различаются между собой морфологическими признаками и особенностями развития. В. sanguinis локализуется в крупных кровеносных сосудах. Ширина гиф, толщина их стенок и диаметр спор соответственно равны 9—15; 0,2; 5—9 мкм. В. demigrans способен развиваться как в кровеносных сосудах жабр, так и вне их. Ширина гиф, толщина их стенок и диаметр спор равны соответственно 13—14; 0,5— 07; 12—17 мкм. Эпизоотология. Бранхиомикозом поражается около 30 видов рыб. Особенно опасен он для карповых: карпа, сазана, серебряного карася и других рыб, для которых возбудителем является В. sanguinis. B. demigrans паразитирует у линя, щуки и других видов рыб. Вспышки заболевания отмечены у сиговых и форели при их выращивании в прудах и садках. В озерах неоднократно отмечалась гибель уклеи и угря от бранхиомикоза. Наиболее восприимчивы рыбы двух- и трехлетнего возраста. Эпизоотии наблюдаются в жаркое время года — в июле и августе при температуре воды— выше 20 °С. вспышки болезни Branchiomyces sanguinis отмечаются в водоемах с высоким уровнем эвтрофикации, перманганатная окисляемость в которых более 20 мг 02/л, концентрация аммиака более 10 мкг/л. При этом рН воды и содержание кислорода в ней могут оставаться оптимальными. Заболевание протекает в острой и хронической формах. При острой форме отмечается массовая гибель рыб (от 30 до 60 %) на 3—5-й день после появления первых признаков. Хроническая форма длится от 2 до 8 нед и заканчивается гибелью более слабых рыб (до 10 %) от асфиксии. Источником заражения являются больные и переболевшие бранхиомикозом рыбы, трупы рыб, погибших от бранхиомикоза, а также вода, поступающая из неблагополучных водоемов. Факторами, способствующими возникновению заболевания, являются сильное загрязнение водоемов органическими веществами, отсутствие проточности, зарастание водной растительностью, иловые отложения, кормление рыбы недоброкачественным кормом. Наиболее часто бранхиомикоз возникает в карпово-утиных хозяйствах или прудах многоцелевого назначения. При разложении органических веществ, особенно животного происхождения, создается благоприятная питательная среда для роста, развития и размножения возбудителя. Клинические признаки и патогенез. Первые симптомы болезни отмечаются за 2—3 дня до гибели рыб. Рыбы перестают брать корм, собираются стаями у поверхности воды, подплывают к берегам, слабо реагируют или не реагируют на внешние раздражители. В начале заболевания на жаберных лепестках наблюдаются темно-красные полоски, которые образуются в результате закупорки кровеносных сосудов гифами гриба, т. е. формируются тромбы. В дальнейшем около тромба появляются анемичные участки грязно-серого цвета. Позже на жаберных лепестках наблюдается чередование полос бледно-розового, темно-коричневого и темно-серого цвета. Такая «мраморная» окраска очень характерна для острой формы бранхиомикоза (см. цв. вкл. табл. X). На следующей стадии заболевания отмечается некроз отдельных участков жаберных лепестков с дальнейшим их выпадением. Регенерация жаберных лепестков при неблагоприятном течении заболевания происходит медленно (несколько месяцев), при благоприятном — в течение 3 нед. При вскрытии пораженных рыб видимых изменений во внутренних органах не отмечается, иногда наблюдается отек почек и селезенки. В крови больных бранхиомикозом рыб в начале заболевания происходит резкое увеличение числа лейкоцитов за счет моноцитов и лимфоцитов. У рыб с ярко выраженной клиникой отмечается цитолиз как лейкоцитов, так и эритроцитов, который приводит к формированию нормохромной анемии, анизоцитоза, нейропе-нии и моноцитоза.
Рис. 31. Возбудитель бранхиомикоза
Диагноз. Его ставят на основании эпизоотологических данных, клинического осмотра рыбы и микроскопического исследования патологического материала жабр для обнаружения гиф и хорошо различимых спорангионосцев гриба. В сомнительных случаях для подтверждения диагноза проводят гистологический анализ жабр больных рыб. При постановке диагноза на бранхиомикоз необходимо исключить заболевание рыб мукофилозом, сангвиниколе-зом, дактилогирозом и бранхионекрозом, так как клиническая картина при этих заболеваниях сходна с бранхиомикозом. Меры борьбы. Борьба с бранхиомикозом осуществляется в основном путем профилактики. Пруды, в которых наблюдается болезнь, с осени необходимо осушать, а дно вспахивать для ускорения процессов минерализации. Лучший результат дает летование с осуществлением комплекса мелиоративных мероприятий. В жаркое время нужно обеспечить максимум проточности. Необходимо контролировать окисляемость и при ее резком повышении приостанавливать кормление рыб и внесение удобрений. В карпо-утиных хозяйствах для уток отводится специальный пруд. Места притока свежей воды должны быть защищены от птиц. В фермерских хозяйствах и прудах многоцелевого назначения не допускается выгул более 100 уток или гусей на 1 га водной площади. На водоем (пруд), где отмечалась вспышка бранхиомикоза, накладывают карантин. В зависимости от системы водоснабжения и расположения прудов карантинированию подвергаются отдельные неблагополучные пруды, система прудов или полностью рыбоводное хозяйство. По возможности обеспечивают проточность воды в прудах и ее аэрацию. На период вспышки прекращают кормление рыбы. По воде вносят негашеную известь (150—200 кг/га) или гипохлорит кальция (7,5—15,0 кг/га). В местах максимального скопления рыбы проводят обработку по воде хлорной известью (30 кг/га). При отсутствии извести можно применять медный купорос при концентрации его 0,3—0,4 г/м3. В дальнейшем внесение негашеной извести повторяют через каждые 10 дней до снижения температуры воды до 15 0С. В конце сезона рыбу из карантинного водоема реализуют через торговую сеть. Весь рыболовный инвентарь, орудия лова и спецодежду после каждого использования на неблагополучном водоеме подвергают обязательной санитарной обработке и дезинфекции. Ложе неблагополучных прудов осенью подвергают тщательной обработке хлорной известью (30—50 кг/га) или негашеной известью (2500 кг/га), а откосы дамб, донные водоспуски, рыбо-уловители обрабатывают 10%-ной взвесью хлорной или негашеной извести.
САПРОЛЕГНИОЗ
Сапролегниоз — микозное заболевание рыбы и икры, широко распространенное как в аквакультуре, так и в естественных водоемах. Этиология. Сапролегниоз вызывается грибами из класса ооми-цеты, порядка сапролегниевых (Saprolegniales) и относящимися к нескольким родам: АсЫуа, Aphonomyces, Dictyuchus, Leptolegnia, Saprolegnia и др. Наиболее распространенными и патогенными являются следующие виды: Ach. flagellata, Aph. laevis, D. mono-sporus, S. ferax, S. mixa, S. parasitica, Achlia flagellata, способные переходить от сапрофии к некрофии (рис. 32). Плесневые грибы представляют собой разветвленные гифы, лишенные перегородок. Гифы могут быть как тонкими, слабо ветвящимися, шириной не более 20 мкм, так и более широкими, ветвящимися. Гифы состоят из оболочки и цитоплазмы, содержащей многочисленные ядра. Для сапролегниевых грибов характерны бесполый и половой способы размножения. Органы бесполого размножения (зооспорангии) расположены на концах гиф. Они наполнены многочисленными зооспорами, которые имеют по 2 жгутика для передвижения в воде. Созревшие зооспоры выходят в воду, прорастают и дают начало новым гифам. При половом способе размножения на коротких отростках гиф образуются мужские (антеридии) и женские (оогонии) половые органы. В оогониях развиваются яйцеклетки. Антеридии разрастаются, приближаются к оогониям и через особые поры, имеющиеся в их оболочке, выпускают внутрь оогония отросток, через который в яйцеклетку перетекает ядро антеридия. В результате слияния мужских и женских ядер образуется зигота, которая покрывается оболочкой и превращается в ооспору. После некоторого периода покоя находящаяся в воде ооспора прорастает и образует новую гифу. Строение оогониев и антеридиев является важным систематическим признаком. Оптимальные температуры для роста и размножения плесневых грибов 12-20 0С. Эпизоотология. Сапролегниоз распространен повсеместно, так как возбудители заболевания, являясь сапрофитными организмами, постоянно присутствуют в воде и грунтах.
Рис. 32. Наиболее распространенные грибы класса Oomycetes: I—образование зооспор у грибов: A — Achlya; Б — Saprolegnia; В — Dictyuchus; Г — Leptolegnia; Д — Aphonomyces; Ј— Pythium; //—превращения зооспор; а —первичная зооспора; б — инцистирование первичной зооспоры; в — вторичная зооспора; г — инцис-тирование вторичной зооспоры; д— прорастание зооспоры; III—оогонии грибов: 1 — Achlya; 2—Saprolegnia; 3—Dictyuchus; 4 — Leptolegnia; 5—Aphonomyces; 6—Pythium
Заболевание может развиваться в любое время года, однако каждый вид гриба обладает определенными требованиями к условиям среды, в частности, имеет свой температурный оптимум. Установлено, что максимум развития для S. mixa и S. ferax приходится на весну и осень, S. monica — на зиму, A. flagellatta — на лето, S. parasitica встречается круглогодично. Заболевание описано для всех искусственно воспроизводимых видов рыб, а также для икры во время ее инкубации. Оно также встречается у рыб и на икре в естественных водоемах. Сапролегни-ей обычно поражаются травмированные участки тела рыбы, а также во время инкубации неоплодотворенная, мертвая или травмированная икра. Заболевание у рыб может протекать длительно, особенно при Низкой температуре, вызывая повышенную гибель. Сапролегниоз часто сопутствует и осложняет ряд инфекций или инвазий, вызывая ассоциативный комплекс болезней. Факторами, способствующими развитию болезни на рыбе, являются травмы, стресс, низкая температура воды (ниже 1 °С), высокий рН (более 8,3), наличие в воде рыбоводных сооружений большого количества органических веществ. Интенсивность развития грибов на икре зависит от процента травмированной и неоплодотворенной, т. е. мертвой, икры. Как правило, такая икра получена от слабых производителей или при ее получении и оплодотворении были допущены нарушения в технологии. Клинические признаки и патогенез. Сапролегниоз проявляется в виде ватообразного разрастания гриба на различных участках поверхности тела, плавниках, жабрах, реже на внутренних органах (рис. 33). Цвет мицелия белый, но может варьировать от желтоватого до коричневого в зависимости от цвета взвешенных в воде частиц, которые осаждаются на нем.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.8 (0.07 с.) |