
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осадок растворяется, если произведение концентраций ионов, образующих малорастворимый электролит, меньше величины его произведения растворимости ⇐ ПредыдущаяСтр 3 из 3
Пример 2. Вычислите растворимость цианида серебра в воде при T= 298 K, если произведение растворимости AgCN Решение: В насыщенном растворе цианида серебра устанавливается равновесие:
Концентрации ионов
Растворимость соли определяется концентрацией ее ионов:
Основные типы реакций обмена, протекающих необратимо: 1. Реакции, протекающие с образованием осадка:
Или в ионно-молекулярной форме
Реакция протекает в прямом направлении самопроизвольно, что подтверждает понижение стандартной энергии Гиббса:
2. Реакции, протекающие с образованием летучих веществ, переходящих в газовую фазу: а) или Равновесие реакции смещено вправо, т. к. продукт реакции HСl удаляется из реагирующей смеси. б) образование слабого электролита, сразу распадающегося на малодиссоциирующие и (или) малорастворимые вещества:
ионно-молекулярное уравнение реакции:
3. Реакции, протекающие с образованием слабых электролитов:
б) реакции нейтрализации, в результате которых образуется слабый электролит – вода:
4. Реакции, протекающие с образованием комплексных ионов:
Гидролиз солей. Константа и степень гидролиза Гидролиз – реакция обменного взаимодействия химического соединения с водой, в результате которого, как правило, изменяется рН раствора Гидролизу подвергаются как неорганические вещества (соли и солеобразные соединения), так и органические соединения (углеводы, белки, жиры и пр.). Соли, образованные катионом сильного основания и анионом сильной кислоты, не подвергаются гидролизу, так как концентрации ионов не изменяются Водные растворы таких солей имеют нейтральную реакцию среды (pH≈7) Это нитраты, сульфаты, хлориды, бромиды, иодиды щелочных и щелочноземельных металлов.
Различают три типа гидролиза солей. 1. Гидролизу по катиону подвергаются соли, образованные слабыми основаниями и сильными кислотами, например, нитрат аммония Нитрат аммония в растворе, как сильный электролит, полностью диссоциирует на ионы:
молекулярное уравнение: полное ионно-молекулярное уравнение:
сокращенное ионно-молекулярное уравнение:
Константа равновесия:
[H2O] = const
Константа гидролиза:
в общем виде:
где Гидролиз
1 -я ступень диссоциации:
2 -я ступень диссоциации:
1 -я ступень гидролиза:
2 -я ступень гидролиза:
|
|||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 315; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.184.214 (0.008 с.) |




 и
и  одинаковы и равны:
одинаковы и равны:










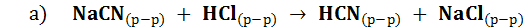





 ;
; 
 , сульфат меди
, сульфат меди  , хлорид алюминия
, хлорид алюминия  и др.
и др.


 (pH
(pH  7)
7)



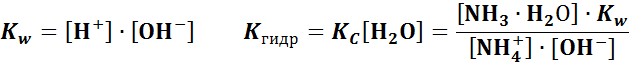




 – константа диссоциации слабого основания (b – base, англ. – основание)
– константа диссоциации слабого основания (b – base, англ. – основание) протекает ступенчато через стадию образования осно̍вной соли
протекает ступенчато через стадию образования осно̍вной соли  :
: ,
,


 D
D  ,
,
 ,
,



