Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ЭТЦ – электронтранспортная цепь.Стр 1 из 16Следующая ⇒
ПРАКТИКУМ ПО ФИЗИОЛОГИИ РАСТЕНИЙ Часть II Учебно-методическое пособие
Минск 2010 УДК 581.1 ББК М
Печатается по решению редакционно-издательского совета БГПУ, Рекомендовано секцией естественных и сельскохозяйственных наук БГПУ (протокол № от)
Рецензенты: Кафедра физиологии и биохимии растений БГУ; Кандидат биологических наук, заведующая сектором биохимии ГНУ «ЦБС НАН Беларуси» Е.В. Спиридович
Мазец Ж.Э. М Физиология растений: практикум. В 2 ч. Ч.2/Ж.Э. Мазец, С.В. Судейная, Е.Р. Грицкевич. – Минск: БГПУ, 2010.– с. ISBN
Пособие содержит лабораторные работы по темам «Дыхание растений», «Рост и развитие растений», «Физиологические основы устойчивости растений к неблагоприятным условиям среды», «Вторичный метаболизм растений», а также «Глоссарий» физиологических терминов. Адресуется студентам педагогических вузов, обучающихся по биологических специальностям. Может быть использовано для контроля знаний по теоретическому и лабораторному курсу «Физиология растений».
СОДЕРЖАНИЕ СПИСОК СОКРАЩЕНИЙ 4 ПРЕДИСЛОВИЕ Тема 5. ДЫХАНИЕ РАСТЕНИЙ 5 Работа 1. Определение дыхательного коэффициента 9 Работа 2. Органические вещества растений и их превращения. 12 Работа 3. Обнаружение активности каталазы в растительном материале. 13 Работа 4. Обнаружение активности пероксидазы 15 Работа 5. Определение активности полифенолоксидазы в растительных тканях (по А.Н. Бояркину) 16 Работа 6. Обнаружение активной амилазы в растительном материале 19 Работа 7. Влияние температуры на активность амилазы 21 Работа 8. Влияние рН среды на активность амилазы 22 Вопросы и задачи по теме 24 Тема 6. РОСТ И РАЗВИТИЕ РАСТЕНИЙ 26 Работа 1. Влияние различных фитогормонов на рост семядолей 28 Работа 2. Влияние фитогормов на содержание хлорофилла в семядолях 30 Работа 3. Периодичность роста древесных растений. 31 Вопросы и задачи по теме 33 Тема 7. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ УСТОЙЧИВОСТИ РАСТЕНИЙ К НЕБЛАГОПРИЯТНЫМ УСЛОВИЯМ СРЕДЫ 36 Работа 1. Определение жаростойкости растений (по Ф.Ф.Мацкову) 37 Работа 2. Влияние сахарозы на морозоустойчивость растительных клеток 38 Работа 3. Определение засухоустойчивости растений проращиванием семян на растворах сахарозы 40
Работа 4. Определение солеустойчивости злаков по всхожести их семян. 41 Работа 5. Влияние засоления на степень деструкции хлорофилл а. 42 Вопросы и задачи по теме 44 Тема 8. ВТОРИЧНЫЙ МЕТАБОЛИЗМ РАСТЕНИЙ 47 Работа 1. Определение содержания суммарной фракции флавоноидов 47 Литература 50 ПРИЛОЖЕНИЕ 1 52 ПРИЛОЖЕНИЕ 2 67
АБК – абсцизовая кислота; БАП – бензоаминопурин; ДК – дыхательный коэффициент; ИУК – индолилуксусная кислота; НАД – никотинамидадениндинуклеотид; НАДФ – никотинамидадениндинуклеотид фосфат; ПФО – полифенолоксидаза; ФАД – флавинадениндинуклеотид; ФМН – флавинмононуклеотид; ЭТЦ – электронтранспортная цепь. ПРЕДИСЛОВИЕ
В данной части практикума представлены лабораторные работы по физиологии растений для студентов педагогических университетов по специальностям 1-02 04 01 Биология с дополнительными специальностями и 1-02 04 05-01 География. Биология. Эта часть практикума является логическим продолжением лабораторного курса “Физиология растений”, представленного в первой части. Пособие включает лабораторные работы по темам: “Дыхание растений”, “Рост и развитие растений”, “Физиологические основы устойчивости растений к неблагоприятным условиям среды», «Вторичный метаболизм растений». В соответствии с новой рабочей типовой программой курса и расширившимися техническими возможностями кафедры в данный практикум включены новые работы, а также модифицированы некоторые из ранее используемых. Кроме того, в качестве приложений включены обширный глоссарий по всему курсу и раздел, касающийся статистической обработки результатов экспериментов. Приведенные лабораторные работы сгруппированы по разделам курса, в конце каждого раздела имеется перечень задач и вопросов для закрепления теоретического курса и результатов экспериментов. Лабораторные работы рассчитаны на 2 – 4 часа. Однако приводятся и более объемные работы, предусматривающие предварительную подготовку экспериментального материала. Расширенный перечень работ дает возможность выбора в соответствии с имеющимися научно-методическим обеспечением.
Порядок выполнения и оформления результатов лабораторных работ приводится в первой части практикума. После изучения основных разделов курса проводятся контрольные по терминам и семинары. Авторы выражают искреннюю благодарность рецензентам: сотрудникам кафедры физиологии и биохимии растений Белорусского государственного университета, а такжезаведующей сектором прикладной биохимии ГНУ «ЦБС НАН Беларуси» Е.В. Спиридович.
Тема 5. ДЫХАНИЕ РАСТЕНИЙ Жизнедеятельность растительных организмов связана с вовлечением кислорода в метаболический и энергетический обмен клеток. Центральное место среди процессов, связанных с поглощением кислорода, занимает дыхание. Дыхание — аэробное окисление органических субстратов до диоксида углерода и воды. Субстратами окисления в клетке являются в основном углеводы, однако ими могут быть также липиды, белки и другие органические соединения. Общее уравнение дыхания при использовании в качестве субстрата глюкозы:
Биологическое окисление глюкозы в процессе дыхания включает ряд стадий: анаэробные (гликолиз) и аэробные реакции – цикл Кребса и электрон-транспортную цепь (ЭТЦ) дыхания. Существуют и другие пути окисления субстратов в растении, например окислительный пентозофосфатный цикл, а также альтернативный путь дыхания. Окисление субстратов в процессе дыхания происходит с участием окислительных ферментов. Первый этап окисления осуществляется дегидрогеназами — ферментами, отнимающими от субстрата водород, терминальный этап — оксидазами, передающими восстановительный эквивалент на кислород. Кроме того, в дыхании участвуют ферменты — промежуточные переносчики электронов в ЭТЦ митохондрий. Дыхание занимает центральное место в энергетике растительной клетки. В ходе дыхания происходит высвобождение энергии органических субстратов и использование ее для процессов жизнедеятельности растений. Большая часть энергии в ходе дыхания запасается в виде макроэргических связей АТФ. Однако она может быть использована организмом на стадии образования электрохимического градиента протонов (∆μН+), а также в виде тепла (термогенез). Количество энергии, используемое в каждой из этих форм, определяется внешними условиями и внутренними потребностями организма. Не менее важна метаболическая роль дыхания. В ходе окисления органических субстратов происходит перестройка углеродных скелетов органических веществ и образование важных промежуточных продуктов, которые используются для синтеза специфических белков, липидов, ароматических веществ и др. Через реакции дыхания в растении осуществляется связь различных процессов обмена веществ. Восстановленные в ходе дыхания коферменты — НАДФ • Н и НАД • Н — используются в реакциях биохимического синтеза, восстановления нитратов до аммиака, восстановительного амминирования кетокислот и других восстановительных процессах. Большую метаболическую и физиологическую нагрузку несут окислительные реакции, связанные с так называемыми альтернативными путями окисления органических субстратов. Участвующие в этих процессах терминальные оксидазы (например, полифенолоксидаза, аскорбатоксидаза, пероксидаза), а также оксигеназы (например, липоксигеназа) контролируют реакции синтеза и распада ароматических веществ, фенолов, регуляторов роста и развития растений и др. В растениях происходит смена терминальных окислительных систем в зависимости от этапа онтогенеза, внешних условий (температуры, концентрации кислорода), поражения патогенами.
Несмотря на то, что общее уравнение дыхания обратно уравнению фотосинтеза, по физиологическому значению эти два процесса близки: дыхание, как и фотосинтез, снабжает клетки энергией и важными метаболитами. Дыхание наряду с фотосинтезом оказывает непосредственное влияние на продуктивность растений. Однако в отличие от фотосинтеза, где процесс в целом направлен против термодинамического градиента за счет поглощенной энергии света, дыхание включает реакции, идущие по термодинамическому градиенту с высвобождением энергии. Конечной формой запасания энергии при фотосинтезе являются достаточно стабильные органические соединения (углеводы, белки, липиды); физиологический смысл дыхания состоит в преобразовании энергии этих соединений в более доступную для растения лабильную форму — макроэргические связи АТФ. Набор промежуточных метаболитов, синтезируемых в процессе дыхания, значительно шире, чем набор метаболитов фотосинтеза. Общая интенсивность дыхательного процесса у растений может быть охарактеризована по скорости поглощения кислорода и выделения углекислого газа, интенсивности расходования органических веществ. Важными физиологическими показателями дыхательного метаболизма являются также величина дыхательного коэффициента, соотношение гликолитического и пентозофосфатного путей распада сахаров, активность окислительно-восстановительных ферментов. Об энергетической эффективности дыхания можно судить по интенсивности окислительного фосфорилирования в митохондриях. Дыхание как физиологическая функция, включает:
1. Газообмен– совокупность процессов, обеспечивающих поступление 02 в организм, использование его в окислительно-восстановительных процессах и удаление продуктов окисления (через устьица, клеточные стенки, покровные ткани). 2. Темновое дыхание – совокупность окислительно-восстановительных процессов разного типа и назначения, в ходе которых сложные органические вещества распадаются на более простые, а высвобождаемая энергия в сопряженныхреакциях аккумулируется в лабильных фосфатных связях (АТФ) и используется во всех энергетических процессах клетки и растительного организма в целом. Различают следующие виды клеточного дыхания:
а) сопряженное с запасанием энергиив форме АТФ и НАДН; б) свободное окисление – перенос электронов, присоединение 3. Фотодыхание (выделение С02 на свету в процессах, связанных с фотосинтезом). Главными функциями дыхания являются: а) мобилизация энергетических ресурсов дыхательного субстрата путем трансформации энергии стабильных соединений в активную б) мобилизация пластических резервов дыхательного субстрата, путем образования многочисленных промежуточных соединений; в) терморегуляционная (теплопродукция) - рассеяние энергии г) защитная - расщепление (детоксикация) вредных веществ.
Компонентамидыхания в обеспечении энергетической и пластической функций являются: 1) дыхание роста (Др) - затраты на процессы роста и развитие 2) дыхание поддержания (ДП): а) ресинтез веществ, претерпевающих обновление в процессе б) поддержание в клетке необходимой концентрации ионов Н+(рН) и др.; г) поддержание уровня метаболитов; д) поддержание функционально-активного состояния структур. Перечисленные показатели могут быть использованы для характеристики физиологических свойств и состояний растений. Краткие сведения
Дыхательным коэффициентом (ДК) называется отношение выделенного при дыхании количества углекислого газа к количеству поглощенного кислорода: V СО2 ДК = __________ VО2 Величина ДК в значительной мере зависит от природы окисляемого субстрата, а именно от степени его окисленности. При окислении углеводов она равна единице, что очевидно из уравнения 6СО2 С6Н12О6 + 6О2 ® 6СО2 + 6Н2О, т. е. ДК = _________ = 1 (ДК = 6СО2/6О2). 6О2 Если же вещества окислены меньше углеводов (жиры, жирные кислоты, некоторые белки и аминокислоты), ДК будет меньше единицы. Перечисленные соединения, более восстановленные, эффективнее углеводов и органических кислот в энергетическом отношении. С17Н35СООН + 26О2 = 18 СО2+ 18 Н2О (ДК = 18 СО2/26О2). Если дыхательным материалом служат вещества более окисленные, чем углеводы, например органические кислоты, то кислорода поглотится меньше, чем выделится углекислого газа, и ДК будет больше единицы. 2С2Н2О4 + О2 = 4СО2 + 2 Н2О (ДК = 4СО2/О2). Величина ДК зависит также от количества кислорода, поступающего к тканям, от состояния организма и фазы его онтогенеза. Величина ДК зависит от вида растения и характера запасных веществ (табл. 1)
Таблица 1. – Примерные величины дыхательного коэффициента семян различных растений
Рис. 1. Прибор для определения дыхательного коэффициента
Если на трубке нет делений, то к ней с помощью двух резиновых колечек прикрепляют полоску миллиметровой бумаги (см. рисунок 1). Прибор должен находиться в стабильных температурных условиях.
Ход работы Наполнить пробирку на 2/3 проросшими семенами, плотно закрыть пробкой с измерительной трубкой и поместить в условия с постоянной температурой. Через 10 мин, когда температура в пробирке стабилизируется, в горизонтальную трубку пипеткой с оттянутым носиком ввести каплю воды на расстоянии 1–1,5 см от края трубки. Изменение положения капли зависит от изменения объема газа в пробирке, т.е. от соотношения выделенного СО2 и поглощенного О2. Если их количества равны, капля останется на месте, значит, ДК=1. Если СО2 больше, чем О2, капля будет двигаться вправо, к концу трубки, т.е. ДК > 1. Если же СО2 меньше О2, капля будет двигаться в сторону пробирки ___ ДК < 1. Как только капля начнет двигаться, отметить начальное положение мениска и засечь время. Каждые 3 мин отмечать положение мениска и рассчитать среднюю скорость движения капли. Если она смещается к концу трубки, то скорость ее движения А соответствует разнице объема выделенного СО2 и поглощенного О2
Если капля движется в сторону пробирки, то скорость соответствует разнице:
Определив А, открывают пробирку, проветривают ее, удаляют каплю воды из трубки (выдувают с одного конца и впитывают фильтровальной бумагой с другого). После этого полоску фильтровальной бумаги сворачивают в кольцо, равное диаметру пробирки и, держа его пинцетом, смачивают в концентрированном растворе щелочи. Затем вкладывают кольцо в верхнюю часть пробирки так, чтобы оно не касалось семян и пробки. Далее в горизонтальное колено трубки снова вводят каплю воды и определяют среднюю скорость ее движения. Теперь образованный при дыхании семян СО2 поглощается щелочью и средняя скорость движения капли В будет:
Преобразуя оба уравнения, находим, что Отсюда соотношение объемов выделенного СО2 и поглощенного О2, выраженное через значение скоростей движения капли, т.е. ДК, равно:
Результаты определения следует записать по форме табл. 1. Таблица 2
На основании величины ДК сделать вывод о природе запасных веществ в исследуемых семенах. Задача. Определить ДК у семян одного из видов: 1) злаков (ячмень, пшеница, рожь); 2) бобовых (бобы, фасоль, горох, люпин); 3) масличных растений (лен, подсолнечник, конопля, горчица); 4) у семян гречихи; 5) у семян кабачков; Общие результаты записать по образцу табл. 3 Таблица 3
Сделать вывод о зависимости ДК от вида дыхательного субстрата исследуемых семян.
Краткие сведения При прорастании семян сложные запасные вещества (белки, жиры, углеводы) под действием соответствующих ферментов превращаются в более простые. Последние легче вовлекаются в различные химические процессы и используются на дыхание, рост и развитие проростка. Так как метаболическая взаимосвязь белков, жиров и углеводов осуществляется через цикл Кребса или глиоксилатный, то при прорастании семян можно обнаружить, что одни вещества превращаются в другие, например жиры, белки ___ в углеводы, полисахара ___ в моносахара и т.д. Чтобы установить, каким превращениям подвергаются запасные вещества при прорастании семян, необходимо определить их химический состав до и после прорастания. Проращивание семян следует проводить в темноте для исключения образования новых органических веществ.
Ход работы
Равное по сухой массе количество непроросших (сухих) и проросших семян различного состава (крахмалистые, белковые, маслянистые) растереть в фарфоровой ступке, насыпать в сухие пробирки (на 1,5 см), залить 10 мл теплой воды и нагревать на кипящей водяной бане в течение 10 мин. При этом происходит экстракция редуцирующих сахаров. По истечении указанного времени профильтровать через увлажненный складчатый фильтр в чистые пробирки так, чтобы количество фильтрата во всех было одинаковым. Добавить к фильтрату равное количество реактива Фелинга и нагреть на кипящей водяной бане (5 мин). По количеству образовавшейся закиси меди дать оценку содержания в материале редуцирующих сахаров в баллах. К оставшемуся на фильтре материалу (мезга) добавить 5-6 капель йода и оценить содержание крахмала или продуктов его расщепления в баллах. Параллельно провести аналогичные операции с проросшими в течение 3-5 суток семенами тех же растений, взятыми в равном количестве по сухой массе. Оценку содержания липидов в проросших и непроросших семенах исследуемых растений можно проводить несколькими способами. Первый способ основан на окрашивании капель жира краской судан III. Для этого необходимо сделать срезы непроросших и проросших семян маслянистых растений, поместить на предметные стекла в капли раствора краски судан III, закрыв покровными стеклами. Через 5 минут промыть срезы водой, рассмотреть в микроскоп и дать оценку содержания жира – по количеству и размеру капель, окрашенных в красный или оранжевый цвет. Можно использовать и более простой способ оценки содержания липидов. Сухие и проросшие семена поместить на куски фильтровальной бумаги, раздавить их пестиками, подсушить бумагу и рассмотреть на свет масляные пятна. Общие результаты записать по форме табл.1
Таблица 1
Сделать вывод о характере запасных веществ в исследуемых семенах. Отметить, какие вещества образовались при прорастании семян. Объяснить эти превращения исходя из взаимосвязи углеводного, жирового и белкового обменов. Задача. Провести сравнительное изучение превращения веществ в крахмалистых, белковых и маслянистых семенах при прорастании: 1) ячменя, бобов, подсолнечника; 2) пшеницы, гороха, льна; 3) ржи, фасоли, льна; 4) ячменя, люпина, льна; 5) пшеницы, подсолнечника, люпина. Общие результаты работы записать по форме табл. 2.
Таблица 2
Сделать вывод о наличии исследуемых углеводов в непроросших семянах разных видов (крахмалистых, белковых, маслянистых) и их появлении (исчезновении) в проросших семенах. Объяснить возникновение углеводов в прорастающих семенах, которые ранее не содержались в сухих семенах.
Краткие сведения Фермент каталаза относится к классу оксидоредуктаз. Он представляет собой железопротеид. Небелковая часть, как у пероксидазы, представлена железопорфирином. Деятельность каталазы в живой клетке сопряжена с активностью флавопротеидов __ важнейшего звена ЭТЦ дыхания. Каталаза расщепляет токсичную для живой клетки перекись водорода, образующуюся как побочный продукт деятельности флавопротеидов в пероксисомах. Реакция идет согласно уравнению каталаза
Полагают, что в очень мясистых тканях, лишенных достаточного доступа кислорода, каталаза играет роль поставщика последнего, генерируя его из перекиси водорода. Ход работы Из листа растения пробочным сверлом диаметром 1 см сделать 5 высечек, не захватывая крупные жилки. При работе с мясистыми органами растений (клубни, корнеплоды), перед тем как делать высечки, следует нарезать ткань пластинками толщиной 4–5 мм. Диски растереть в ступке с добавлением небольшого количества воды (до 1 мл). Если ткань жесткая, добавить немного песка. К растертой кашице прилить 5 мл воды тщательно перемешать и профильтровать в чистую пробирку через увлажненный складчатый фильтр. Для работы достаточно 3–4 мл вытяжки фермента. Добавить к вытяжке 2 мл 3% перекиси водорода. В результате разложения перекиси водорода ферментом выделяются пузырьки кислорода, дающие хорошо заметную пену. Для сравнения активности каталазы в различных объектах следует брать равное по сухой массе количество материала. Активность фермента оценить в баллах: интенсивное образование пены __ 4 балла, умеренное __ 3, слабое __ 2, очень слабое __ 1 балл, отсутствие активности __ 0 баллов. Результаты записать по форме табл.1. Таблица 1
Используя активность каталазы как косвенный показатель интенсивности дыхания, сделать вывод о зависимости активности каталазы и (косвенно) интенсивности дыхания от изучаемых внутренних и внешних факторов. Задача. Определить активность каталазы: 1) в молодых, зрелых и старых листьях; 2) в зрелых листьях различных видов растений (хлорофитум, узумбарская фиалка, пеларгония); 3) в различные органах растения (корень, стебель, лист); 4) в наружных и внутренних частях мясистых органов растений (клубни, корнеплоды); 5) в сухих, набухших и наклюнувшихся семенах ячменя. Общие результаты работы по вариантам записать по образцу табл.1, вычислить среднюю для каждого варианта.
Краткие сведения Пероксидаза является протеидом, состоящим из белка и простетической группы – железопорфирина. Установлено, что пероксидаза катализирует окисление различных циклических (фенолы, ароматические амины) и гетероциклических соединений кислородом перекиси водорода. Реакция идет согласно уравнению:
Перекись водорода образуется в клетке как побочный продукт каталитической деятельности флавиновых дегидрогеназ в электрон-транспортной цепи дыхания. Таким образом, деятельность пероксидазы по утилизации токсичной для клетки перекиси водорода косвенно связана с основной ЭТЦ дыхания. Вместе с тем установлено, что пероксидаза способна функционировать как типичная оксидаза, катализируя окисление субстрата кислородом воздуха: Е пероксидаза
Н+ пероксидаза е- 1/2О2→ →Н2О
Так, пероксидаза с одной стороны, может окислять кислородом воздуха НАД·Н2, с другой ___ передавать электроны, полученные от него, на различные акцепторы (например, на цитохром С). В обоих случаях пероксидаза является звеном ЭТЦ дыхания. Пероксидаза обнаружена практически во всех органоидах клетки и в цитоплазме. Ее легко выделить растиранием растительной ткани в воде или ацетатном буфере (рН 5,4). Обнаружение активности пероксидазы основано на ее способности в присутствии Н2О2 окислять бесцветные фенольные соединения до окрашенных хинонов. Ход работы При определении активности пероксидазы растительную ткань (около 200 мг) растереть в ступке с водой, слить в пробирку и довести водой до 5 мл. Для сравнения активности пероксидазы в различных объектах следует брать равное по сухой массе количество материала. Полученную смесь отфильтровать в сухую пробирку через увлажненный складчатый фильтр. Количество фильтрата должно быть около 2 мл. К этой вытяжке добавить 2 мл 0,3% перекиси водорода и 2 мл 1,5% раствора бензидина. Встряхнуть пробирку и через 30 с определить интенсивность посинения по 4-балльной шкале. Результаты записать по форме табл.1. Таблица 1
Сделать вывод об активности пероксидазы в исследуемых объектах. Задача. Изучить активность пероксидазы в зависимости: 1) от степени прорастания семян (сухие, наклюнувшиеся); 2) от видовой специфики запасающей ткани разных видов растений (мякоть картофеля, яблока, моркови); 3) от типа ткани определенного органа (кожура, глазки, мякоть клубня картофеля); 4) от возраста листа (молодой, зрелый, старый).
Краткие сведения
Полифенолоксидаза (ПФО), известная также как катехолоксидаза, фенолоксидаза или о-дифенол: кислород оксидоредуктаза катализирует окисление о-дифенолов до о-дихинонов (дифенолоксидазная, или катехолазная, активность, см. уравнение 1), а также о-гидроксилирование монофенолов (монофенолгидроксилазная, или крезолазная, активность, см. уравнение 2).
Только катехолоксидаза (ПФО) способна осуществлять о-гидроксилирование фенолов. Обычно в норме дифенолоксидазная активность значительно превышает монофенолгидроксилазную активность этого фермента. Гидроксилирование и окисление составляют две главные реакции в синтезе и расщеплении фенолов растения. Полифенолоксидаза — медьсодержащий фермент, субстратами которого могут быть катехол, хлорогеновая, галловая кислоты, пирокатехин и другие о-дифенолы. Полагают, что ПФО осуществляет окисление по одноэлектронному механизму. Это сопряжено с образованием свободных радикалов субстратов реакции, а также, возможно, с возникновением активированных форм кислорода. Оптимум активности рН лежит в довольно широких пределах (рН 5,0—7,0). Характерной особенностью фермента является низкое сродство к кислороду, поэтому для выявления максимальной активности фермента необходима хорошая аэрация субстратов. Катехолоксидаза — наиболее изученная и превалирующая форма фенолоксидазы в растениях. В клетках высших растений ПФО локализована в основном в пластидах всех типов (в хлоропластах, лейкопластах) и находится в латентном состоянии (прополифенолоксидаза). Активация латентной формы ПФО происходит при действии детергентов, жирных кислот, протеаз и некоторых других воздействиях. Физиологическая роль ПФО остается недостаточно ясной. Показано изменение ее активности в онтогенезе растений (активация ПФО при старении), при повреждениях и патогенезе. Активность ПФО может быть определена измерением скорости окисления фенолов (в ультрафиолетовой области спектра) или по образованию окрашенных продуктов. Однако механизм реакции сложен; он связан с образованием ряда последующих полимерных продуктов, поэтому определение активности фермента по скорости развития окраски в реакционной смеси возможно лишь на коротком начальном этапе реакции. Более удачным является определение активности ПФО по развитию окраски в окислительно-восстановительных реакциях, сопряженных с окислением фенолов. С этой целью используют систему пирокатехин-р-фенилендиамин или пирокатехин-диэтил-о-фенилендиамин. Реакция протекает следующим образом:
α-Хинон р-Фенилендиамин Окрашенный Пирокатехин продукт Ход работы. Навеску растительного материала (250—500 мг) растирают в ступке с небольшим количеством (10—15 мл) фосфатного буфера. Растертую массу переносят количественно в мерную колбу, доводят буфером точно до метки, хорошо перемешивают и оставляют на 10—15 мин. Затем раствор фильтруют через двойной бумажный фильтр или центрифугируют 10 мин при 4000 об/мин. Фильтрат (или надосадочную жидкость) используют для определения активности фермента. Активность фермента исследуют фотометрически на ФЭКе (λ. = 590 нм). Об активности фермента судят по времени развития окраски до определенной оптической плотности (значение оптической плотности D — выбирают в зависимости от скорости образования окраски в пределах от 0,025 до 0,4). Для анализа каждой биологической пробы используют три одинаковые кюветы для ФЭКа: одну контрольную и две опытные (две аналитические повторности из одной биологической пробы). Во все три кюветы вносят: 2 мл вытяжки, 2 мл буферного раствора, 2 мл диметил-о-фенилендиамина. Затем в контрольную кювету приливают 2 мл воды, устанавливают ее в контрольную (дальнюю) подставку ФЭКа и вводят в световой луч. Закрывают кюветную камеру и ручками грубой и тонкой регулировки устанавливают нуль на шкале оптической плотности по контрольному образцу. Одну из опытных кювет ставят в держатель и вводят ее в световой луч. Автоматической пипеткой добавляют в опытную кювету 2 мл раствора пирокатехина и одновременно включают секундомер. Пробу хорошо перемешивают стеклянной палочкой. Затем закрывают кюветную камеру и следят за развитием окраски по шкале оптической плотности. Замечают по секундомеру время достижения необходимой оптической плотности. Аналогичные изменения производят и для второй опытной кюветы. Расчет активности ведут по формуле
где А — активность фермента (относительные единицы на 1 г сырой массы за 1 с); D — зарегистрированная в опыте оптическая плотность; t— время (с); d — толщина кюветы, (см); α, β, γ – факторы разведения: α – отношение количества жидкости, взятой для приготовления вытяжки(мл к массе навески, г); β — степень дополнительного разведения вытяжки после центрифугирования (если это требовалось); γ— степень постоянного разведения вытяжки в кювете (в наших условиях равна 4). Результаты запишите в таблицу.
Таблица 1.
Сделать вывод об активности полифенолоксидазы в различных растительных объектах. Краткие сведения Запасные вещества растений (крахмал, белки, жиры и другие высокополимерные соединения) обладают относительно низкой химической активностью. При прорастании семян, корневищ, клубней они гидролизуются до простых и более активных веществ. Этот процесс осуществляется с участием специфических ферментов - гидролаз. Гидролитический распад запасного крахмала может протекать при участии четырех видов гидролаз: α-амилазы, β-амилазы, глюкоамилазы и амилопектин-1,6-глюкозидазы. Фосфоролитический распад ассимиляционного крахмала осуществляется ферментом α-глюканфосфорилазой. По мере набухания сухих семян в период прорастания активность гидролитических ферментов возрастает, при этом содержание крахмала снижается, а сахаров возрастает. Одно из распространенных запасных веществ – крахмал состоит из остатков глюкозы (С6Н10О5)n и представляет собой смесь двух полимеров: амилозы и амилопектина. Амилоза – линейный полимер, амилопектин - полимер с многократно разветвленной цепью. В связи с особенностями строения гидролиз этих соединений под действием амилазы протекает по-разному. Амилоза сразу расщепляется на молекулы дисахара мальтозы, амилопектин - постепенно, через декстрины (ряд промежуточных продуктов со все более укороченной цепью). Дальнейшее расщепление мальтозы до глюкозы осуществляется уже другим ферментом - мальтозой. Степень гидролиза крахмала определяется по реакции декстринов с
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 597; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.31.247 (0.137 с.) |
 С6Н1206+6 02 6 С02+6 Н20+2721,8 кДж/моль.
С6Н1206+6 02 6 С02+6 Н20+2721,8 кДж/моль.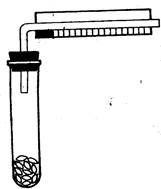
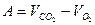 (1)
(1) (2)
(2) (3)
(3)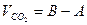 (4).
(4).
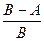 (5).
(5). Н2 О2 + Н2О2 О2 + 2Н2О
Н2 О2 + Н2О2 О2 + 2Н2О



 Субстрат → НАД·Н2 → ФП → ц.х.В → ц.х.С → ЦХО → О2
Субстрат → НАД·Н2 → ФП → ц.х.В → ц.х.С → ЦХО → О2