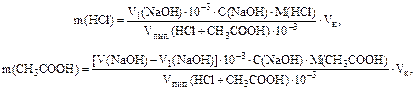Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания хлороводородной и уксусной кислот в растворе при их совместном присутствии ⇐ ПредыдущаяСтр 2 из 2
Определение проводят методом потенциометрического кислотно-основного титрования, титрант – стандартный раствор гидроксида натрия. При титровании смеси сильной хлороводородной и слабой уксусной (рКа = 4,75) кислот на кривой титрования наблюдается два скачка титрования. Вначале титруется хлороводородная, затем уксусная кислота. Однако дифференцированное титрование смеси хлороводородной и уксусной кислот в водном растворе невозможно провести с достаточной точностью из-за отсутствия заметного скачка потенциала в первой т.э., отвечающей оттитровыванию хлороводородной кислоты. Поэтому тируют аликвотные порции анализируемого раствора в водной и водно-ацетоновой средах: при титровании в водном растворе находят объем стандартного раствора щелочи, эквивалентной суммарному содержанию кислот, V(NaOH); при титровании в водно-ацетоновой среде определяют объем раствора щелочи, пошедшей на реакцию с хлороводородной кислотой V1(NaOH). Раздельное титрование раствора HCl становится возможным вследствие уменьшения степени диссоциации уксусной кислоты в присутствии ацетона. Расчет массы HCl и CH3COOH в анализируемом растворе проводят по формулам:
где Vпип.(HCl +CH3COOH) – аликвота, равная вместимости пипетки, мл; Vк – вместимость мерной колбы, л. Ход работы
1. Получите у лаборанта мерную колбу со смесью хлороводородной и уксусной кислот, доведите до метки дистиллированной водой и хорошо перемешайте.
2. Потенциометрическое титрование в водной среде.
Заполните бюретку стандартным раствором NaOH. В стакан для титрования отберите пипеткой аликвотную часть испытуемого раствора, добавьте 20-30 мл дистиллированной воды. Погрузите в стакан электроды (индикаторный – стеклянный, электрод сравнения – хлоридсеребряный), включите магнитную мешалку и приступите к титрованию. Вначале проведите ориентировочное титрование, приливая по 0,5 мл титранта и измеряя рН раствора. Результаты титрования занесите в табл.1.
Таблица 1 Результаты ориентировочного титрования в водной среде V(HCl + CH3COOH) =
При этом надо обнаружить два скачка потенциала или рН: первый небольшой и второй – основной. Первый скачок на кривой потенциометрического титрования смеси кислот соответствует нейтрализации HCl, второй скачок – нейтрализации CH3COOH.
Отсутствие заметного первого скачка потенциала не позволяет установить точный расход раствора щелочи на титрование хлороводородной кислоты. При повторном (точном) титровании в водной среде определяют вторую т.э., стандартный раствор щелочи вблизи второго скачка титрования приливайте по 0,1 мл. Результаты титрования занесите в табл.2.
Таблица 2 Результаты точного титрования в водной среде V(HCl + CH3COOH) =
3. Потенциометрическое титрование в водно-ацетоновой среде. Отберите аликвоту анализируемого раствора в стакан для титрования, добавьте двойной объем ацетона. Оттитруйте раствор щелочью, прибавляя в области первого скачка титрант порциями по 0,1 мл. Результаты титрования занесите в табл. 3.
Таблица 3 Результаты титрования в водно-ацетоновой среде V(HCl + CH3COOH) =
4. По результатам титрования постройте кривые титрования в водной и водно-ацетоновой средах в координатах рН (Е) – V(NaOH). Вклейте график в лабораторный журнал. 5. Чтобы точнее определить положение точек эквивалентности, постройте графики зависимости ∆рН/∆V от V(NaOH). Для этого на участках кривой по обе стороны от предполагаемых точек эквивалентности выберите по 3-4 точки и обработайте их, результаты занесите в табл.4. Таблица 4 Данные для построения дифференциальной кривой титрования
Постройте график зависимости ∆рН/∆V от V(NaOH) и по положению максимумов определите положение первой и второй точек эквивалентности и объемы титранта в первой т.э. (V1) и второй т.э. (V).
6. Вычислите содержание HCl и CH3COOH (в г) в анализируемом растворе. Лабораторная работа
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 1253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.217.228 (0.007 с.) |