Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионные механизмы генеза биопотенциалов кардиомиоцитов
Возбудимость, проводимость и автоматия миокарда обеспечиваются электрохимическими процессами, происходящими на плазматической мембране кардиомиоцитов (сарколемме). Важнейшим параметром, характеризующим эти процессы, является электрический заряд внутренней поверхности мембраны - мембранный потенциал. Мембранный потенциал кардиомиоцитов периодически изменяется (рис.2). В период времени между двумя электрическими импульсами возбуждения мембранный потенциал (так называемый максимальный диастолический потенциал) достигает в разных клетках миокарда от -50 до -95 мВ. В сократительных кардиомиоцитах весь этот период мембранный потенциал стабилен и называется поэтому потенциалом покоя. Мембранные потенциалы клеток водителей ритма во время диастолы не стабильны. Поэтому для этих клеток термин «потенциал покоя» не применяется. В момент возбуждения (генерации электрического импульса) регистрируется резкое колебание мембранного потенциала в сторону положительных величин (деполяризация), с последующим возвращением к уровню максимального диастолического потенциала. Этот электрический импульс называется потенциалом действия.
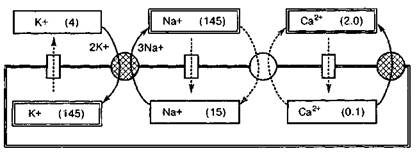
Рис.2. Ионные градиенты и транспорт ионов через плазматическую мембрану кардиомиоцита в скобках - концентрации ионов, ммоль/л; сплошные стрелки - активный транспорт; пунктирные стрелки - пассивный транспорт; прямоугольники - ионные каналы; заштрихованные кружки - ионные насосы; светлый кружок – Na+/Ca2+- переносчик.
Величина мембранного потенциала в любой момент времени определяется трансмембранными токами ионов (в основном - калия, натрия и кальция). Скорость движения ионов через сарколемму зависит от функционирования мембранных белков-переносчиков: ионных каналов и насосов (рис.2). Через ионные каналы осуществляется облегченная диффузия ионов - пассивный транспорт, не требующий затрат энергии. Направление и скорость диффузии определяются величиной электрохимического градиента для данного иона (т. е. разностью его внутри- и внеклеточной концентраций и зарядом мембраны). Большинство каналов ионоселективны, т. е. преимущественно проницаемы для какого-либо одного вида ионов, Движение ионов против электрохимического градиента (активный транспорт) осуществляется ионными насосами, которые сопряжены с мембранными ферментами (АТФ-азами). Последние ускоряют гидролиз АТФ, а выделяющаяся при этом энергия расходуется на перенос ионов. Среди таких переносчиков наибольшую роль в кардиомиоцитах играют: K+/Na+ -насос (переносит ионы Na+ наружу клетки, а ионы К+ - внутрь) и Са2+-насос (выводит ионы Са2+ из кардиомиоцита). Основным результатом деятельности ионных насосов является создание и поддержание градиентов концентрации ионов по сторонам плазматической мембраны: снаружи значительно повышена концентрация ионов Na+ и Са2 +, а внутри - ионов К+.
В межимпульсный период проницаемость мембраны кардиомиоцитов для ионов К+ значительно больше, чем для других ионов. Поэтому возникновение отрицательного диастолического потенциала определяется, в основном, пассивно выходящим из клетки током ионов калия. Другим током, участвующим в формировании диастолического потенциала кардиомиоцитов, является активный ток, непосредственно создаваемый K +/Na+ -насосом. При работе этого насоса происходит неэквивалентный (электрогенный) обмен ионов: на каждые 2 иона К+, введенных в клетку, выводится 3 иона Na+. В результате возникает выходящий из клетки ток положительных зарядов - насосный ток, который увеличивает отрицательный внутриклеточный заряд. Доля насосного тока в формировании мембранного потенциала тем больше, чем больше электрическое сопротивление сарколеммы, и может составлять 25% и более (особенно в клетках Пуркинье). Активность K+ /Na+- АТФ-азы и величина насосного тока регулируются концентрациями переносимых ионов, усиливаясь при увеличении внеклеточной концентрации ионов К+ и внутриклеточной концентрации ионов Na+. В клетках водителей ритма сердца диастолический потенциал нестабилен и самопроизвольно отклоняется от максимального отрицательного уровня в сторону деполяризации. Этот феномен, называемый спонтанной (медленной) диастолической деполяризацией, свойственен всем проводящим кардиомиоцитам и является основой их автоматии. Когда в результате спонтанной деполяризации мембранный потенциал достигает критического уровня (порогового потенциала), пейсмекер генерирует потенциал действия. При развитии потенциала действия в одном кардиомиоците деполяризация распространяется на соседние невозбужденные клетки. В результате мембранный потенциал этих клеток достигает порогового уровня, и в них также возникает потенциал действия. Таким образом, распространение возбуждения по миокарду происходит согласно «принципу домино»: предыдущая клетка возбуждает последующую.
В норме с наибольшей скоростью спонтанная диастолическая деполяризация протекает в пейсмекерах синоатриального узла. Поэтому в этих клетках пороговый потенциал достигается наиболее быстро, что и обусловливает самую большую частоту генерации потенциалов действия (60-80 в 1 мин). В изолированных кардиомиоцитах атриовентрикулярного соединения и проводящей системы желудочков (латентные пейсмекеры) спонтанная диастолическая деполяризация протекает с меньшей скоростью, а в сократительных кардиомиоцитах отсутствует. Таким образом, в норме перечисленные клетки возбуждаются не спонтанно, а лишь под влиянием импульсов, поступающих от синоатриального узла. Пусковыми стимулами для возбуждения кардиомиоцитов могут явиться и внешние электрические импульсы, получаемые от искусственных водителей ритма (кардиостимуляторов), а также механическое раздражение, например, сильный удар в область грудины при остановке сердца. Основная роль в формировании потенциала действия кардиомиоцита принадлежит входящему в клетку току ионов Na + и (или) Са2+. Сила этого тока регулируется потенциалзависимыми ионными каналами, которые при диастолическом уровне мембранного потенциала закрыты, а при деполяризации открываются (активируются). Когда деполяризация достигает величины порогового потенциала, количество активированных каналов становится достаточным для замыкания положительной обратной связи: «деполяризация - активация ионных каналов - усиление входящего тока - деполяризация». В результате возникает самоподдерживаемый, лавинообразный вход катионов в клетку, составляющий суть формирования потенциала действия. Описанный процесс приводит к сильной деполяризации мембраны, при которой каналы входящего тока инактивируются, т. е. закрываются и временно теряют способность к активации. Сила входящего тока при этом падает, а мембранный потенциал вследствие выхода из клетки ионов К+ возвращается к диастолическому уровню. В межимпульсный период каналы входящего тока вновь обретают способность к активации, а исходное распределение ионов по обе стороны сарколеммы восстанавливается за счет работы ионных насосов. В 1975 г. американский электрофизиолог П. Крейнфилд предложил классифицировать кардиомиоциты по скорости развития фазы деполяризации потенциала действия на клетки с «медленным ответом» и клетки с «быстрым ответом». В сарколемме клеток первого типа представлены, в основном, «медленные» каналы входящего тока, которые характеризуются низкими скоростями активации и инактивации. Эти каналы проницаемы для ионов Са2+ и Na+ (в соотношении примерно 1000: 1) и обозначаются как Ca 2+,Na +- или просто Са 2+-каналы. В поверхностной мембране кардиомиоцитов с «быстрым ответом», кроме указанного вида каналов, находятся также «быстрые» натриевые каналы,проницаемые исключительно для ионов Na+ и обладающие высокими скоростями активации и инактивации. Именно свойства ионных каналов входящего тока и определяют особенности формирования потенциала действия и электрофизиологические параметры «медленных» и «быстрых» кардиомиоцитов, сравнительная характеристика которых представлена в табл.1.
Таблица 1 Основные типы кардиомиоцитов и их свойства
* Длительность потенциала действия в предсердиях – 100-300 мс ** Скорость проведения в AN-зоне атриовентрикулярного соединения около 0,05 м/с, в пучке Гиса - меньше, чем в волокнах Пуркинье, в сократительных миоцитах предсердий - меньше, чем в желудочках. *** Сократительные кардиомиоциты не обладают автоматией.
Клетки с «быстрым ответом». К этому типу относятся все сократительные кардиомиоциты, а также проводящие кардиомиоциты предсердий и некоторые элементы проводящей системы желудочков (волокна Пуркинье). Кроме высокой скорости деполяризации, указанные клетки характеризуются большой амплитудой потенциала действия, а также высокой скоростью и надежностью проведения возбуждения. Максимальный диастолический потенциал в этих кардиомиоцитах составляет около -90 мВ, а процесс формирования потенциала действия складывается из следующих пяти фаз (рис.3,б): Фаза 0 - быстрая деполяризация - протекает со скоростью, достигающей 1000 В/с (в клетках Пуркинье), и обеспечивается, в основном, входящим током ионов Na+. Необходимое количество «быстрых» Na+ -каналов активируется при деполяризации мембраны до пороговой величины, составляющей около -60 мВ. Когда мембранный потенциал достигает примерно -40 мВ, начинают активироваться «медленные» Са2+-каналы, и к натриевому току добавляется входящий кальциевый ток, вклад которого становится значимым только в формировании положительных значений мембранного потенциала - «овершута». На протяжении всей фазы 0
регистрируется также выходящий ток ионов К+, однако сила этого тока мала, по сравнению с натриевым током, так как проницаемость мембраны для ионов К+ в эту фазу значительно меньше, чем для Na+, а клетка большую часть времени заряжена внутри отрицательно. Фаза 1 - начальная быстрая реполяризация. Когда величина мембранного потенциала достигает примерно + 20 мВ, натриевые каналы быстро инактивируются, и вход ионов Na+ в клетку прекращается. Входящий ток Са2+ при этом сохраняется, так как «медленные» Са 2+-каналы инактивируются позже. В то же время реверсия мембранного потенциала вызывает заметное усиление выходящего тока К+ (в частности, из-за активации потенциалзависимых калиевых каналов). Интенсивный выход ионов К+ на фоне относительно небольшого входящего тока Са2+ приводит к уменьшению положительного заряда внутри клетки. В клетках волокон Пуркинье в эту фазу происходит также кратковременная активация потенциалзависимых хлорных каналов, через которые анионы Сl- поступают в клетку, что ускоряет реполяризацию. Фаза 2 - медленная реполяризация (фаза «плато»). Характеризуется примерным равновесием между выходящим током ионов К+ и входящим током ионов Са2+, что обеспечивает относительную стабилизацию мембранного потенциала. Фаза «плато» является наиболее значимой для сократительных кардиомиоцитов, так как входящие в это время в цитоплазму ионы Са2+ инициируют процесс сокращения. Кроме того, от длительности фазы «плато» зависит продолжительность периода рефрактерности. Фаза 3 - конечная быстрая реполяризация. Примерно через 200 мс после начала потенциала действия Са 2+-каналы практически полностью инактивируются, а вход ионов Са2+ в кардиомиоцит прекращается. Продолжающийся выход ионов К+ обеспечивает возвращение мембранного потенциала к максимальному диастолическому уровню. Фаза 4 - покой (в сократительных кардиомиоцитах) или спонтанная диастолическая деполяризация (в клетках Пуркинье).
Таблица 2
Сравнительная характеристика кардиомиоцитов с «быстрым» и «медленным ответом»
Клетки с «медленным ответом» представлены, в основном, проводящими кардиомиоцитами синоатриального узла и атриовентрикулярного соединения. Для этого типа кардиомиоцитов, по сравнению с «быстрыми» клетками (табл.2), характерны меньшая величина максимального диастолического потенциала (МДП) (около -60 мВ), а также меньшая амплитуда потенциала действия (ПД) и скорость его распространения. Фазы де- и реполяризации потенциала действия «медленных» клеток протекают более плавно, чем в «быстрых» (рис.3,а). Фаза 0 - быстрая деполяризация - характеризуется небольшой по сравнению с «быстрыми» клетками скоростью (до 20 В/с) и обеспечивается входящим током ионов Са2+. Пороговый потенциал, при котором активируется достаточное для обеспечения этого тока количество «медленных» Са 2+-каналов, примерно равен -40 мВ. Фазы 2 и 3 - реполяризация. По сравнению с «быстрыми» клетками фаза I (начальная быстрая реполяризация) отсутствует, вершина потенциала действия и фаза реполяризации сглажены, «плато» не выражено и четкой границы между фазами 2 и 3 нет. Величина мембранного потенциала в фазу реполяризации определяется соотношением между выходящим током ионов К+ и входящим током ионов Са2+ на фоне медленной инактивации Са2+-каналов. Завершается реполяризация достижением уровня максимального диастолического потенциала. Фаза 4 - спонтанная диастолическая деполяризация. В истинных пейсмекерах в результате этого процесса мембранный потенциал достигает порогового уровня, фаза 4 плавно переходит в фазу 0 очередного потенциала действия, и цикл повторяется. В латентных пейсмекерах спонтанная диастолическая деполяризация прерывается импульсом, приходящим от синоатриального узла, что обусловливает скачкообразный переход фазы 4 в фазу 0 следующего цикла. Спонтанная диастолическая деполяризация и, следовательно, автоматия характерны для всех клеток с «медленным ответом», в то время как среди «быстрых» клеток этим свойством в норме обладают лишь клетки Пуркинье. Вместе с тем, в условиях повреждения сократительные кардиомиоциты также могут самовозбуждаться и генерировать электрические импульсы, что является одной из причин возникновения экстрасистолии и других нарушений ритма сердца.
Рис.3. Потенциалы действия кардиомиоцитов По оси ординат - мембранный потенциал (мВ); по оси абсцисс - время (мс), П -пороговый потенциал (критический уровень деполяризации). А-клетки-пейсмекеры синоатриального узла («медленные» клетки): 0 - быстрая деполяризация; 2-3 - реполяризация; 4 - медленная (спонтанная) диа-столическая деполяризация. МДП - максимальный диастолический потенциал. б - сократительные кардиомиоциты желудочков («быстрые» клетки); 0- быстрая деполяризация; 1 - начальная быстрая реполяризация; 2 - медленная реполяризация; 3 - конечная быстрая реполяризация; 4 - покой. ПП - потенциал покоя; ПД - амплитуда потенциала действия; Р - реверсия мембранного потенциала. ∆t - время проведения возбуждения от синоатриального узла к желудочкам.
Ионные механизмы спонтанной диастолической деполяризации окончательно не установлены. В разных клетках-пейсмекерах она может быть вызвана повышением проницаемости для ионов Na+ (или Са2+) и усилением входящего в клетку тока этих ионов или (и) снижением проницаемости для ионов К+ и уменьшением соответствующего выходящего тока.
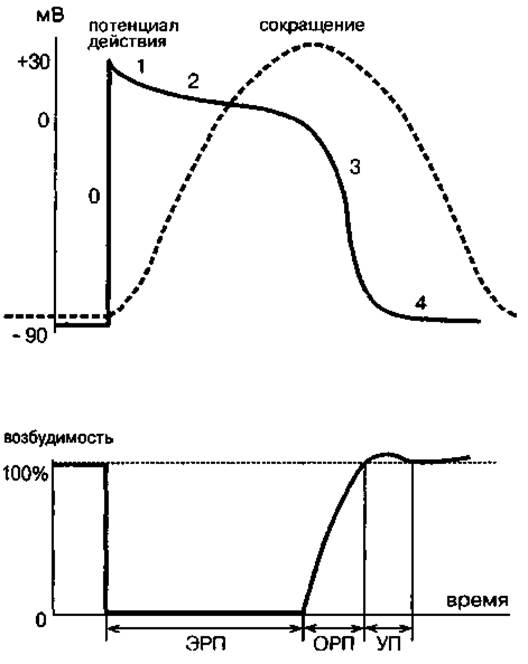
4. Рефрактерность миокарда В процессе развития потенциала действия возбудимость кардиомиоцитов меняется в зависимости от величины мембранного потенциала, что связано с изменением состояния натриевых и кальциевых ионных каналов. Во время деполяризации мембраны происходит инактивация потенциалзависимых каналов и снижение возбудимости (способности к генерации потенциала действия в ответ на очередное раздражение). По мере реполяризации ионные каналы постепенно выходят из состояния инактивации, и возбудимость кардиомиоцита восстанавливается. Состояние пониженной возбудимости называется рефрактерностью, а соответствующий период времени - рефрактерным периодом. Различают несколько фаз рефрактерного периода, которые у клеток с «быстрым ответом» четко соотносятся с фазами потенциала действия (рис.4). Время, в течение которого кардиомиоцит не способен генерировать распространяющееся возбуждение в ответ на раздражение любой силы, называется эффективным рефрактерным периодом (ЭРП). Этот период совпадает по времени с фазами быстрой деполяризации, начальной быстрой реполяризации, «плато» и началом фазы конечной реполяризации потенциала действия «быстрых» кардиомиоцитов. Фаза быстрой деполяризации характеризуется максимально возможной скоростью активации Na+-каналов, после чего наступает их быстрая инактивация (во время фаз начальной реполяризации и «плато»). В это время кардиомиоцит находится в состоянии абсолютной рефрактерности, никак не реагируя на любые стимулы, вплоть до повреждающих. В начале фазы конечной реполяризации потенциала действия некоторые Na+-каналы выходят из состояния инактивации, однако их еще недостаточно для обеспечения распространяющегося по сердечной мышце возбуждения. В течение этого короткого промежутка времени миокард способен только к локальным реакциям на раздражение.
Рис.4. Изменения возбудимости сократительных кардиомиоцитов Цифрами обозначены фазы потенциала действия. (Остальное объяснение в тексте.)
Когда в процессе реполяризации мембранный потенциал достигает примерно -60 мВ, к активации оказывается способным такое количество Na+-каналов, что становится возможным развитие распространяющегося возбуждения. Однако потенциал действия возникает только в ответ на более сильные, чем обычно (сверхпороговые раздражители), а скорость распространения возбуждения по миокарду снижена. Промежуток времени, когда кардиомиоцит находится в таком состоянии, называется относительным рефрактерным периодом (ОРП). Этот период соответствует второй половине фазы конечной реполяризации потенциала действия «быстрых» кардиомиоцитов и длится очень короткое время (до 50 мс) после достижения максимального диастолического потенциала. Суммарная продолжительность эффективного и относительного рефрактерных периодов (т. е. общее время восстановления нормальной возбудимости) у «быстрых» кардиомиоцитов практически равно длительности потенциала действия. В «медленных» клетках полное восстановление возбудимости возможно не ранее чем через 100 мс после окончания реполяризации. Такое удлинение рефрактерного периода по отношению к длительности потенциала действия объясняется тем, что Са2+-каналы, ответственные за возбуждение клеток с «медленным ответом», выходят из состояния инактивации гораздо медленнее, чем Na+-каналы «быстрых» кардиомиоцитов. Рефрактерность играет важную роль в обеспечении нормальной деятельности сердца. Рефрактерный период сердечной мышцы «закрывает» практически весь период ее сокращения, защищая в это время миокард от действия раздражителей, которые могли бы вызвать преждевременное повторное возбуждение и сокращение. Поэтому даже при очень высокой частоте стимуляции частота сердечных сокращений не превышает уровень, определяемый длительностью рефрактерного периода. Таким образом, сохраняется минимальный резерв времени, необходимый, чтобы, камеры сердца успевали расслабляться и наполняться кровью. Рефрактерность обеспечивает также нормальную последовательность распространения возбуждения в сердце и электрическую стабильность миокарда. Так как участок миокарда, по которому проходит возбуждение на некоторое время становится рефрактерным, повторный вход возбуждения в этот участок невозможен. Благодаря этому, встречные волны возбуждения в миокарде взаимно «гасят» друг друга, что препятствует, в частности, возникновению циркуляции возбуждения. В заключительной стадии каждого цикла возбуждения сердца существует интервал времени, когда реполяризующиеся кардиомиоциты выходят из состояния рефрактерности и их проводимость восстанавливается, причем этот процесс в одних клетках начинается раньше, чем в других. В результате на короткое время, называемое уязвимым периодом (УП), миокард становится неоднороден по рефрактерности и теряет электрическую стабильность. Стимул, действующий на миокард в этот период (например, импульс электрического тока или рано пришедший из других отделов сердца потенциал действия), может привести к серьезным нарушениям нормального хода возбуждения, в частности, к возникновению круговых волн возбуждения по механизму «re-entry» (повторный вход). Феномен «re-entry» является одной из причин образования в различных участках миокарда эктопических очагов самовозбуждения, активность которых часто оказывается выше, чем у синоатриального узла. Такие очаги автоматии могут становиться патологическими водителями ритма сердца, что является одним из механизмов возникновения тахиаритмий (нарушений сердечного ритма с увеличением его частоты). Резкие нарушения нормальных соотношений возбудимости и рефрактерности могут привести к образованию в миокарде множественных автономных очагов возбуждения и полной десинхронизации и дискоординации активности волокон миокарда, когда они начинают возбуждаться и сокращаться независимо друг от друга. Это состояние называется фибрилляцией и сопровождается практически полной утратой насосной функции соответствующего отдела сердца. Фибрилляция желудочков представляет собой наиболее грозное нарушение сердечного ритма, являясь одной из основных причин внезапной смерти вследствие остановки кровообращения. Иногда восстановить сердечную деятельность в этом случае удается с помощью электрической дефибрилляции - воздействия на миокард коротким электрическим разрядом напряжением в несколько тысяч вольт. Такой разряд вызывает возбуждение большей части кардиомиоцитов и их синхронизацию по рефрактерности, после чего возможно восстановление нормального ритма. Фибрилляция предсердий (которая называется также мерцательной аритмией), как правило, менее опасна. В этом случае, хаотическое возбуждение предсердий случайным образом проводится через АВ-соединение, но далее распространяется в обычной последовательности по системе Гиса-Пуркинье. В результате миокард желудочков возбуждается синхронно, что позволяет в той или иной степени осуществлять их насосную функцию. Однако ритм сокращений желудочков при этом абсолютно нерегулярный, и при каждом сокращении выбрасывается различное количество крови, что дает повод называть это состояние «бредом сердца» (delirium cordis).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 1174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.66.178 (0.036 с.) |