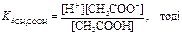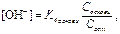Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід №1. Реакції іонного обміну в розчинах електролітів.
Провести реакції між розчинами електролітів у результаті яких утворюються осади, газоподібні сполуки та слабкі електроліти. Пояснити спостерігаємі явища, на- писати рівняння реакцій в молекулярному, іонному та скороченому іонному вигляді. Дослід №2. Основні випадки гідролізу солей. До п’яти пробірок містять по 1 г сухих солей: Na2SO4, ZnCl2, К2CO3, (NH4)2CO3, Pb(CH3COO)2. Розчиняють їх у воді. До кожної пробірки додають краплю індикатора (наприк-лад, лакмусу). Відзначають зміну забарвлення індикатора, якщо вона відбулася. Написати рівняння гідролізу, вираз константи гідролізу для кожного ступеня, указати рН середовища.
Дослід №3. Реакції взаємного посилення гідролізу. До пробірки містять 5-6 крапель розчину хром (ІІІ) хлориду та додають розчин натрій карбонату до утворення малорозчинного осаду. Аналогічний дослід вико-нують з розчином алюміній (ІІІ) сульфату додаючи до нього розчин натрій сульфіду, до утворення осаду. Написати відповідні рівняння реакцій та пояснити, чому при взаємодії розчинів вищенаведених солей гідроліз відбувається незворотно.
Висновок: Рекомендована література 1. Біонеорганічна, фізична, колоїдна і біоорганічна хімія. Вибрані лекції. Навч. посібник / Л.О. Гоцуляк та ін. – Одеса: Одес. держ. мед. ун-т, 1999. 2. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. – М.: Высшая школа, 1990. 3. Калібабчук В.О., Грищенко Л.І., Галинська В.І. Медична хімія. – К.: Інтермед, 2008. 4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М.: Высшая школа, 1989. 5. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2013. 6. Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994. 7. Миронович Л.М., Мардашко О.О. Медична хімія. – К.: Каравела, 2007. 8. Физическая и коллоидная химия. Под ред. проф. Кабачного В.И. – Харьков: Изд-во НФАУ, 2001. 9. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. – К.: Вища школа, 1986. Практична робота №3
Тема: Буферні розчини. Розрахунок рН буферних розчинів Мета роботи: узагальнити знання про буферні розчини, їх практичне застосування, механізм буферної дії, значення буферних систем в біологічних системах та клінічних дослідженнях, навчитися розраховувати рН буферних розчинів.
Питання до самостійної підготовки. 1. Склад буферних розчинів згідно з протолітичною теорією Бренстеда–Лоурі. 2. Механізм буферної дії. 3. Буферна ємність. Розрахунок буферної ємності за кислотою та лугом. 4. Розрахунок рН буферних розчинів. Рівняння Гендерсона–Гассельбаха. 5. Буферні системи крові. 6. Кислотно-основна рівновага в організмі. Поняття про ацидоз та алкалоз. Хімічний посуд: штатив із пробірками, колби для титрування, бюретки, піпетки (дозатори). Реактиви: 0,1 н розчини СН3СООН, СН3СООNa, НCl, NaОН; універсальний індикатор, метил-оранж, спиртовий розчин фенолфталеїну; сироватка крові; дистильована вода. Теоретична частина Для створення та підтримання сталого значення рН реакційного середовища при перебігу реакцій в хімічних і біологічних системах використовують буферні розчини. Буферний розчин перешкоджає зміні рН, яка може відбуватися при розведенні розчину або при додаванні до нього сильної кислоти чи сильної основи. Буферні розчини – це суміш слабкої кислоти і солі цієї кислоти, або суміш слабкої основи і солі цієї основи, або суміш розчинів солей багатоосновних кислот різного ступеня заміщен- ня. Таким чином, буферна система – це суміш спряженої кислоти і основи.
Таблиця 2. Буферні розчини.
Буферна дія заснована на тому, що окремі компоненти буферних сумішей зв’язують іони Н + або ОН– з утворенням слабких електролітів. Наприклад,додавання до ацетатного буферу натрій гідроксиду або хлоридної кислоти:
СН3СООН (кислота) + NaОН → СН3СООNa + Н2О, СН3СООН + ОН– → СН3СОО– + Н2О,
СН3СООNа (основа) + HCl → СН3СООН + NаCl, СН3СОО– + H+ → СН3СООН.
Якщо до 1 л ацетатної буферної суміші (рН = 4,76) додати 100 мл 0,1 М хлоридної кис-лоти, то рН зміниться від 4,76 до 4,66. При додаванні HCl до чистої води, рН зміниться в ме-жах від 7 до 2. При розведенні співвідношення концентрацій СН3СООН до СН3СООNа не змінюється.
Кількісно буферні розчини характеризують буферною ємністю – це число еквівалентів сильної кислоти або сильної основи, яке необхідно додати до 1 л буферного розчину, щоб значення рН змінилося на одиницю. Вимірюється буферна ємність у моль/л. Буферна ємність розчину залежить відприроди речовини, тобто Кд кислоти або основи та співвідношення концентрацій кислоти і солі чи основи і солі. Чим ближче це співвідно-шення до одиниці та вище концентрація компонентів, тим більше буферна ємність. Обчислюють буферну ємність В за кислотою або за лугом: де С – концентрація електроліту; V – об’єм електроліту.
Значення рН будь-якої буферної системи обчислюють, виходячи зі значення константи дисоціації кислоти або основи (а точніше р Ka або p Kb) і молярних концентрацій цієї кислоти або основи в розчині. Розрахунок рН ацетатного буферу. CH3COOH «CH3COO– + H+
Рівняння Гендерсона–Гассельбаха для розрахунку рН ацетатного буферу має вигляд: Розрахунок рН амоніачного буферу. NH4OH «NH4+ + OH–
Ураховуючи, що рН = 14 – рОН, тоді Для нормального функціонування організму необхідне підтримання сталих характерис- тик крові і тканинних рідин: рН, температури, тиску та концентрації речовин. Зміна рН будь-яких біологічних систем, особливо крові, може призвести до патологічних процесів в орга-нізмі. Тому важливим є підтримання рН у визначених межах, характерних для здорового ор-ганізму (7,36). Регуляторними системами, що забезпечують сталість рівня рН крові і тканин-них рідин, є буферні системи крові (гідрогенкарбонатна, фосфатна, оксигемоглобін-гемогло-бінова та білкова), діяльність легень та видільна функція нирок. Кислотно-основний стан організму можна оцінити за допомогою рівняння Гендерсона–Гассельбаха, виведеного для гідрогенкарбонатної буферної системи, яка діє переважно в ери-троцитах та в позаклітинних рідинах:
у плазмі крові (при 37°С) встановлюється рівновага Н2СО3 «Н+ + НСО3–, p Kа (I) = 6,1.
Зміщення кислотно-лужної рівноваги в бік підвищення концентрації гідроген(+1)-іонів та зменшення резервної лужності має назву ацидоз, а зміщення його в бік зниження концен-трації гідроген(+1)-іонів та збільшення резервної лужності – алкалоз.
|
||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 234; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.46.36 (0.008 с.) |