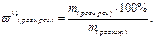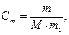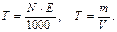Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квнз «запорізький медичний коледж» запорізької обласної радиСтр 1 из 6Следующая ⇒
Методична комісія професійно-практичного циклу Лабораторного та фармацевтичного профілю Медична хімія
Модуль І. Комплексоутворення та кислотно-основна рівновага В організмі і біологічних рідинах Змістовий модуль 1. Кислотно-основна рівновага В організмі і біологічних рідинах Змістовий модуль 2. Хімія біогенних елементів. Комплексоутворення в біологічних системах
Методичний посібник до практичних занять та завдання до самостійної підготовки
для студентів 2 курсу денного відділення спеціальності 5.12010101 «Лікувальна справа»
Запоріжжя УДК 543.9
Медична хімія Модуль І. Комплексоутворення та кислотно-основна рівновага в організмі і біологічних рідинах. Методичний посібник до практичних занять та завдання до самостійної підготовки для студентів 2 курсу денного відділення спеціальності «Лікувальна справа» (видання друге)
Укладачі: викладач вищої категорії, к.біол.н. Галиця В.В., викладач Трінкаль Є.В.
Рецензенти: доц. кафедри фізичної та колоїдної хімії Запорізького державного медичного університету, декан фармацевтичного факультету (заочної форми навчання), к.хім.н. Пряхін О.Р.
зав. кафедри фармакології та медичної рецептури Запорізького державного медичного університету, проф., д.біол.н. Беленічев І.Ф.
Відповідальний за випуск: завідувач методичної комісії професійно-практичного циклу лабораторного та фармацевтичного профілю, викладач вищої категорії Толмосова Н.М.
Методичний посібник включає практичні роботи, які виконуються студентами 2 курсу спеціальності «Лікувальна справа» денного відділення при вивченні дисципліни «Медична хімія». До кожної роботи наведені питання до самостійної підготовки, теоретичний матеріал, задачі та приклади їх розв’язання, навчальні завдання для самостійного виконання та лабораторні досліди.
Обговорено і схвалено на засіданні методичної комісії професійно-практичного циклу лабораторного та фармацевтичного профілю КВНЗ «Запорізький медичний коледж» ЗОР Протокол №1 від 29.08.2014
ÓГалиця В.В., Трінкаль Є.В., 2014 ÓКВНЗ «Запорізький медичний коледж» ЗОР, 2014
Передмова
Викладання курсу «Медична хімія» безпосередньо пов’язане з інтеграцією сучас-ної медичної освіти у ВНЗ та впровадженням новітніх фізико-хімічних, біохімічних та фармакологічних методів дослідження в медичній практиці. Зв’язок медичної хімії з дисциплінами медико-біологічного профілю (медичною біологією, фізіологією, клінічною патологією, фармакологією тощо) сприяє розвитку у студентів науково-природничого світогляду, який у подальшому навчанні допомагає формувати клі-нічне мислення та дає можливість ґрунтовно пояснювати певні функціональні за-кономірності біологічних систем (на молекулярному, клітинному, тканинному рів-нях), застосовувати фізико-хімічні методи дослідження для їх аналізу. Це дозволяє більш детально розуміти функції окремих систем та організму в цілому. Медична хімія сприяє формуванню системних знань щодо закономірностей у хі-мічній поведінці біологічно-активних сполук, їх взаємозв’язку з будовою та власти-востями і використанню цих знань у якості основи для вивчення на молекулярному рівні процесів, які перебігають у живому організмі. Особливої уваги заслуговує необхідність самостійної роботи студентів, що сприяє закріпленню теоретичних знань та формуванню практичних навичок. Згідно з тематичним розподілом дисципліни «Медична хімія», яку вивчають на спеціальності «Лікувальна справа», курс містить 3 модулі «Комплексоутворення та кислотно-основна рівновага в організмі і біологічних рідинах», «Рівновага в біо-логічних системах на межі поділу фаз» та «Біологічно важливі класи органічних сполук та їх властивості». Загальна кількість годин – 81, з яких 33 години відведено на самостійну (позааудиторну) роботу студентів. Практична робота №1
Тема: Способи вираження концентрації розчинів Мета роботи: узагальнити знання про розчини та умови утворення розчинів, вивчити кількісні характеристики складу розчинів, способи вираження концентрації, ознайоми-тися з практичним значенням та застосуванням розчинів різних концентрацій в медич-ній практиці, навчитися готувати розчини заданих концентрацій.
Питання до самостійної підготовки. 1. Розчини як фізико-хімічні системи. Умови утворення розчинів. Розчинність речовин. 2. Принцип, за яким компоненти розчину відносять до розчинника та розчиненої речовини. 3. Насичені, ненасичені та перенасичені розчини. 4. Теорії розчинів. 5. Кількісні характеристики складу розчинів: а) мольна частка; б) масова частка; в) молярна концентрація (молярність); г) моляльна концентрація (моляльність); д) молярна концентрація еквівалента, розрахунок еквівалентних мас кислот, основ, солей, оксидів; є) титр. 6. Перерахунок концентрації з однієї форми до іншої. Теоретична частина Розчином називають гомогенну термодинамічно стійку систему, яка складається з двох або більш компонентів, роздрібнених до розмірів атомів, молекул, іонів. Термодинамічними умовами утворення розчинів є зниження енергії Гіббса та збільшення ентропії. У рідких розчинах розрізняють розчинник та розчинену речовину. Розчинені речовини можуть бути в твердому, рідкому та газопобідному стані. Найбільше практичне значення мають рідкі розчини, у яких розчинником є вода. Вода – біологічний розчинник, вона прий-має участь в багатьох обмінних реакціях (гідроліз, гідратація, плазмоліз). Між молекулами води відбувається диполь-дипольна взаємодія. Існують дві теорії, які описують поведінку розчинів – фізична та хімічна. Згідно з фізич-ною теорією, розчинення – це рівномірний розподіл частинок розчиненої речовини у всьому об’ємі індиферентного розчинника. Хімічна теорія розглядає розчини як системи, утворені частинками розчинника, розчиненої речовини та нестійких хімічних сполук (сольватів), які виникають між ними за рахунок водневих або електростатичних сил взаємодії. Сучасна теорія розчинів поєднує фізичну та хімічну точки зори. Склад розчину кількісно виражають через безрозмірні відносні одиниці – частки (масо-ву, об’ємну, мольну) та розмірні величини – концентрації. Під терміном концентрація – розу-міють відносну кількість даної речовини у системі (суміші, розчині). · Масова частка – маса розчиненої речовини у 100 г розчину: m (розчину) = m (розч. реч.) + m (розчинника). · Мольна частка – відношення кількості розчиненої речовини (або розчинника) до суми кіль-костей всіх речовин, які складають розчин: х 2 – мольна частка розчиненої речовини; n 1 – кількість розчинника; n 2 – кількість розчиненої речовини. · Молярна концентрація (молярність) – кількість розчиненої речовини в розчині об’ємом 1 л:
Виражають молярну концентрацію у моль / л, моль / дм 3, моль / м 3 або М. · Моляльна концентрація (моляльність) – кількість розчиненої речовини в 1 кг розчинника: m 1 – маса розчинника (у кг).
Моляльність виражають у моль / кг. · Молярна концентрація еквівалента (нормальна) – кількість еквівалентів розчиненої речови-ни в розчині об’ємом 1 л: Е – еквівалентна маса розчиненої речовини.
Молярну концентрацію еквівалента виражають у моль-екв / л, моль-екв / дм 3 або н. Між об’ємами розчинів та їх нормальними концентраціями існує обернена пропорційність:
N 1 V 1 = N 2 V 2, звідки
· Титр – маса речовини в 1 мл розчину (г / мл):
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 321; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.48.131 (0.011 с.) |