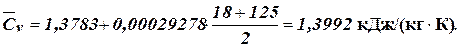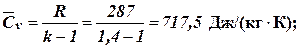Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Заняття № 1. Основні параметри робочого тіла. Рівняння стану ідеальних газів. Термодинамічні процеси
Приклад 1.1. Визначити абсолютний тиск пари в котлі, якщо манометр показує Р = 1,3 бар, а атмосферний тиск за ртутним барометром складає 680 мм рт. ст. при t = 25°С. Рішення. Барометричний тиск необхідно перерахувати до 0 ºС: Ро = Рt (1 – 0,000172 t) = 680 (1 – 0,000172∙25) = 677,1 мм рт. ст. Тепер можна визначити абсолютний тиск пари в котлі:
Рабс = 130000 + 677,1∙133,3 = 220257 Па = 0,22 МПа.
Приклад 1.2. Масові долі кисню та азоту в атмосферному повітрі відповідно дорівнюють – 0,232 і 0,768. Визначити об’ємні долі кисню та азоту, газову постійну і молекулярну масу повітря, парціальні тиски кисню та азоту, якщо тиск повітря за барометром складає 760 мм рт. ст. Рішення. Газові постійні кисню та азоту знаходимо за додатком А. Визначаємо газову постійну повітря:
Розраховуємо об’ємні долі компонентів суміші:
Молекулярну масу суміші визначаємо за формулою
або за формулою
Визначаємо парціальні тиски:
Приклад 1.3. Балон с киснем ємністю 20 л знаходиться під тиском 10 МПа при 15°С. Після витрати частки кисню тиск зменшився до 7,6 МПа, а температура до 10°С. Визначити масу кисню, яку витратили. Рішення. Визначаємо початкову та кінцеву масу кисню за рівнянням Клапейрону:
Таким чином витрата кисню складає:
Приклад 1.4. Визначити густину оксиду вуглецю при 20°С і 710 мм рт. ст., якщо при 0°С і 760 мм рт. ст. вона складає 1,251 кг/м 3. Рішення. Запишемо рівняння Клапейрону для двох станів. Згадаємо, що густина – це величина, яка оборотна питомому об’єму. Тоді одержуємо:
Приклад 1.5. Повітря знаходиться в замкнутій посудині ємністю 90 л при тиску 8 бар і температурі 30°С. За рахунок підведення теплоти тиск збільшився до 16 бар. Визначити кількість підведеної теплоти. Розрахунки провести для двох випадків: а) теплоємність повітря враховувати нелінійно залежною від температури; б) теплоємність повітря враховувати незалежною від температури. Визначити похибку розрахунку теплоємності за двома методами. Рішення. Зі співвідношення параметрів ізохорного процесу (газ знаходиться в замкнутому сосуді) визначаємо кінцеву температуру повітря:
Масу повітря, яка знаходиться в сосуді, визначаємо із рівняння Клапейрона (газова постійна R, додаток А):
Для розрахунку теплоємності за першим методом (нелінійна залежність від температури) знаходимо теплоємність повітря в інтервалі температур від 0оС до 30оС та від 0оС до 333оС (додаток Б, табл. Б.2)
Визначаємо середню масову теплоємність повітря при постійному об’ємі для інтервалу температур від 30 до 333оС:
Кількість теплоти, яка підведена до повітря, дорівнює
Для розрахунку теплоємності за другим методом (теплоємність не залежіть від температури) теплоємність повітря розраховуємо за формулою
Газову постійну знаходимо за додатком А. Показник адіабати дорівнює 1,4 (повітря – двохатомний газ). Розраховуємо теплоємність:
Кількість теплоти, яку підведено до повітря, дорівнює
Відносна похибка розрахунку теплоємності за двома методами складає
Приклад 1.6. Повітря об’ємом 0,01 м 3 при тиску 2 бар і температурі 25°С розширюється до тиску 1 бар. Визначити кінцевий об’єм, кінцеву температуру, роботу, яку виконує газ, підведене тепло, якщо розширення здійснюється за: 1) ізотермою, 2) адіабатою, 3) політропою з показником політропи n = 1,3. Рішення. 1) Ізотермічне розширення. Зі співвідношення параметрів ізотермічного процесу визначаємо кінцевий об’єм:
Процес здійснюється при Т=const, тому кінцева температура дорівнює початковій: t2=t1=25 oC. Визначаємо роботу ізотермічного процесу розширення:
Кількість підведеної теплоти згідно з першим законом термодинаміки дорівнює роботі тому, що внутрішня енергія не змінюється. 2) Адіабатне розширення. Адіабатним називають процес, який здійснюється без теплообміну з навколишнім середовищем, тобто Q =0. Кінцевий об’єм визначаємо із співвідношення параметрів процесу (для двоатомного газу показник адіабати дорівнює 1,4):
Кінцева температура повітря зі співвідношення параметрів процесу:
Визначаємо роботу адіабатного процесу розширення:
3) Політропне розширення. Кінцевий об’єм визначаємо із співвідношення параметрів процесу:
Кінцева температура повітря із співвідношення параметрів процесу:
Визначаємо роботу адіабатного процесу розширення:
Визначаємо кількість підведеної теплоти (без урахування впливу температури на теплоємність):
Приклад 1.7. Яку кількість теплоти потрібно витратити для нагріву 2 м 3 суміші газів при постійному надлишковому тиску 2 бар від 100°С до 500°С? Суміш газів складається з 3 кіломолей азоту та 2 кіломолей кисню. Яку роботу при цьому виконує газ? Тиск атмосфери прийняти рівним 760 мм рт. ст. При розрахунках вплив температури на теплоємність не враховувати. Рішення. Спочатку потрібно визначити газову постійну суміші газів. Для цього визначаємо масу азоту та кисню:
Тепер визначаємо газову постійну суміші газів:
Теплоємність суміші газів за умовами незалежності від температури визначаємо за формулою (суміш складається з двохатомних газів, тому k =1,4)
Визначаємо абсолютний тиск, під яким знаходиться суміш газів:
Масу суміші газів визначаємо за допомогою рівняння Клапейрона
Визначаємо кількість теплоти, яку потрібно витратити для нагріву суміші газів від 100°С до 500°С:
Роботу, яку виконує суміш газів визначаємо за формулою
Приклад 1.8. Стан 1,5 кг водяної пари в політропному процесі змінюється від Р1 =0,9 бар і t1 =18°С до Р2 =10 бар і t2 =125°С. Визначити показник політропи, кінцевий об’єм, величину роботи і кількість відведеної теплоти. Теплоємність газу враховувати лінійно залежною від температури. Рішення. Зі співвідношення параметрів політропного процесу одержуємо:
тоді
Кінцевий об’єм визначаємо з рівняння Клапейрона
Роботу процесу визначаємо за формулою
Визначаємо теплоємність водяної пари при постійному об’ємі з урахування лінійної залежності від температури (додаток В):
Визначаємо кількість відведеної теплоти:
Приклад 1.9. 13 кг повітря знаходиться при нормальних умовах. Після проведення процесу температура повітря підвищилась до 400оС. Визначити зміну ентропії повітря при: а) ізохорному процесі, б) ізобарному процесі, в) адіабатному процесі, г) політропному процесі з показником політропи 2,2. Теплоємність повітря враховувати постійною і незалежною від температури. Рішення. Спочатку визначаємо теплоємність повітря при постійному об’ємі та тиску:
Визначаємо зміну ентропії в ізохорному процесі:
Визначаємо зміну ентропії в ізобарному процесі:
Зміна ентропії в адіабатному процесі дорівнює нулю. Визначаємо зміну ентропії в політропному процесі:
Для закріплення матеріалу першого заняття рекомендується самостійно вирішити задачі № 1.1–1.17 (розділ 4.3).
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.150.175 (0.028 с.) |







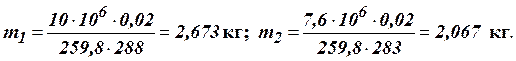



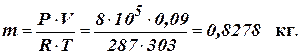



 .
. .
.








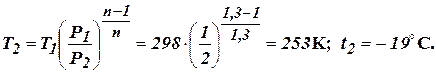



 .
.